В начале 70-х годов прошлого столетия норвежский учёный Хьеллю Клеппе ( Kjell Kleppe ) из лаборатории нобелевского лауреата Хаара Гобинды Хораны ( Har Gobind Khorana ) предложил проводить амплификацию ДНК в условиях in vitro с помощью пары коротких одноцепочечных молекул ДНК― синтетических праймеров. Однако в то время эта идея осталась невостребованной.
В 1983 году Кэрри Б. Мюллисом (Kary Mullis, фирма "Cetus", США) был разработан абсолютно простой метод получения фрагментов ДНК в неограниченном количестве копий. Метод был назван «Полимеразная цепная реакция» (ПЦР). В 1985 г. Кэрри Мюллис впервые опубликовал в американском журнале «Science» статью об открытии ПЦР. Это открытие было названо самым выдающимся открытием последних лет.
В своей статье автор показал простоту и доступность этой реакции, возможность в течение дня из одной молекулы ДНК получать 100 млрд. сходных по структуре молекул. Полимеразная цепная реакция оказалась очень проста в исполнении: для её постановки нужны лишь пробирка, несколько простых реагентов и источник тепла. ДНК, которую необходимо копировать, может представлять собой очень сложную смесь биологических веществ. В качестве источника ДНК подходит любой биологический и патологический материал, капля засохшей крови, обнаруженная на месте преступления, мозг мумии и даже тело мамонта, пролежавшего 40000 лет в вечной мерзлоте, гистологические препараты и гербарий.
Из лабораторий научных институтов метод распространился по всему миру и прочно вошёл в сферу диагностического использования. Диагностика инфекционных болезней любой этиологии, генотипирование микроорганизмов, оценка их вирулентности, определение устойчивости микрофлоры к антибиотикам, генодиагностика и генетическая дактилоскопия, пренатальная диагностика, судебная медицина и криминалистика, палеонтология - вот далеко не полный перечень направлений, где с успехом применяется ПЦР.
Суть метода полимеразной цепной реакции заключается в многократном копировании (амплификации) в пробирке определенных специфических участков ДНК в процессе повторяющихся температурных циклов. Реакция осуществляется с помощью фермента термостабильной Tаq-ДНК-полимеразы. После каждого цикла амплификации ранее синтезированные фрагменты ДНК вновь вступают в реакцию. Благодаря этому происходит многократное увеличение количества специфических фрагментов ДНК, что делает возможным провести детекцию полученной ДНК с помощью различных методов: электрофореза или гибридизационными методами. При этом чувствительность ПЦР-анализа достигает 10 копий ДНК на пробу.
Основным компонентом ПЦР является фермент ДНК-полимераза. В 1955 г. А. Корнберг и его коллеги из Станфордского университета открыли в клетках фермент, который назвали ДНК-полимеразой. ДНК-полимеразы выполняют ряд функций, в том числе обеспечивают репарацию и репликацию ДНК. Эти ферменты способны удлинять короткие олигонуклеотидные затравки (праймеры), присоединяя к 3'-концу дополнительный нуклеотид, но для этого необходимо, чтобы праймер был гибридизован, т. е. связан с комплементарной цепью ДНК, которая называется матрицей. Раствор, в котором происходит эта реакция, должен содержать нуклеозидтрифосфаты, используемые в качестве строительного материала. Нуклеотид, который присоединяет ДНК-полимераза, комплементарен основанию в соответствующем положении матричной цепи. Например, если это А, полимераза присоединяет Т, если матричный нуклеотид – Г, то фермент присоединяет Ц. Многократно повторяя эту реакцию, полимераза способна удлинять 3'-конец праймера до тех пор, пока не достигнет 5 ' -конца матрицы. В ходе репарации и репликации двойной спирали ДНК каждая цепь служит матрицей для синтеза другой цепи.
В 1989 г. в журнал «Science» объявил об открытии молекулы года - термостабильной ДНК-полимеразы, сделавшей возможной автоматизацию ПЦР. В 1990 г. учеными фирмы «Cetus» D.Gelfand и S. Stoffel.
была предложена очищенная Tаq-ДНК-полимераза.
Кэрри Мюллис на первом этапе своего эксперимента разделял цепи ДНК при помощи нагревания, затем проводил гибридизацию олигонуклеотида с комплементарной последовательностью в одной из этих цепей. Эту смесь ДНК делил на четыре пробирки, в каждой из которых присутствовали все четыре типа нуклеотидов, один из них помечался радиоактивным изотопом. Затем добавлял ДНК-полимеразу, которая удлиняла связанный с ДНК олигонуклеотид в каждой пробирке на один нуклеотид. С помощью электрофореза можно было отделить удлиненные олигонуклеотиды от оставшихся и определить, какой из радиоактивных нуклеотидов присоединился к олигонуклеотиду.
По мнению К.Мюллиса, если вместо одного олигонуклеотида использовать два, полученное определение будет гораздо точнее. Два праймера будут расположены с обеих сторон от пары нуклеотидов, которую необходимо идентифицировать. Если синтезировать олигонуклеотиды разного размера, их можно будет отличить друг от друга. Если олигонуклеотиды будут комплементарны разным цепям ДНК, можно будет определить соответствующие последовательности в обеих цепях молекулы. Это был первый шаг на пути открытия ПЦР. В результате было сделано заключение о том, что цепи ДНК в исходной матрице и в удлиненном олигонуклеотиде по последовательности нуклеотидов будут идентичны. В итоге в этой реакции число ДНК-матриц удвоится.
Так возникла идея о многократном повторении одной и той же процедуры. После нескольких циклов, состоящих из наращивания праймеров, отделения продуктов полимеризации, связывания новых праймеров и их наращивания, длина экспоненциально накапливающихся цепей ДНК окажется фиксированной, поскольку их концы будут точно определяться 5'-концами олигонуклеотидных праймеров. Если синтезировать праймеры, связывающиеся с более удаленными друг от друга участками ДНК, можно реплицировать в исходном препарате фрагменты ДНК большей длины. Продуктами реакции всегда будут фрагменты ДНК строго определенной длины.
Тысячи ученых с разными целями производили наращивание олигонуклеотидов с использованием полимераз, и, конечно, кто-нибудь из них должен был заметить возможность полимеразной цепной реакции. Но, по всей видимости, до Кэрри Мюллиса этого никто не заметил.
Когда все было готово, К.Мюллис провел эксперимент из тех, что больше всего нравятся учёным – эксперимент, который ставится в одной пробирке и позволяет получить простой ответ: да или нет. Будет ли ПЦР амплифицировать выбранный участок ДНК? И ответ был получен: да, будет.
В настоящее время используется несколько вариантов методики проведения ПЦР. Многие из первоначальных сбоев и ошибок при постановке этой реакции преодолены.
Через 10 лет, в 1993 году, автор был удостоен Нобелевской премии в области химии за предложение концепции и методики постановки ПЦР.
Строение ДНК
Для понимания сущности полимеразной цепной реакции необходимо вспомнить строение ДНК.
Дезоксирибонуклеиновая кислота (ДНК) – один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. В клетках эукариот (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий) кольцевая или линейная молекула ДНК прикреплена изнутри к клеточной мембране, встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
Первые данные о химических свойствах ДНК появились в 1868 г. К началу 40-х годов ХХ в. было установлено, что молекула ДНК – это линейный полимер.
В 1953 году Джеймс Уотсон и Френсис Крик, основываясь на данных рентгеноструктурного анализа кристаллов ДНК, пришли к выводу, что молекула ДНК состоит из двух полимерных цепей, образуя двойную спираль.
Согласно предложенной ими модели, ДНК построена в виде двойной спирали, состоящей из двух полинуклеотидных цепей, сплетенных друг с другом так, что на каждый виток спирали приходится 10 пар оснований. Каждый нуклеотид, в свою очередь, состоит из пятиуглеродного сахара (дезоксирибозы у ДНК и рибозы у РНК), остатка фосфорной кислоты и одного из четырёх азотистых оснований (рис. 1).
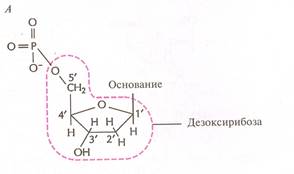
Рис. 1. Схема строения нуклеотида
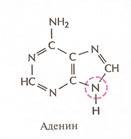
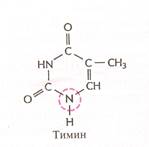
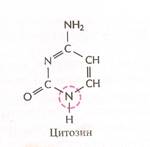
Нуклеотиды соединены между собой ковалентно в длинные цепи, которые в большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) попарно объединяются при помощи водородных связей в структуру, называющуюся двойной спиралью. Водородные связи образуются между обращёнными друг к другу азотистыми основаниями. Основания, входящие в молекулу ДНК, относятся к двум группам: пурины (аденин и гуанин) и пиримидины (тимин и цитозин) (рис. 2). Пурины комплементарны пиримидинам, т.е. аденин образует связи только с тимином, гуанин – с цитозином. Между аденином и тимином образуются двойные водородные связи, между гуанином и цитозином – тройные.
Дезоксиаденозинтрифосфат - дАТФ
| Дезокситимидинтрифосфат - дТТФ
|
Дезоксицитидинтрифосфат - дЦТФ
| Дезоксигуанозинтрифосфат - дГТФ
|
Рис. 2. Строение четырёх нуклеотидов ДНК
Для двухцепочечных молекул ДНК мольные доли аденина и тимина равны, так же как и мольные доли гуанина и цитозина. Этот факт, открытый и изученный Э. Чаргаффом, был одним из важнейших среди тех данных, которые привели к открытию двойной спирали ДНК. Последовательность нуклеотидов в одной цепи однозначно определяет последовательность нуклеотидов в другой цепи. Поскольку водородные связи нековалентны, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться под действием ферментов или при высокой температуре (95ºС).
Остов каждой спирали состоит из регулярно чередующихся фосфатов и сахаров. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3'-гидроксильной группой одной молекулы дезоксирибозы и 5'-фосфатной группой другой.
Асимметричные концы цепи ДНК называются 5' (пять штрих) и 3' (три штрих). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3' концу). По своему химическому строению две цепи молекулы ДНК ориентированы противоположно (цепи «антипараллельны» друг другу, 3'-конец одной цепи связан с 5 '-концом другой, и наоборот) (рис. 3).
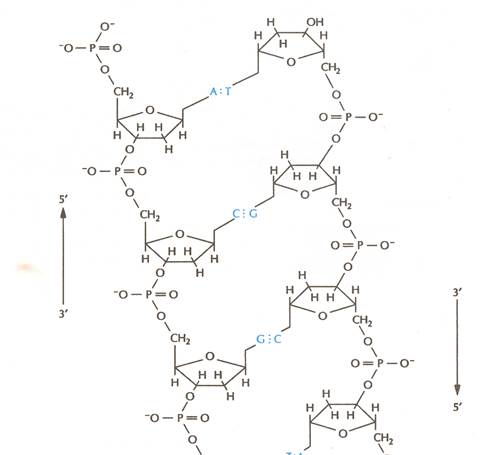
Рис. 3. Образование цепи ДНК
Носитель генетической информации должен удовлетворять двум основным требованиям: воспроизводиться (реплицироваться) с высокой точностью и детерминировать (кодировать) синтез белковых молекул. Модель Уотсона – Крика полностью отвечает этим требованиям.
Дата: 2019-07-31, просмотров: 532.