Вещество используют в медицине как сосудорасширяющее средство и противоядие при отравлениях синильной кислотой (цианидами), также оно применяется в качестве консерванта в пищевой промышленности. Средство уменьшает приток крови к правому предсердию, расширяет периферические вены, уменьшает периферическое сосудистое сопротивление. Кроме того, применение нитрита натрия дает возможность уменьшить кислородную потребность миокарда, улучшить коронарный кровоток. Терапевтическое действие средства подобно амилнитриту, но оно более продолжительно.
· Нитрит натрия также используется в медицине и ветеринарии как сосудорасширяющее, бронхолитическое(расширяет бронхи), снимает спазмы кишечника, используется как слабительное, а также как антидот при отравлении цианидами.
· Проводятся исследования по применению его при серповидной анемии, сердечными приступами и ишемией сердца, аневризмами головного мозга и лёгочной гипертензии у детей.
E250 при приёме в значительном объёме (порядка нескольких граммо) может вызвать серьёзное отравление (образует метгемоглобин), вплоть до летального исхода.
98. Обшая характеристика группы р–элементов VI группы
Элементы кислород О, сера S, селен Se, теллур Те и полоний Ро, входящие в VI A группу называют халькогенами (образующие руды, греч.). Полоний радиоактивный металл. Кислород и сера являются типическими элементами VI A группы; остальные элементы объединяют в подгруппу селена (Se, Te, Po).
В основном состоянии атомы халькогенов имеют конфигурацию ns2np4 с двумя неспаренными р-электронами. Поэтому эти элементы проявляют стремление к дополнению электронами внешнего уровня до октета.
В ряду O – S – Se – Te – Po увеличиваются радиусы атомов, понижаются величины энергии ионизации и относительная электроотрицательность. Следовательно, от кислорода к полонию в подгруппе понижается окислительная активность элементов. Неметаллические свойства халькогенов при переходе от кислорода к полонию ослабляются. Кислород и сера – типичные неметаллы, у теллура появляются металлические свойства, а полоний – металл.
Для элементов VI A группы способность к комплексообразованию выражена слабо. С увеличением порядкового номера у элементов возрастают координационные числа. Для серы и селена они равны 3 и 4, у теллура – 6 и даже 8. Это связано с тем, что при переходе от серы к теллуру в образовании σ- и π-связей всё большую роль начинают играть d- и f-орбитали.
99. Кислород. Общая характеристика.
Атом кислорода в основном состоянии имеет электронную кофигурацию внешнего уровня 2s22p4 c двумя неспаренными электронами и двумя неподелёнными электронными парами. По своей электроотрицацельности (3,5) кислород занимает 2-ое место после фтора. Это означает, что во всех своих соединениях (кроме фторидов) кислород может находиться только в состоянии с отрицательной степенью окисления.
Кислород самый распространённый элемент на Земле, на его долю приходится 49,5% общей массы земной коры. Считается, что в процессе образования планеты Земля кислород был полностью связан в соединения. Наличие его в атмосфере обусловлено жизнедеятельностью растений – эндотермической реакцией фотосинтеза, протекающей за счёт энергии солнечного излучения: 6СО2 + 6Н2О = С6Н12О6 + 6О2.
Существуют две аллотропные модификации элемента кислорода: это устойчивая форма простого вещества О2 дикислорода (молекулярный кислород) и трикислород О3 – озон.Кислород – бесцветный газ без запаха и вкуса. Межмолекулярные связи в кислороде слабы, и он конденсируется в голубую жидкость лишь при -1830С. Тпл = - 219 0С. Энергия связи в устойчивой молекуле О2 довольно велика 494 кДж/моль.
Получение О2
В промышленности кислород получают ректификацией жидкого воздуха. Первым улетучивается азот (Ткип= -195,80С). Хранят кислород в баллонах голубого цвета под давлением 15 МПа.
В лабораторных условиях кислород получают проводя реакции внутримолекулярного окисления-восстановления солей кислородсодержащих кислот и оксидов или диспропорционирования пероксидов:
2ВаО2 = 2ВаО + О2 (8000С); 2KMnO4 = K2MnO4 + MnO2 + O2 (t0)
2H2O2 = 2H2O + O2 (t0, MnO2); 2KClO3= 2KCl + 3O2 (t0, MnO2)
Химические свойства
Молекула О2 устойчива, энергия связи в устойчивой молекуле О2 довольно велика 494 кДж/моль. Однако кислород обладает высокой химической активностью, особенно при нагревании (200 – 4000С) и в присутствии катализатора. Реакции с участием кислорода, как правило, экзотермичны и во многих случаях протекают в режиме горения – самоподдерживающегося процесса, сопровождающегося выделением теплоты и света в форме пламени. Он взаимодействует непосредственно со всеми простыми веществами, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, образуя оксиды. Наиболее активные металлы (K, Rb, Cs) образуют с ним надпероксиды ЭО2, а Na пероксид Na2O2. Кислород окисляется только при взаимодействии с фтором.
4Р + 5О2 = Р4О10; С + О2 = СО2; S + O2 = SO2; O2 + 2Mg = 2MgO;
O2 + 2Ca = 2CaO; 4Li + O2 = 2Li2O; O2 + 2Na = Na2O2; K + O2= KO2
В некоторых случаях скорость взаимодействия так велика (цепные реакции), что происходит взрыв. Например, со взрывом реагируют смеси кислорода с водородом, метаном, оксидом углерода (II):
2Н2 + О2 = 2Н2О + Q; CH4 + 2O2 = CO2 + 2H2O + Q; CO + 0,5O2 = CO2 + Q.
Взрывоопасны смеси воздуха с угольной пылью, с мукой и другими горючими взрывоопасными веществами.
В земных условиях именно взаимодействие с атмосферным кислородом того или иного вещества определяет возможность его существования, использования, хранения. Так, например, триметилалюминий {Al(CH3)3} самовозгорается на воздухе и его существование в контакте с воздухом невозможно; углеводороды не самовозгораются, но горят на воздухе и могут быть использованы как источник энергии; серебро изолото не реагируют с кислородом и поэтому встречаются в самородном состоянии, но многие металлы (щелочные, щелочноземельные, лантаноиды) быстро окисляются и могут храниться только без доступа воздуха.
ОЗОН
(Озон открыл в 1840 году Х. Шёнбейн)
Озон (О3) – газ синего цвета, в жидком состоянии тёмносиний, в твёрдом сине-фиолетовый. По своим свойствам сильно отличается от молекулярного кислорода. Поскольку молекула О3 обладает большей полярностью и поляризуемостью, озон имеет более высокую температуру кипения (-111,90С), чем кислород. Этим же объясняется большая интенсивность окраски озона и лучшая его растворимость в воде.
Длина связи в молекуле ближе к длине двойной связи О = О (0,121 нм), чем к одинарной О – О (0,149 нм), что свидетельствует о неравноценности атомов и позволяет приписать центральному атому степень окисления +4. Озон термодинамически неустойчив: 2О3 = 3О2 ∆G0298 = - 325 кДж/моль.
В природе он образуется при грозовых разрядах и за счёт фотохимических реакций, идущих под действием ультрафиолетового излучения Солнца. Образование озона в атмосфере происходит в результате реакциий:
О2→ О + О, О + О2 → О3. Поэтому в верхних слоях атмосферы существует область с повышенным содержанием озона – озоновый слой, который имеет исключительно важное экологическое значение: озоновый слой задерживает наиболее губительную для живых организмов и растений часть УФ радиации Солнца с длиной волны 300 нм, наряду с СО2 озон поглощает ИК излучение Земли, препятствует её охлаждению.
В лабораториях получают озон действием тихого электрического разряда на сухой кислород.
О3 – сильнейший окислитель, в реакциях с его участием обычно образуется О2, например:
2Ag + O3 = Ag2O + O2; PbS + 4O3 = PbSO4 + 4O2;
Для количественного определения озона используют реакцию: 2KI + O3 + H2O = I2 + 2KOH + O2.
Сродство к электрону у озона около 180 кДж/моль, поэтому он может переходить в озонид-ион О3‾. В частности, при действии озона на щелочные металлы образуются озониды: К + О3 = КО3. Озониды это соединения, состоящие из положительных ионов-металлов и отрицательных ионов О3‾.
Как сильный окислитель озон используется для очистки питьевой воды, для дезинфекции воздуха, в различных синтезах (получение камфоры, ванилина и др. веществ).
100. Водорода пероксид Н2О2, его КО и ОВ характеристика, применение в медицине. Соединения кислорода с фтором. Биологическая роль кислорода. Химические основы применения кислорода и озона, а также соединений кислорода в медицине и фармации.
Поскольку связь в молекуле О2 кратная, возможно существование соединений, в которых одна из связей О – О сохраняется. Эта так называемая пероксидная группировка существует в пероксиде водорода Н2О2, пероксиде натрия Na2O2 и целом ряде других соединений. Присоединяя два электрона молекула О2 превращается в пероксид-ион О22-, в котором атомы связаны одной двухэлектронной связью.
Энергия связи О – О (210 кДж/моль) почти в два раза меньше энергии связи О – Н (468 кДж/моль).
Из-за несимметричного распределения связей Н – О молекула Н2О2 сильно полярна. Между молекулами пероксида возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода – сиропообразная жидкость (ρ = 1,44 г/мл) с довольно высокой температурой кипения (Тпл = 0,410С; Ткип = 150,20С). Она имеет бледно-голубую окраску. С водой смешивается в любых отношениях благодаря возникновению новых водородных связей. В лабораториях пользуются обычно 3% и 30% растворами пероксида (последний называют пергидролем).
В водных растворах Н2О2 – слабая кислота: Н2О2 + Н2О = Н3О + + НО2‾ (рК=11,62).
Чаще всего протекают реакции, в которых в пероксиде водорода рвётся связь О – О. В этом случае пероксид проявляет свойства окислителя:
2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O;
H2O2 + FeSO4 + H2SO4 = Fe2(SO4)3 + 2H2O;
4 H2O2 + PbS = PbSO4 + 4H2O.
При взаимодействии с очень сильными окислителями пероксид проявляет свойства восстановителя:
5 H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + K2SO4 + 2MnSO4 + 8H2O
(данную реакцию используют при химическом анализе для определения содержания Н2О2 в растворе).
Пероксидная группа из двух атомов кислорода – О – О – входит в состав очень многих веществ. Такие вещества называют пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.), которые можно рассматривать как соли пероксида водорода. Кислоты, содержащие пероксидную группу, называют пероксокислотами (или надкислотами), их примерами являются пероксомонофосфорная и пероксодисерная кислоты:
О – ОН O O
О = Р – ОН НО – S – O – O – S – OH
ОН O O
Все пероксидные соединения являются окислителями (часто более сильными, чем Н2О2). При небольшом нагревании они разлагаются с выделением кислорода.
Пероксид водорода используют, главным образом, в качестве окислителя при отбеливании тканей, дезинфекции, как антисептик.
101. Сера. Общая характеристика. Способность к образованию гомоцепей.
Общая характеристика.
Сера находится в VI группе А подгруппе.
В земной коре сера находится в виде различных минералов, образующих богатые залежи. Нередко встречается самородная сера (т.е. простое вещество S8). Так же распространены соединения серы с металлами. Многие из них наиболее ценны для получения металлов: свинцовый блеск (PbS), медный блеск (CuS), пирит (железный колчедан FeS2)-образующий кубичекие кристаллы цвета латуни, служит главным сырьём для получения серной кислоты.
Большое распространение имеют некоторые сульфаты. Минералы гипс и ангидрид (кристаллогидрат CаSO4 * 2H2O и безводный сульфат кальция) образуют местами целые горы. Сульфаты Mg и Na содержатся в морской воде. Прозрачные кристаллы образуют сульфат стронция SrSO4 – целестин. Барит, или тяжёлый шпат BaSO4 широко применяется для производства белил и как наполнитель в бумажной и резиновой промышленности (слой барита наносится на фотобумагу).
Сера содержится в каменном угле и при его сжигании попадает в атмосферу. В воздухе постоянно присутствует SO2. Сера всегда имеется в белках, т.к. аминокислоты цистеин и метионин содержит серу. (в теле человека серы содержится примерно 120г)
Природная сера состоит из 4-ёх устойчивых изотопов. (95% приходится на изотоп 3216S.
По химическим свойствам сера не проявляет значительного сходства с O2. С кислородом сера схожа тем, что имеет валентность 2 в соединениях с большинством химических элементов. При этом важно помнить, что в соединениях с кислородом и серой кислород остаётся двухвалентым, а сера может быть четырёх- и шестивалентной.
Высшие валентные состояния серы возможны благодаря наличию свободного 3d-подуровня, на орбитали которого переходят один или два электрона атома S с 3s- и 3p- подуровней:
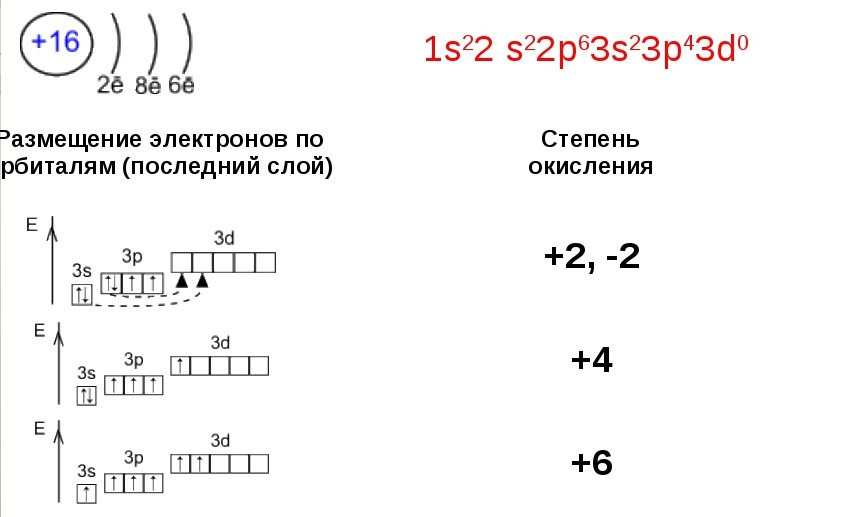
S(II): H2S, СS2
S(IV): SO2, SCl4
S(VI): SO3, SF6
Способность к образованию гомоцепей.
Одно из важных и характерных свойств атомов серы – способность образовывать цепочки:
Сера при определённых условиях даёт цепочки из сотен тысяч атомов. Два связанных между собой атома серы –S – S – часто служат перемычкой внутри белковой молекулы. 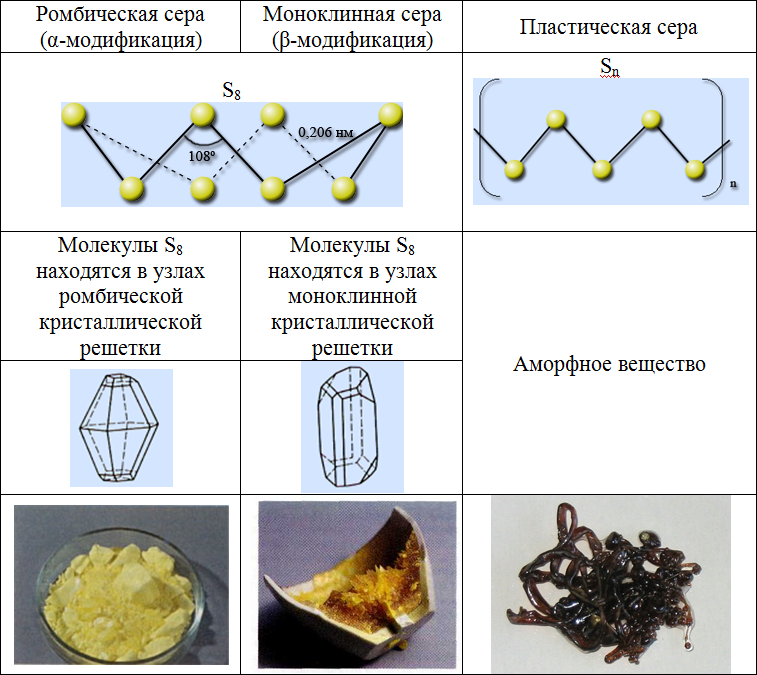 Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S – S –. Устойчивость цепей объясняется тем, что связи – S – S – оказываются прочнее, чем связь в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S – S –. Устойчивость цепей объясняется тем, что связи – S – S – оказываются прочнее, чем связь в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток.
Молекула S8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Соединения серы в отрицательных степенях окисления. Сероводород, его КО и ОВ свойства. Сульфиды металлов и неметаллов, их растворимость в воде и гидролиз. Полисульфиды, КО и ОВ характеристика, устойчивость.
Сероводород – бесцветный газ, имеет характерный запах гниющего белка (“запах тухлых яиц”). В воде при 20 0С растворяется 2,5 л сероводорода в 1 литре воды. Водный раствор сероводорода проявляет кислотные свойства и называется сероводородной кислотой или сероводородной водой. Сероводородная кислота – слабая, двухосновная и бескислородная кислота.
Рассмотрим свойства сероводорода в двух аспектах: а) окислительно-восстановительные свойства; б) кислотно-основные.
Окислительно-восстановительные свойства. В молекуле сероводорода атом серы проявляет низшую степень окисления, равную –2. Поэтому сероводород проявляет свойства восстановителя:
· 2H2S + O2 (недост.) = 2S + 2H2O
· 2H2S + 3O2 = 2SO2 + 2H2O
· H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
· H2S + Br2 = S↓ + 2HBr
· H2S + I2 = S + 2HI
· H2S + H2SO4 (конц.) =S↓ + SO2↑ + 2H2O (комн. тем.),
· H2S + 3H2SO4 (конц.) = 4SO2↑ + 4H2O (кип.),
· H2S + 8HNO3 (конц.) = H2SO4 + 8NO2↑ + 4H2O (кип.),
· H2S + 2HNO3 (конц. хол.) = S↓ + 2NO2↑ + 2H2O,
· 3H2S + 8HNO3 = 3H2SO4 + 8NO + 4H2O,
· 3H2S + 4HClO3 = 3H2SO4 + 4HCl,
· H2S + 4Br2 + 4H2O = H2SO4 + 8HBr.
Недостаточные количества даже сильных окислителей, а также слабые окислители окисляют ион S2- до S0:
· 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O,
· 3H2S + K2Cr2O7 + 4H2SO4 = 3S↓ + Cr2(SO4)3 + K2SO4 + 7H2O,
· 2H2S + SO2 = 3S + 2H2O,
· H2S + I2 = S + 2HI.
Рассмотрим теперь свойства сероводородной кислоты. Сероводородная кислота, являясь кислотой двухосновной, диссоциирует ступенчато:
· H2S ↔ H+ + HS-,
· HS‾ ↔ H+ + S2-.
Константа второй ступени диссоциации так мала, что практически не влияет на кислотные свойства Н2S, но определяет чрезвычайно большую склонность иона S2- к гидролизу:
· S2- + H2O ↔ HS1- + OH1- и далее HS1- + H2O ↔ H2S + OH1-.
Поэтому растворы сульфидов имеют сильнощелочную реакцию.
Сероводородная кислота проявляет все свойства кислот: изменяет окраску индикаторов, взаимодействует с металлами, основными оксидами, щелочами и солями.
Например:
· H2S + Mg = MgS + H2↑,
· H2S + MgO = MgS + H2O
· H2S + NaOH = NaHS + H2O,
· H2S + 2NaOH = Na2S + 2H2O,
· H2S + CuSO4 = CuS↓ + H2SO4.
Сероводородной кислоте соответствуют два вида солей: а) кислые – гидросульфиды (KHS), б) средние (Na2S). Гидросульфиды растворимы в воде и существуют только в растворах. Сульфиды щелочных и щелочноземельных металлов и аммония растворимы в воде, а сульфиды остальных металлов не растворимы. Растворимые сульфиды в водных растворах подвергаются гидролизу, среда раствора – щелочная:
· K2S + H2O ↔ KHS + KOH,
· S2- + H2O ↔ HS ‾ + OH‾.
Катионы очень слабых оснований (Al3+ или Cr3+) не могут быть осаждены в водном растворе в виде сульфидов вследствие полного гидролитического разложения сульфидов этих металлов:
· 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl,
· Cr2O3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑.
Сульфиды некоторых металлов не растворимы в кислотах неокислителях, но растворимы в концентрированной азотной кислоте или в царской водке (смесь азотной и соляной кислот в соотношении 1: 3):
· 3CuS + 8HNO3 = 3CuSO4 + 8NO + 4H2O,
· 3HgS + 8HNO3 + 6HCl = 3HgCl2 + 3H2SO4 + 8NO + 4H2O.
Сульфиды неметаллов:
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
· CS2+2Н2O=CO2+2H2S
SiS2 гидролизуется водой:
· SiS2 + 2H2O=SiO2↓+ 2H2S
As2S3 разлагается перегретым па́ром:
· As2S3 + 3H2O→ As2O3 + 3H2S (t=200-250)
ПОЛИСУЛЬФИДЫ — многосернистыесоединения общей формулы Me2Sn, например, полисульфид аммония (NH4)2Sn. В структуре этих соединений имеются (димерные/полимерные) цепи атомов —S—S(n)—S—.
Известны многочисленные полисульфиды водорода, общей формулы H2Sn, где n меняется от 2 (персульфид водорода) до 23. Это желтые маслянистые жидкости; по мере увеличения содержания серы окраска изменяется от жёлтой до красной.
Полисульфиды щелочных металлов образуются при взаимодействии элементарной серы с соответствующим сульфидом (при сплавлении или в концентрированном растворе):
· Na2S+nS=Na2S1+n
Обычно в молекулах полисульфидов число атомов серы изменяется от 2 до 8, известно лишь одно соединение с n = 9, это (NH4)2S9. Наиболее распространены полисульфиды с двумя атомами серы (дисульфиды). Эти полисульфиды можно рассматривать как аналоги соответствующих пероксидов — персульфиды. Для полисульфидов, подобно пероксидам, характерны окислительные и восстановительные свойства:
· Na2S2 + SnS = SnS2 + Na2S (S2- — окислитель);
· (NH4)2S2 + SnS = (NH4)2SnS3
· 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (S2− — восстановитель).
При взаимодействии с кислотами разлагаются с образованием сульфанов, серы и H2S. Также, как и пероксиды, персульфиды способны диспропорционировать:
· Na2S2 → Na2S + S (S2−— окислитель, восстановитель);
· 2FeS2 → 2FeS + 2S (аналогично).
Присоединение серы к солям синильной кислоты лучше всего протекает при действии на них легко отдающего серу полисульфида аммония по схеме (для двусернистого аммония):
· KCN + (NH3)2S2 = KNCS + (NH4)2S
Химически полисульфиды весьма нестойки; при нагревании разлагаются с образованием сульфидов.
103. Соединения серы( IV ) – оксид, хлорид, хлористый тионил, сернистая кислота, сульфиты и гидросульфиты. Их КО и ОВ свойства. Восстановление сульфитов до дитионистой кислоты и дитионитов. Взаимодействие сульфитов с серой с образованием тиосульфатов. Свойства тиосульфатов: реакция с кислотами, окислителями (в том числе с иодом), катионами – комплексообразователями. Политионаты, особенности их строения и свойства.
Оксид серы(IV)

Оксид серы (IV) – SO2 – бесцветный газ с резким запахом, термически устойчивый. При 200С в 1 литре воды растворяется 40 л диоксида серы.
Оксид серы (IV) – кислотный оксид. При взаимодействии с водой он образует сернистую кислоту, а реагируя с растворами щелочей – соли:
· SO2 + H2O ↔ H2SO3,
· SO2 + NaOH = NaHSO3,
· SO2 + 2NaOH = Na2SO3 + H2O.
При взаимодействии с основными оксидами также образуются соли:
· SO2 + CaO = CaSO3.
Оксид серы (IV) и сернистая кислота содержат в своей молекуле своей молекуле атом серы в промежуточной степени окисления (+4), поэтому для этих соединений характерны окислительно-восстановительные свойства.
Окислительные свойства проявляются в реакциях с сильными восстановителями:
· Na2SO3 + 2Na2S + 3H2SO4 = 3S + 3Na2SO4 + 3H2O,
· SO2 + 2H2S = 3S + 2H2O,
· SO2 + C = S + CO2 (t = 600 0C),
· SO2 + 2CO = S + 2CO2,
· SO2 + 6H0 (Pt-чернь) → H2S + 2H2O.
Восстановительные свойства соединений серы (IV) проявляются при взаимодействии с сильными окислителями:
· 2SO2 + O2 = 2SO3,
· SO2 + O3 = SO3 + O2,
· SO2 + 3F2 = SF6 + O2,
· SO2 + Сl2 + 2H2O = H2SO4 + 2HCl,
· SO2 + 2HNO3(конц. гор.) = H2SO4 + 2NO2↑,
· 5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4.
· 5Na2SO3 + 2KMnO4 + 3H2SO4 =5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
Сульфиты при нагревании диспропорционируют:
· 4Na2SO3 → Na2S + 3Na2SO4 (t › 600 0C)
Оксид серы может участвовать в реакциях без изменения степени окисления атома серы:
· SO2 + MgO = MgSO3,
· SO2 + 2NH3∙H2O (конц.) = (NH4)2SO3,
· SO2 + NH3∙H2O (разб.) = NH4HSO3.
Оксид серы соединение токсичное, так как проявляет окислительные свойства в реакциях с восстановителями, а в реакциях с окислителями – восстановительные. Существует биохимический механизм детоксикации сульфит-иона с участием фермента сульфитоксидазы.
Оксид серы (IV) накапливается в атмосфере и особенно сильно в промышленных районах. При высокой влажности воздуха образуется туман, содержащий сернистую и серную кислоты, сажу и пыль. Поэтому в отсутствии ветра над отдельными районами появляется токсический смог, который вызывает поражения легких и даже гибель людей.
Получение SO2:
а) в промышленности – обжиг пирита:
· 4FeS2 + 11O2 = 8SO2 + 2Fe2O3.
б) в лаборатории:
· Na2SO3 + H2SO4 = SO2↑ + Na2SO4 + H2O,
· Cu + 2H2SO4 = SO2↑ + CuSO4 + H2O.
Применение: SO2 используется в производстве серной кислоты, для отбеливания тканей, как дезинфицирующее средство, консервирующее средство при производстве сухофруктов. Газ SO2 убивает многие микроорганизмы, поэтому его используют для уничтожения плесневых грибков в сырых помещениях, подвалах, погребах, бродильных чанах, винных бочках. Использую диоксид серы для лечения домашних животных от чесотки.
ТЕТРАХЛОРИД СЕРЫ (SCl4) — неорганическое соединение серы и хлора с формулой SCl4, бесцветные или бледно-жёлтые кристаллы при -35°С, выше -31°С — тёмно-бурая жидкость, разлагается при температуре выше -15°С.
Химические свойства
Разлагается при нагревании:
· SCl4 = SCl2 + Cl2
Реагирует с влагой из воздуха:
· SCl4 + H2O = SOCl2+2HCl
Реагирует с водой:
· SCl4+2H2O = SO2+4HCl
Реагирует с азотной кислотой:
· SCl4 + 2HNO3 + 2H2O = H2SO4+2NO↑ +4HCl
Реагирует с щелочами :
· SCl4 + 6NaOH = Na2SO3+4NaCl+3H2O
ТИОНИЛХЛОРИД (хлористый тионил) SOCl2 — хлорангидрид сернистой кислоты. Бесцветная дымящаяся на воздухе жидкость с удушающим запахом. Молекула тионилхлорида имеет пирамидальное строение.
При нагревании выше температуры кипения тионилхлорид начинает разлагаться с образованием S2Cl2, SO2, Cl2. Выше 440 °C наблюдается полный распад соединения.
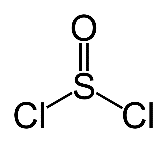
В воде разлагается на диоксид серы и хлороводород:
· SOCl2 + H2O = SO2↑ + 2HCl
Широко применяется в органическом синтезе в качестве хлорирующего агента, например, для получения хлорангидридов карбоновых кислот и алкилгалогенидов:
· RCOOH+SOCl2→RCOCl+SO2 + HCl
· ROH+SOCl2→RCl+SO2+HCl
Тионилхлорид можно получить по следующим реакциям:
· SO3 + SCl2 → SOCl2 + SO2
· SO2 + PCl5 → SOCl2 + POCl3
· SO2 + Cl2 + SCl2 → 2SOCl2
· SO3+Cl2+2SCl2 → 3SOCl2
СЕРНИСТАЯ КИСЛОТА
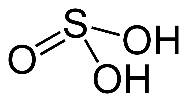
Водный раствор диоксида серы называется сернистой кислотой. Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2. Эта кислота существует только в растворе:
· SO2 + H2O ↔ H2SO3 ↔ H+ + HSO3 - ↔ 2H+ + SO3 2-
Является кислотой средней силы, диссоциирует ступенчато:
· H2SO3 ↔ H + + HSO3 ‾,
· HSO3‾ ↔ H + + SO3 2 ‾
Окислительные свойства проявляются в реакциях с сильными восстановителями:
· H2SO3 + 2H2S = 3S↓ + 3H2O
Восстановительные свойства сернистой кислоты проявляются при взаимодействии с сильными окислителями:
· 2H2SO3 + O2 = 2H2SO4
· H2SO3 + Br2 + H2O = H2SO4 + 2HBr
Для сернистой кислоты характерны все реакции кислот:
· H2SO3 + KOH = KHSO3 + H2O,
· H2SO3 + 2KOH = K2SO3 + 2H2O,
· H2SO3 + Na2SiO3 = Na2SO3 + H2SiO3↓,
· H2SO3 + Na2CO3 = Na2SO3 + H2O + CO2↑.
Дата: 2019-07-30, просмотров: 532.