Классификация нарушений ритма сердца. Особенности клинических проявлений. Принципы диагностики нарушений ритма сердца.
234-240 стр. методички
Аритмии сердца – это любой сердечный ритм, не являющийся регулярным синусовым ритмом нормальной частоты (60-90 уд/мин), а также нарушение проводимости электрического импульса по разным отделам проводящей системы сердца.
| Нарушения образования импульса | Нарушения проводимости | Комбинированные аритмии |
I. Патология САУ
 Синусовая тахикардия Синусовая тахикардия
 Синусовая брадикардия Синусовая брадикардия
 Синусовая аритмия Синусовая аритмия
 Миграция источника ритма
II. Эктопические ритмы Миграция источника ритма
II. Эктопические ритмы
 Экстрасистолия Экстрасистолия
 Пароксизмальная тахикардия Пароксизмальная тахикардия
 Трепетание предсердий Трепетание предсердий
 Мерцание предсердий Мерцание предсердий
 Трепетание и мерцание желудочков Трепетание и мерцание желудочков
|  Синоатриальная блокада Синоатриальная блокада
 Предсердная блокада Предсердная блокада
 Атриовентрикулярная блокада Атриовентрикулярная блокада
 Внутрижелудочковая блокада (ножек или ветвей пучка Гиса) Внутрижелудочковая блокада (ножек или ветвей пучка Гиса)
|  Синдром слабости синусового узла (синдром Шорта) Синдром слабости синусового узла (синдром Шорта)
 Синдром предвозбуждения желудочков (WPW, CLC). Синдром предвозбуждения желудочков (WPW, CLC).
 Синдром замедленной реполяризации желудочков Синдром замедленной реполяризации желудочков
 Парасистолии Парасистолии
 Ускальзывающие (выскальзывающие) сокращения и ритмы Ускальзывающие (выскальзывающие) сокращения и ритмы
|
КЛАССИФИКАЦИЯ НАРУШЕНИЙ РИТМА СЕРДЦА
(по Katz L.,Pick A.,1953 в модификации Дощицина В.Л.)
ПРОГРАММА ОБСЛЕДОВАНИЯ БОЛЬНОГО С НАРУШЕНИЕМ СЕРДЕЧНОГО РИТМА
1. Расспрос:
- жалобы,
- анамнез заболевания,
- анамнез жизни (семейный, профессиональный, вредные привычки).
2. Осмотр:
- выявление патологии сердца и другой патологии внутренних органов,
- диагностика аритмии.
3. ЭКГ в 12 отведениях и анализ имеющихся у больного ЭКГ.
4. Эхокардиография.
| Диагностика патологии сердца 5. Суточное мониторирование ЭКГ. 6. Проба с физической нагрузкой. 7. Чреспищеводное ЭФИ. 8. Внутрисердечное ЭФИ. 9. МРТ с оценкой сократимости миокарда и анатомии коронарных сосудов 10. КАГ | Диагностика патологии внутренних органов 5. желудочно-кишечного тракта; 6. ЦНС и вегетативной нервной системы; 7. патологии легких; 8. других органов и систем. |
Суточное мониторирование ЭКГ – 24, 48, 72 ч
Абляция зоны аритмии – особенно у молодых людей устраняет причину.
Суточное ЭКГ мониторирование по методу Холтера: Развитие пароксизма желудочковой тахикардии по данным суточного мониторирования ЭКГ начинается с желудочковой экстрасистолии
Блокады сердца
1.Атриовентрикулярные блокады – нарушение проведения электрического импульса от предсердий к желудочкам.
АВ-блокада I степени: удлинение интервала P - Q более 0,20 с.
Атриовентрикулярная блокада II степени
АВ-блокада III степени
Полное прекращение проведения импульса от предсердий к желудочкам, в результате предсердия и желудочки возбуждаются независимо друг от друга.
Предсердия - регулярными импульсами, исходящими из синусового узла
Источник возбуждения желудочков – АВ-соединение или проводящая система желудочков
Дефиниции миокардита
II Миокардит – поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной или протозойной инвазии, химических или физических факторов, а также поражения, возникающие при аллергических и аутоиммунных заболеваниях – дифтерический миокардит (непосредственное поражение).
Инфекционный агент
1 и 2 действуют на миокард, вызывая гибель кардиомиоцитовà усиление апоптозаà иммунная реакцияà нарушение глобальной и локальной сократимостиà гемодинамические нарушения.
Апоптоз кардиомиоцитов можно рассматривать как общий механизм повреждения миокарда при тяжёлом течении миокардита у человека.
Классификация
Далласская классификация – морфологические критерии (количество биоптатов> 17)
- Активный миокардит
-характеризуется воспалительной клеточной инфильтрацией и признаками некроза или повреждения миоцитов, не характерными для ишемических повреждений.
- Пограничный миокардит
- имеются менее выраженные признаки воспалительной клеточной инфильтрации и отсутствует повреждение миоцитов.
- Воспалительная инфильтрация
- Лимфоцитарная
- Эозинофильная
- Гранулематозная
- Воспалительная реакция:
- Слабая
- Умеренно выраженная
- Тяжелая
- Распространенность воспалительной реакции:
- Фокальная, сливающаяся
- Диффузная.
K.L. Baughman предлагает делить миокардиты на первичные (идиопатические) и вторичные. К первичным миокардитам рекомендуется относить гигантоклеточный, идиопатический, гранулематозный и лимфоцитарный миокардиты, вирусная этиология развития которых вероятна. Вторичные, или ассоциированные, миокардиты предлагается делить по этиологическому принципу на инфекционные, аллергические, токсические и аутоиммунные.
Клиника.
В типичной ситуации для миокардита характерны:
- Продромальный период, который проявляется неспецифическими симптомами, сопровождается слабостью и субфебрилитетом
- Период клинического манифеста, который проявляется загрудинными болями, слабостью и симптомами недостаточности кровообращения
- Период выздоровления характеризуется ослаблением симптоматики недостаточности кровообращения. В большинстве случаев симптомы недостаточности кровообращения исчезают полностью, однако у некоторых больных они сохраняются и доминируют
- Для всех больных характерна астения
Клиника:
- типичная(слайд)
- атипичная
Диагностика миокардита
В связи с отсутствием патогномоничных симптомов заболевания при обследовании больных с подозрением на миокардит особое внимание уделяется инструментальным и лабораторным методам.
Лечение.
Режим нагрузок
- исключение аэробных и интенсивных нагрузок
- нагрузка не должна вызывать усиление симптомов недостаточности кровообращения (чувство комфорта)
- при сохранении на ЭХО-КГ дисфункции ЛЖ – исключается прений уровень нагрузок
- возможная роль дыхательных упражнений
Этиотропная терапия
Период репликации вируса, наиболее уязвимый для специфической противовирусной терапии, занимает короткий временной интервал в начальной стадии заболевания. Но даже в этот короткий период использовать этиотропную противовирусную терапию невозможно из-за отсутствия специфических препаратов против большинства кардиотропных вирусов Показано, что интерферон-В наряду с прямым виростатическим эффектом препятствует распространению вируса за счет активации клеточного иммунитета. Терапия интерферонов-В (18 млн ед в нед., 24) у больных с энтеро- и аденовирусной инфекцией в миокарде без морфологических признаков активного или пограничного миокардита приводила к элиминации вирусов и улучшению глобальной сократительной способности ЛЖ.
Терапия интерферонами
Механизм – применение ИФ-α по 3.000.000ЕД/м3х3р/неделю у лиц с доказательным вирусным миокардитом приводит через 2 года к увеличению ФВ и большей продолжительности выполнения нагрузки по сравнению с этими же показателями в группе базовой терапии (уровень доказательности - С)
Иммунодепрессивная терапия
Механизм – терапия преднизолоном не привела к снижению смертности
Нет доказательств эффективности преднизолона при вирусных миокардитах
Принято считать, что иммуносупрессивная терапия эффективна при лечении миокардитов, развившихся при аутоиммунных заболеваниях, коллагенозах, у больных с хронически протекающими вирус-негативными воспалительными кардиомиоматиями (уровень доказательности – С)
Статины
Механизм – результаты ККИ позволяют предполагать, что добавление аторвастатина в дозе 20 мг к терапии миокардитов снижает выраженность воспалительной реакции и замедляет ремоделирование миокарда (уровень доказательности – С).
Базовое применение препаратов, используемых в лечении ХСН:
Ингибиторы АПФ
Механизм – иАПФ достоверно замедляют ремоделирование сердца при миокардитах, что позволяет рекомендовать применять иАПФ у пациентов с острым миокардитом для контроля над прогрессом ремоделирования, с осторожностью под контролем АД (уровень доказательности – I B).
2. 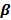 -адреноблокаторы (клинические исследования не проводились)
-адреноблокаторы (клинические исследования не проводились)
Механизм – в экспериментальных работах выявлен негативный эффект БАБ метапролола у мышей с моделью вирусного миокардита. Применение карведилола было эффективно...
3. Спиронолактоны (спиронолактон в дозе 25 мг), АРА (при непереносимости ИАПФ), диуретики (симптоматически, преимущественно торасемид)
Препараты, направленные на поддержку гемодинамики:
- Возможно применение положительных инотропных препаратов (применение дигоксина возможно только в минимальных дозах – мониторинг ритма обязателен) и периферических вазодилататоров
- В остром периоде при развитии угрожающих жизни нарушениях ритма, возможна имплантация кардиовертерадефибрилятора
Прогноз
Не существует четкой прямой связи:
- Между выраженностью клинической картины и отдаленным прогрнозом
- Между гистопатологическим вариантом миокардита и отдаленным прогнозом (кроме случаев гигантоклеточного миокардита)
В случаях подтверждения актвного миокардита в биоптатах выживаемость через 4, 3 года составила 44%.
Существенно лучший прогноз наблюдается при пограничном миокардите.
Лечение: 1-6 симптоматическая терапия (метаболическая терапия – триметацидин, милдронат...). если есть возможность, то назначать.
ИФ – менее эффективно
- Патогенетическая: НПВС (неэффективны), ГК(иммунодепрессивные), иммунодепрессанты, плазмаферез
+ статины (!)
- Симптоматическая: (+ ИАПФ, БАБ, спиронолактон, АРА)
Сердечные гликозиды (нет)
Клиника.
Наличие и выраженность признаков определяют клиническую картину порока.
• Прямые или «клапанные» признаки, обусловленные нарушением функции митрального клапана.
• Косвенные или «левосердечные» признаки, обусловленные компенсаторной гиперфункцией левого желудочка и левого предсердия с последующим развитием дилатации и гипертрофии.
• Признаки «пассивной» легочной гипертензии.
• Признаки застойных явлений в большом круге кровообращения.
Диагностика.
1. Жалобы и анамнез (хроническая МР, оценка толерантности к физической нагрузке)
2. Физикальное обследование: Осмотр выявляет смещение верхушечной пульсации, что свидетельствует о тяжелой хронической МР, приводящей к дилатации полостей сердца. Осмотр прекардиальной области в большинстве случаев не выявляет изменений (левый желудочек нормального размера и не вызывает усиленной верхушечной пульсации).
Аускультация – систолический шум может не быть голосистолическим, но может иногда отсутствовать. Атипичной находкой при осмотре может быть третий тон сердца или ранний диастолический шум.
3. Лабораторная диагностика: Специфическая лабораторная диагностика не требуется.
4. Инструментальная диагностика: а)ЭКГ (оценка ритма).
б) Рентгенография грудной клетки – для уточнения состояния МККО и выявления легочного застоя.
в) Трансторакальная эхокардиография – степень поражения МК, полуколичественная информация относительно тяжести регургитации (базовая (первичная) оценка размеров и функции ЛЖ, ПЖ и размера ЛП, давления в легочной артерии и тяжести МР); однако иногда метод недооценивает тяжесть регургитации. В случае гиперкинетической систолической функции ЛЖ у пациента с острой сердечной недостаточностью может быть заподозрена тяжелая МР. Если трансторакальная эхокардиография не позволяет четко визуализировать и оценить поток регургитации, должна быть выполнена
г) Чреспищеводная ЭхоКГ для уточнения деталей анатомического поражения МК и выбора оптимальной хирургической тактики.
5. Инвазивная диагностика: Зондирование сердца (левая вентрикулография, измерения гемодинамики), коронароангиография.
Лечение.
Консервативное лечение:
1. Динамическое наблюдение
2. Медикаментозная терапия: При острой тяжелой МР – нитропруссид натрия, а при гипотензии в комбинации с инотропными препаратами (типа добутамина). Идентификация и лечение инфекции при инфекционном эндокардите. При хронической МР – нет общепринятой медикаментозной терапии.
В настоящее время для коррекции МР используется три различных типа операций:
1) реконструкция МК;
2) протезирование МК с сохранением части или всего митрального аппарата;
3) протезирование МК с удалением митрального аппарата.
+Чрескожные катетерные методы лечения митральной недостаточности
Показания к хирургическому лечению. Показанием к хирургическому лечению при митральной недостаточности является возникновение регургитации II-III степени.
+
1. Операция на МК рекомендуется симптомным пациентам с острой тяжелой МР.
2. Операция на МК показана пациентам с хронической тяжелой МР и симптомами II, III или IV ФК по NYHA в отсутствие тяжелой дисфункции ЛЖ (фракция выброса менее 0,30) и/или конечного систолического размера более 55 мм.
3. Операция на МК показана бессимптомным пациентам с хронической тяжелой МР и умеренно выраженной дисфункцией ЛЖ (фракция выброса 0,30–0,60) и/или конечным систолическим размером не менее 40 мм.
4. Реконструкция МК предпочтительнее протезирования у большинства пациентов с тяжелой хронической МР, которым требуется операция, и пациенты должны быть направлены в хирургические центры, имеющие большой опыт проведения реконструктивных операций на МК.
5. Можно рекомендовать бессимптомным пациентам с хронической тяжелой МР с сохраненной функцией ЛЖ (фракция изгнания более 0,60 и конечный систолический размер менее 40 мм) выполнить реконструкцию МК в опытных хирургических центрах, где вероятность успешной реконструкции без остаточной МР выше 90%.
7. Операция на МК может быть рекомендована бессимптомным пациентам с хронической тяжелой МР, сохраненной функцией ЛЖ и впервые появившейся фибрилляцией предсердий.
8. Операция на МК может быть рекомендована бессимптомным пациентам с хронической тяжелой МР, сохраненной функцией ЛЖ и легочной гипертензией (систолическое давление в легочной артерии более 50 мм в покое или более 60 мм при нагрузке.
9. Операция на МК может быть рекомендована пациентам с хронической тяжелой МР, наступившей вследствие первичного дефекта митрального аппарата, симптомами III–IV ФК по NYHA и тяжелой дисфункцией ЛЖ (фракция выброса менее 0,30 и/или конечный систолический размер более 55 мм), у которых реконструкция МК весьма вероятна.
10. Реконструкция МК может быть рассмотрена как метод лечения отдельных пациентов с хронической тяжелой вторичной МР, наступившей вследствие тяжелой дисфункции ЛЖ (фракция выброса менее 0,30), при наличии симптомов III–IV ФК по NYHA, несмотря на оптимальную терапию сердечной недостаточности, включая бивентрикулярную стимуляцию.
11. Операция на МК не показана бессимптомным пациентам с МР и сохраненной функцией ЛЖ (фракция выброса более 0,60 и конечный систолический размер менее 40 мм), если есть сомнение в успехе операции.
12. Изолированная операция МК не показана пациентам с незначительной или умеренной МР.
13.Протезирование МК с удалением аппарата МК должно выполняться только в случае, если его невозможно сохранить из-за выраженной деформации (например при ревматизме). В таких случаях возможно выполнение искусственной хордальной реконструкции.
Особенности гемодинамики.
При острой тяжелой АР в левый желудочек нормального размера возвращается объем крови, и ЛЖ не имеет времени адаптироваться к перегрузке объемом. С резким увеличением конечного диастолического объема желудочек работает на «крутой» части кривой Франка – Старлинга, демонстрирующей отношение диастолическое давление: объем, и конечное диастолическое давление ЛЖ и давление в левом предсердии могут увеличиться быстро и вызвать резкое ухудшение состояния здоровья больного. Неспособность желудочка к быстрой компенсаторной дилатации полости приводит к уменьшению ударного объема. Тахикардии, которая развивается как компенсаторный механизм для поддержания сердечного выброса, часто оказывается недостаточно для такой компенсации. При выраженной АР высок риск развития отёка легких или кардиогенного шока. Наиболее ощутимы гемодинамические изменения у пациентов с гипертрофией ЛЖ на фоне артериальной гипертензии с небольшой полостью ЛЖ и уменьшенным резервом преднагрузки. В качестве примеров, иллюстрирующих последнюю ситуацию, можно привести расслоение аорты у пациентов с артериальной гипертензией, инфекционный эндокардит у пациентов с существовавшим ранее АС и острую регургитацию после баллонной вальвулотомии или хирургической комиссуротомии при врожденном АС. У пациентов могут быть также симптомы ишемии миокарда. Поскольку конечное диастолическое давление ЛЖ приближается к диастолическому давлению в аорте и коронарных артериях, постольку снижается миокардиальная перфузия субэндокарда. Дилатация ЛЖ и истончение стенки ЛЖ из-за увеличения постнагрузки в сочетании с тахикардией приводит к увеличению потребности миокарда в кислороде. Поэтому при острой тяжелой АР часто развивается ишемия, осложнения которой могут привести к внезапной смерти.
В ответ на перегрузку объемом при хронической АР в ЛЖ формируется ряд компенсаторных механизмов, в том числе увеличение конечного диастолического объема и податливости камеры ЛЖ, что приводит к увеличению объема без повышения давления наполнения ЛЖ и комбинации эксцентрической и концентрический гипертрофии. Увеличенный ударный объем достигается нормальной работой каждой сократительной единицы вдоль увеличенной окружности. Таким образом, сократительная функция ЛЖ остается нормальной, и показатели фазы изгнания, такие как фракции выброса и фракция укорочения, остаются в допустимых пределах. Однако увеличение полости ЛЖ и связанное с ним повышение систолического пристеночного напряжения, в свою очередь, приводят к увеличению постнагрузки ЛЖ, что становится причиной дальнейшей гипертрофии. Таким образом, АР создает условия для комбинации перегрузки объемом и перегрузки давлением. По мере прогрессирования болезни увеличение преднагрузочного резерва и компенсаторная гипертрофия дают возможность желудочку поддерживать нормальный выброс, несмотря на повышение постнагрузки. Большинство пациентов остаются бессимптомными на протяжении фазы компенсации, которая может продолжаться в течение многих десятилетий. Снижение сократимости миокарда может также усугубить положение. Часто на этом этапе развития болезни у пациентов возникает одышка; уменьшенный коронарный резерв в гипертрофированном миокарде может привести к стенокардии напряжения. Однако пациенты могут оставаться бессимптомными до развития тяжелой дисфункции ЛЖ. Систолическая дисфункция ЛЖ (наиболее часто определяемая как снижение фракции выброса ниже нормы в покое) связана преимущественно с приростом постнагрузки и может быть обратима на начальных этапах после протезирования аортального клапана (ПАК). Постепенно, по мере дилатации, ЛЖ приобретает сферическую форму. Сократимость миокарда снижается из-за чрезмерной нагрузки, что приводит к стойкой систолической дисфункции, и ожидаемый результат операции (восстановление функции ЛЖ, повышение выживаемости) уже не может быть достигнуто.
Клиническая картина. Клиническим проявлением острой АР является острая сердечная недостаточность и кардиогенный шок. При острой тяжелой АР, даже при интенсивной медикаментозной терапии, нередко наступает смерть из-за отека легких, желудочковых аритмий, электромеханической диссоциации или кардиогенного шока. Хроническая АР длительное время протекает бессимптомно. При декомпенсации порока появляется одышка при физической нагрузке, затем и в покое. Затем присоединяются приступы удушья (сердечная астма и/или отек легких). Боли в сердце (стенокардия) также могут возникать при аортальной недостаточности, но они не всегда связаны с провоцирующими факторами, как ангинозные боли при ИБС. Не менее чем у четверти больных прогрессирует систолическая дисфункция ЛЖ перед появлением симптомов вплоть до смертельного исхода.
Диагностика.
1. Жалобы и анамнез (наличие стенокардии, одышки при физической нагрузке и покое, приступов удушья)
2. Физикальное обследование:
Осмотр - смещение пульсации ЛЖ; увеличение пульсового давления за счет выраженного снижения диастолического давления и умеренного повышения систолического давления. Периферические симптомы, отражающие большое пульсовое давление (пульсация сонных артерий, симптом де Мюссе).
Аускультация - диастолический шум во II межреберье справа и от грудины и в III- IVу левого края грудины и проводится на верхушку сердца. По характеру это высокочастотный шум, чаще убывающий (decrescendo), связан с быстрым снижением объема или степени регургитации в течение диастолы. Шум Остина-Флинта – специфичный признак тяжелой АР, низкочастотный грохочущий диастолический шум часто выслушивается на верхушке, он может быть среднедиастолическим или пресистолическим.
3. Лабораторная диагностика: Специфическая лабораторная диагностика не требуется.
4. Инструментальная диагностика: а) ЭхоКГ (оценка морфологии клапана, корня аорты; степени гипертрофии, размеров, объема и систолической функции ЛЖ). +Полуколичественная оценка тяжести АР (определение площади и ширины потока цветной допплеровской эхокардиографией), количественное измерение объема регургитации, фракции регургитации и регургитационной площади отверстия, степени снижения градиента регургитации.
б) Магнитно-резонансная томография (оценка объемов, функции ЛЖ, тяжести регургитации у пациентов с АР, если визуализация при эхокардиографии неудовлетворительная.)
в) Мультиспиральная компьютерная томография–ангиография (оценка корня аорты - синусы Вальсальвы, синотубулярное соединение, восходящая аорта - если визуализация при эхокардиографии неудовлетворительная).
г) Магнитно-резонансная томография – ангиография (-//-)
д) Нагрузочные тесты при хронической АР (оценка функциональных возможностей и выявление симптомов у пациентов, имеющих атипичную картину болезни).
е) Рентгенографии органов грудной клетки (оценка размеров сердца и восходящей аорты).
ж) ЭКГ для выявления нарушений ритма, проводимости и гипертрофии ЛЖ
з) Зондирование сердца с ангиографией корня аорты и с измерением давления в ЛЖ (оценка тяжести регургитации, функции ЛЖ, определение размера корня аорты; при неинформативности неинвазивных тестов и др.).
и) Коронарная ангиография.
Прогноз. В большинстве исследований показано, что систолическая функция ЛЖ и конечный систолический размер являются самыми важными детерминантами выживаемости и послеоперационной функции ЛЖ у пациентов, подлежащих ПАК при хронической АР.
*Насколько безопасна патология и степень эффективности лечения можно определить оттого, какое заболевание инициировало нарушение, насколько оно поддается лечению; степень развития проблемы.
Прогнозы будут такими:
Если нарушение приобрело выраженную степень сложности, то обычно с момента его диагностирования пациент проживает от пяти до десяти лет.
Если проблема вызвала необратимые изменения в организме, выражает себя тяжелыми нарушениями кровообращения и при этом препараты не приносят облегчения, то пациент может прожить не более двух лет.
Оперативное вмешательство способно прогноз улучшить.
Лечение.
Медикаментозная терапия
1.Профилактика обострения ревматической лихорадки. Профилактическое назначение антибиотиков пенициллинового ряда в течение10 лет после последнего обострения ревматической лихорадки или до достижения 40 лет. Пожизненная профилактика показана пациентам с АР высокого риска (носительство стрептококка группы А).
2. Профилактика инфекционного эндокардита.
3. Лечение артериальной гипертензии и сердечной недостаточности.
Клиника.
Клиническую картину заболевания определяют наличие и выраженность следующих признаков:
• прямые («клапанные») признаки, обусловленные нарушением функции митрального клапана. К прямым
относят также «левопредсердные» признаки, отражающие реакцию левого предсердия на затруднение
кровотока в митральном отверстии;
• косвенные признаки:
- «легочные», обусловленные наличием легочной гипертензии;
- «правожелудочковые», обусловленные реакцией правого сердца на наличие легочной гипертензии;
• признаки застойных явлений в большом круге кровообращения.
Диагностика.
1. Жалобы и анамнез (усталость, одышка, симптомы альвеолярного отека легких; впервые возникшая фибрилляция предсердий или тромбоэмболии; иногда - кровохарканье, дисфагия, осиплость голоса)
2. Физикальное обследование:
Аускультация - усиленный первый тон сердца (S1), щелчок открытия (OS) , низкочастотный среднедиастолический шум и пресистолический шум.
+ Признаки легочной гипертензии - акцент второго тона или пульсация правого желудочка
3. Лабораторная диагностика: Специфическая лабораторная диагностика не требуется.
4. Инструментальная диагностика: а) ЭхоКГ (ограничение диастолического открытия створок), двухмерная ЭхоКГ (миксома левого предсердия, мукополисахаридоз, неревматический склеротический МС, трехпредсердное сердце, парашютный МК). Проводится оценка гемодинамической тяжести (средний градиент, площадь МК и давление в легочной артерии), наличия тромба в ЛП.
+ нагрузочная проба или добутаминовая стресс-проба для дифференциальной диагностики МС, велоэргометрия
5. Инвазивная диагностика: Зондирование сердца (при несоответствии между неинвазивными тестами и клиническими данными относительно тяжести МС)
Осложнения. Смерть пациентов с МС происходит из-за прогрессирующей легочной и системной недостаточности – в 60–70% случаев, системной эмболии – в 20–30%, легочной эмболии – в 10% и инфекции – в 1–5% случаев. Тяжесть МС определяется на основании данных гемодинамики и анамнеза.
+Острый отек легких, суправентрикулярные аритмии (особенно – фибрилляция и трепетание предсердий).
Лечение.
Консервативное лечение. У бессимптомных пациентов с нормальным синусовым ритмом и легким МС не требуется никакой специфической терапии. Если МС имеет ревматическую этиологию, показано профилактическое лечение. У пациентов с более тяжелыми формами МС рекомендуется избегать чрезмерных физических нагрузок, Препараты с отрицательным хронотропным эффектом (бета-блокаторы, блокаторы кальциевых каналов) при синусовом ритме - для купирования клинических симптомов. При наличии бронхиальной гиперреактивности – ингаляционные кортикостероиды. При симптомах застоя в легких - ограничение соли и эпизодическое назначение мочегонных. Дигиталис неэффективен у пациентов с МС на фоне синусового ритма, за исключением случаев подтвержденной ЛЖ- или ПЖ-дисфункции.
Медикаментозная терапия фибрилляции предсердий - антикоагулянтная терапия гепарином и контроль ЧСС. Для контроля частоты желудочковых сокращений - дигоксин внутривенно, регулирующие ЧСС БКК или бета-блокаторы (при противопоказании к БАБ – амиодарон). Если гемодинамика нестабильна, должна быть срочно проведена электрическая кардиоверсия с внутривенным введением гепарина до, в течение и после процедуры. При рецидивирующей пароксизмальной фибрилляции предсердий – антиаритмические препараты класса IC (в связи с их отрицательным дромотропным эффектом) или класса III.
Медикаментозная терапия: предотвращение системной эмболии - Антикоагулянтная терапия.
+Иное лечение: баллонная катетеризация или на хирургическая комиссуротомия/вальвулотомия (показания по градации Wilkins).
Этиология.
1. Самая частая причина АС у взрослых – кальцификация cтворок нормального трехстворчатого клапана или врожденного двустворчатого клапана. Кальциноз распространяется от основания створок к их свободному краю, вызывая ограничение подвижности створок и уменьшение площади отверстия аорты без сращения по комиссурам. Кальцинированный АС – активный патологический процесс, характеризующийся отложением липидов, воспалением и кальцификацией, во многом подобен атеросклерозу.
2. АС ревматической этиологии, обусловлен сращением по комиссурам с последующим разрушением и в итоге кальцификацией краев створок, встречается реже и нередко сопровождается поражением МК.
3. Врожденный порок АК может также привести к стенозу и является более частой причиной в молодом возрасте.
Клиника.
Тяжесть АС определяется по скорости кровотока, среднему градиенту, площади отверстия.
У пациентов с тяжелым АС при сниженном сердечном выбросе могут определяться более низкие трансклапанные градиенты и максимальные скорости. Некоторые пациенты с тяжелым АС могут быть бессимптомными, тогда как с умеренным АС – имеют симптомы.
Анамнез АС у взрослых включает длительный латентный период, в течение которого заболеваемость и смертность очень низкие. Прогрессирование АС может быть более быстрым у пациентов с дегенеративным атеросклерозом (кальцификацией), чем у пациентов с врожденным АС или ревматизмом. Поэтому постоянное клиническое наблюдение обязательно для всех пациентов с легким и умеренным бессимптомным АС.
После появления симптомов - стенокардии, одышки при физической нагрузке, обмороков - возрастает риск внезапной смерти, продолжительность жизни составляет два-три года. У большинства пациентов с тяжелым АС нарушена агрегация тромбоцитов и снижен уровень фактора Виллебранда. Выраженность изменений свертывающей системы крови пропорциональна тяжести АС. Приобретенный синдром Виллебранда чаще всего проявляется петехиями или экхимозами приблизительно у 20 % пациентов. Внезапная смерть случается у пациентов с тяжелым АС.
Диагностика.
1. Жалобы и анамнез (наличие стенокардии, одышки при физической нагрузке, обмороков)
2. Физикальное обследование:
Наружный осмотр -
Аускультация – выявления грубого нарастающе-убывающего (типа крещендо-декрещендо) систолического шума изгнания при аускультации. Классические признаки тяжелого АС - громкий (IV–VI степени) поздний систолический шум, распространяющийся на сонные артерии, раздвоение (в том числе парадоксальное) второго тона, медленный и малый пульс на сонной артерии. Одновременно уменьшается интенсивность второго тона сердца. Шум начинается вскоре после I тона, когда давление в желудочке повышается достаточно для открытия полулунного клапана. При увеличении скорости кровотока шум изгнания увеличивается, при снижении – уменьшается. Шум лучше всего выслушивается справа или слева от верхнего края грудины. Нормальное расщепление второго тона сердца является надежным критерием для исключения тяжелого АС, однако у пожилых пациентов каротидный пульс может быть нормальным из-за снижения эластичности сосудов, а систолический шум может быть мягким и распространяться к верхушке.
3. Лабораторная диагностика: Специфическая лабораторная диагностика не требуется.
4. Инструментальная диагностика: а) ЭхоКГ (диагностика и оценка тяжести АС, толщины стенки, объема и функции ЛЖ). Комплексная оценка АС включает измерение трансклапанного потока; определение среднего трансклапанного градиента давления; вычисление эффективной площади клапана. Эхокардиография также используется для оценки размеров и функции ЛЖ, степени гипертрофии, наличия другого сочетанного клапанного порока.
б) Рентгенографии органов грудной клетки для оценки размеров сердца и восходящей аорты – размеры полостей сердца, легочный кровоток, легочное и системное венозное давление и кальцификация сердца.
в) ЭКГ для выявления нарушений ритма, проводимости и гипертрофии ЛЖ.
г) проведение нагрузочных тестов бессимптомным пациентам с АС для выявления индуцированных нагрузкой симптомов и неадекватной реакции системного артериального давления.
д) Магнитно-резонансной томографии (МРТ) при неадекватном качестве и/или противоречивых результатах ЭхоКГ для оценки степени регургитации на клапане, объемов, размеров и сократимости левого и правого желудочков.
е) Компьютерная томография (КТ) для оценки выраженности стеноза, степени кальциноза и планиметрических измерений + топическая диагностика аневризм восходящей аорты.
ж) Коронарная ангиография.
з) Зондирование сердца.
и) Добутаминовая стресс-эхокардиография – для оценки выраженности стеноза АК и «сократительного резерва миокарда» пациентам с АС и низким градиентом/низкой скоростью кровотока при наличии дисфункции ЛЖ.
*Медикаментозное лечение.
1.Антибактериальная терапия для профилактики обострения ревматической лихорадки у пациентов с ревматическим АС.
2.Лечение артериальной гипертензии у бессимптомных пациентов с АС, или с умеренным пороком в соответствии с текущими рекомендациями по лечению артериальной гипертензии.
3. Вазодилататоры в комплексном лечении сердечной недостаточности у пациента с декомпенсированным АС. Рекомендуется использовать ингибиторы АПФ или ингибиторы ангиотензина II.
4. Гликозиды, диуретики - для уменьшения симптомов сердечной недостаточности.
5. Если стенокардия является основным симптомом, то показано осторожное назначение нитратов и бета-блокаторов.
Гемодинамические нарушения.
Могут присутствовать дилатация левого предсердия и расширение ЛЖ в зависимости от тяжести МР. Могут вовлекаться и другие клапаны. Пролапс трикуспидального клапана встречается у 40% пациентов с ПМК. Пролапсы легочного и аортального клапанов обнаруживаются у 2–10% пациентов с ПМК. Отмечается увеличение частоты случаев ПМК, ассоциированных со вторичным дефектом межпредсердной перегородки и/или левосторонними атриовентрикулярными дополнительными проводящими путями и наджелудочковыми аритмиями.
Естественное течение бессимптомного ПМК может варьировать от легкого с нормальной продолжительностью жизни до неблагоприятного с выраженными клиническими симптомами и увеличением риска летального исхода. МР может отсутствовать или варьировать от легкой до тяжелой. Наиболее частым предиктором сердечно-сосудистой смертности является умеренная и тяжелая МР, менее частым – фракция выброса ЛЖ менее 0,50. Данные эхокардиографии об утолщении створок МК (5 мм или более) можно считать предиктором осложнений, связанных с ПМК. У большинства пациентов с синдромом ПМК прогноз благоприятен.
Увеличение степени МР у пациентов с ПМК может привести к прогрессирующей дилатации левого предсердия и желудочка. Дилатация левого предсердия может привести к фибрилляции предсердий, а умеренная и тяжелая МР может, в конечном счете, привести к дисфункции ЛЖ и застойной сердечной недостаточности. Может иметь место легочная гипертензия с присоединением дисфункции ПЖ. У части пациентов после начального длительного бессимптомного периода может развиваться дисфункция левого предсердия, левого желудочка и фибрилляция предсердий. В некоторых случаях происходит спонтанный разрыв хорды МК. Серьезным осложнением ПМК является инфекционный эндокардит. У пациентов с ПМК и симптомами нарушения кровообращения в бассейне глазной или задней мозговой артерий можно заподозрить тромбоэмболию. Внезапная смерть является редким осложнением ПМК, случается менее чем у 2% пациентов с ПМК в течение длительного наблюдения с ежегодной смертностью меньше 1%. Вероятными причинами смерти выступают желудочковые тахиаритмии, приводящие к электрической нестабильности миокарда, выявленные при суточном мониторировании ЭКГ у пациентов с ПМК, внезапно умерших впоследствии. Сообщается о самой высокой частоте внезапной смерти при семейной форме ПМК; у некоторых пациентов отмечено удлинение интервала Q–T.
Диагностика.
1. Жалобы и анамнез (усталость, одышка или симптомы альвеолярного отека легких; впервые возникшая фибрилляция предсердий или тромбоэмболии).
2. Физикальное обследование:
Наружный осмотр -
Аускультация – средний диастолический щелчок, высокий короткий шум. Щелчок возникает в результате внезапного напряжения митрального аппарата, когда створки клапана пролабируют в левое предсердие во время систолы. Средний систолический щелчок может сопровождаться поздним систолическим шумом, который обычно бывает средним и высоким; маточка наилучшего выслушивания – верхушка сердца. Иногда шум бывает музыкальным или может быть похож на автомобильный гудок. Характер и интенсивность шума также варьируют при определенных условиях от легкого и практически неслышного до пансистолического и громкого.
3. Лабораторная диагностика: Специфическая лабораторная диагностика не требуется.
4. Инструментальная диагностика: а)ЭКГ (иногда – неспецифические изменения сегмента ST, инверсия зубца Т, выраженные зубцы Q и удлинение интервала Q–T, выявление аритмий).
б) Двухмерная и допплеровская эхокардиография (для диагностики пролапса митрального клапана, митральной недостаточности, морфологии створок и функции левого желудочка). Толщина створки от 5 мм и более указывает на аномальную толщину и подтверждает наличие ПМК. Избыточность створок часто связана с увеличением митрального кольца и удлинением хорд.
Лечение.
Консервативное лечение.
1. Динамическое наблюдение, нормальный стиль жизни, исключение кофеина, алкоголя и сигарет, регулярные физические нагрузки.
2. При наличии клинических симптомов для оценки и консервативного лечение рекомендуется следующее:
- Лечение аспирином (75–325 мг в день) - пациентам с ПМК при наличии транзиторных церебральных ишемических атак.
- Антикоагулянтная терапия (варфарином или другими препаратами) - пациентам старше 65 лет с ПМК и фибрилляцией предсердий, имеющим гипертензию, МР, сердечную недостаточность.
- Лечение аспирином (75–325 мг/сут) - пациентам с ПМК и фибрилляцией предсердий до 65 лет, не страдающим гипертензией, МН, сердечной недостаточностью.
- Антикоагулянтная терапия (варфарином или другими препаратами) - пациентам с ПМК и перенесенным инсультом при наличии МР, фибрилляции предсердий или тромба в левом предсердии.
3. Катетеризация сердца.
Хирургическое лечение (может потребоваться в первую очередь пациентам с «молотящей» (вследствие разрыва или удлинения сухожильных хорд) митральной створкой):
4. Реконструкция МК, протезирование.
Цели лечения ОРЛ
- Эрадикация БГСА
- Подавление активности воспалительного процесса
- Предупреждение у больных с перенесенным кардитом формирования РПС
- Компенсация застойной сердечной недостаточности у больных РПС
- Показания к госпитализации : госпитализируют всех пациентов
Немедикаментозное лечение
- РЕЖИМ
Соблюдение постельного режима на 2-3 нед. Болезни
- ДИЕТА,
богатая витаминами и белком с ограничением соли и углеводов
- ФИЗИОТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ
НЕ ПОКАЗАНО!
Медикаментозное лечение ОРЛ
- Этиотропная (антистрептококковая терапия)
БЕНЗИЛПЕНИЦИЛЛИН 500 000- 100 000 ЕД 4 раза/сутки в/м - в течении 10 дней
- Патогенетическая терапия
Ø ГЛЮКОКОРТИКОИДЫ 20 мг/сут в 1 прием утром после еды до достижения терапевтического эффекта – в среднем около 2 недель. Затем постепенное снижение дозы до полной отмены препарата
Ø НПВП (назначают при минимальной активности процесса, после отмены глюкокортикоидов при повторной ОРЛ на фоне РПС) по 25-50 мг 3 раза/сут (Диклофенак) 1,5-2 месяца до нормализации показателей воспалительной активности
Первичная профилактика ОРЛ
- Основа первичной профилактики – антимикробная терапия острой и хронической рецидивирующей БГСА-инфекции верхних дыхательных путей (тонзиллит, фарингит)
Вторичная профилактика ОРЛ
- Цель – предупреждение повторных атак и прогрессирование заболевания у лиц, перенесших ОРЛ
- Длительность вторичной профилактики – индивидуально
Первичная профилактика ОРЛ
- Пенициллин V (феноксиметилпенициллин). У лиц с аллергией на пенициллин/эритромицин. Дети: 250 мг 2-3 раза в день, подростки и взрослые: 500 мг 2-3 р/д, per os, 10 дней
- Азитромицин. 500 мг в первый день, 250 мг в день в течение 4 дней, per os, 5 дней
Вторичная профилактика ОРЛ
- Для больных, перенесших ОРЛ без кардита (артрит, хорея) – не менее 5 лет после атаки
- Для больных с излеченным кардитом без порока сердца – не менее 10 лет после атаки
- Для больных со сформированным пороком сердца (в т.ч. оперированном) – пожизненно
Профилактика ОРЛ
- Борьба со стрептококковой инфекцией - пенициллины 5-7 дней, затем а/б продленного действия однократно.
- ЭКСТЕНЦИЛЛИН (наиболее эффективная лекарственная форма бензилпенициллина) - 2.400.000 ЕД 1 раз в 3 недели.
Лечение – активная АБ-терапия
- Этиотропная - бензилпенициллин
- Патогенетическая - ГК, НПВС
Первичная профилактика
Вторичная профилактика:
– В течение 5 лет – если нет порока, не сформировался кардит
- В течение 10 лет – если излеченный кардит
- Пожизненно – если есть поражение
Диспансеризация ОРЛ.
Больные ставятся на учет на основании обращаемости и результатов профилактических осмотров населения. на учет берутся не только переболевшие ОРЛ, но и лица, угрожаемые по этому заболеванию. К категории «угрожаемых» по ОРЛ относятся пациенты, часто болеющие острыми носоглоточными инфекциями стрептококковой этиологии (ангина, фарингит), ОРЗ, а также лица, имеющие частые обострения хронических очагов инфекции. Больные с ОРЛ осматриваются ревматологом один раз в квартал, ЛОР-врачом, стоматологом – один раз в год, офтальмологом – один раз в два года, кардиохирургом, невропатологом, гинекологом – по показаниям. Пациентам выполняется анализ крови (4 раза в год), биохимическое исследование крови (белки острой фазы воспаления, АСЛ-О), анализ мочи, ЭКГ – 2 раза в год, по показаниям – эхокардиография. Больным назначается медикаментозная терапия, при необходимости проводится санация очагов хронической инфекции, при обострении заболевания – обязательная госпитализация.
после хирургического лечения ревматических пороков сердца больным назначаются непрямые антикоагулянты (подбор дозы осуществляется под контролем МНО), диспансерное наблюдение проводится пожизненно с контролем показателей крови, ЭКГ и эхокардиографии.
Острая ревматическая лихорадка. Диагностические критерии. Варианты клинического течения. Признаки активности процесса.
Критерии Джонса, пересмотренные американской Ассоциацией кардиологов в 1992г.
Большие критерии:
- Кардит
- Мигрирующий полиартрит
- Хорея Сиденгама
- Подкожные узелки
- Кольцевидная эритема
Малые критерии
- Клинические:
- лихорадка, артралгии
- Лабораторные:
- реактанты острой фазы (СОЭ, СРБ, сиаловые к-ты, лейкоцитоз)
- Инструментальные:
-удлинение интервала PQ на ЭКГ;
Наличие двух больших или одного большого и двух маленьких критериев свидетельствует о высокой вероятности ОРЛ при наличии подтвержденных данных о перенесенной инфекции, вызванной стрептококком группы А:
- повышенный титр антистрептококковых антител, АСЛ-О
- высевание из зева стрептококков группы А
- недавно перенесенная скарлатина
Ревматический полиартрит
Мигрирующий полиартрит преимущественно крупных и средних суставов (коленных, голеностопных, реже – локтевых, плечевых, лучезапястных). Преобладающая форма поражения – преходящий олигоартрит, реже – моноартрит.
Ревматическая хорея
Поражение нервной системы, характеризующееся пентадой симптомов, наблюдающихся в различных сочетаниях:
- Хореические гиперкинезы
- Мышечная гипотония
- Расстройства статики и координации
- Сосудистая дистония
- Психоэмоциональные нарушения
*Малая хорея (хорея Сиденгама) – непроизвольные движения головы и пальцев при попытке держать руки прямо перед собой.
Кольцевидная эритема
Бледно-розовые кольцевидные высыпания диаметром – от нескольких миллиметров до 5-10 см с преимущественной локализацией на туловище и проксимальных отделах конечностей (но не на лице). Имеет транзиторный мигрирующий характер, не возвышается над уровнем кожи, не сопровождается зудом или индурацией, бледнеет при надавливании, быстро регрессирует без остаточных явлений. Усиливается при согревании кожи.
Лабораторные исследования
• Бактериологическое исследования мазка из зева (результаты обычно отрицательны к моменту развития ОРЛ).
• Экспресс-тест на антиген гем.стрептококка группы А. Специфичность 95%, чувствительность только 60-90%.
• Антистрептококковые антитела (в период от 2 до 24 недель от начала инфекции).
К внеклеточным антигенам: AСO (чувствительность 80-85%), анти-ДНК-аза B (чувствительность 90%), антигиалуронидаза, антистрептокиназа.
К внутриклеточным антигенам: антитела к M-протеину.
• Реактанты острой фазы: СРБ, СОЭ.
• Тропониновый тест.
• Экспресс-тест на D8/17: иммунофлуоресцентный метод определения маркеров В-лимфоцитов. Положителен у 90% больных с ОРЛ.
Данные, подтверждающие А - стрептококковую инфекцию:
- Позитивная А-стрептококковая культура, выделенная из зева или положительный тест быстрого определения А – стрептококкового антигена.
- Повышение или повышающиеся титры противострептококковых антител
(анитистрептолизин –О, анти-ДНК-аза В)
Два варианта развития ОРЛ:
1. Острое внезапное начало через 2-6 недель после фарингита по типу полиартрита с лихорадкой и интоксикацией, чаще у подростков и взрослых.
2. Постепенное субклиническое развитие кардита, чаще у детей.
Особенности течения ОРЛ
- Ревматический полиартрит возникает в 75% случаев.
- Возникает на ранних стадиях болезни.
- Продолжительность составляет от 1-2 до 4 недель.
- Подкожные узелки, как правило, сочетаются с тяжелым поражением сердца.
Особенности диагностики ОРЛ
- Латентный период между стрептококковым фарингитом и ОРЛ от 1 до 5 нед. - обычно 18 дн.
- Положительные результаты посевов из зева - у 25% больных с ОРЛ.
- Невозможно отличить бактерионосительство от инфекции.
- Наиболее информативным является тест на наличие АТ к стрептококкам.
Пример клинического диагноза
- Острая ревматическая лихорадка: хорея. Кардит (митральный вальвулит), ХСН I-ФК 1. Мигрирующий полиартрит.
- Повторная ревматическая лихорадка: кардит. Сочетанный митральный порок сердца, ХСН IIА-ФК 2.
- Хроническая ревматическая болезнь сердца: комбинированный митрально-аортальный порок сердца, ХСН IIБ-ФК 3.
Критерии активности кардита
Кардит с максимальной активностью процесса (активность III степени)
Клиническая симптоматология (синдром):
· панкардит;
· острый или подострый диффузный миокардит;
· подострый кардит с выраженной недостаточностью кровообращения, упорно не поддающийся лечению;
· подострый или непрерывно рецидивирующий ревмокардит в сочетании с симптомами острого или подострого полиартрита, плеврита, перитонита, ревматической пневмонии, нефрита, гепатита, подкожными ревматическими узелками, кольцевидной эритемой, хорея с выраженными проявлениями активности;
· нарастающее увеличение размеров сердца, снижение функции сократимости миокарда, плевро-перикардиальные спайки (по данным рентгенологического исследования), подвергающиеся обратному развитию под влиянием активной антиревматической терапии;
· четкая электрокардиографичекая симптоматика (динамические нарушения ритма и проводимости), характеризующаяся явной динамикой й обратным развитием под влиянием лечения;
· изменения показателей системы крови: нейтрофильный лейкоцитоз — выше 10х109/л, СОЭ — выше 30 мм/ч, СРБ — 3-4 плюса и выше, фибриногенемия — выше 264-294 ммоль/л, α2-глобулин — выше 17%, γ-глобулин — 23-25%, серомукоид — выше 0,6 ед, ДФА — выше 0,35-0,5 ед.;
· серологические показатели: титры антистрептолизина-О, антистрептогиалуронидазы, антистрептокиназы выше нормы в 3-5 раз.повышение проницаемости капилляров II-III степени.
Кардит с умеренной активностью (активность II степени)
Клиническая симптоматология (синдром):
· подострый кардит в сочетании с недостаточностью кровообращения I—II степени, медленно поддающийся лечению;
· подострый или непрерывно рецидивирующий кардит в сочетании с подострым полиартритом, ревматической хореей;
· рентгенологически: увеличение размеров сердца, плевро-перикардиальные спайки, подвергающиеся обратному развитию под влиянием активной антиревматической терапии;
· электрокардиографическая симптоматика (удлинение Р—Q, другие нарушения ритма), признаки нарушения коронарного кровообращения, характеризующиеся динамичностью и изчезновением под влиянием антиревматической терапии;
· изменения показателей системы крови: нейтрофильный лейкоцитоз — 8-10х109л, СОЭ — 20-30 мм/ч, СРБ — 1-3 плюса, α2-глобулины — 11-16%, γ-глобулины — 21-23%, ДФА — 0,25-0,30 ед., серомукоид — 0,3-0,6 ед.;
· серологические показатели: титры стрептококковых антител, главным образом антистрептолизина-О и антистрептогиалуронидазы, выше нормы в 1 -1,5 раза;
· повышение проницаемости капилляров II степени.
Кардит с минимальной активностью (активность I степени)
Клиническая симптоматология (синдром):
· затяжной или латентный кардит при сохраненной или сниженной трудоспособности (при рецидивирующем кардите на фоне ранее развившегося порока сердца может быть недостаточность кровообращения различной степени, как правило, плохо поддающаяся активной терапии);
· затяжной или латентный кардит в сочетании с ревматической хореей, энцефалитом, васкулитом, ириитом, подкожными ревматическими узелками, кольцевидной эритемой, стойкими артралгиями;
· рентгенологически установленные при первичном амбулаторном ревмокардите нормальные или немного увеличенные размеры сердца, плевро-перикардиальные спайки, трудно подвергающиеся обратному развитию под влиянием активной антиревматической терапии (при рецедивирующих ревмокардитах на фоне ранее развившегося порока сердца рентгенологическая картина может быть весьма разнообразной, но, как правило, с расширением и изменением конфигурации сердечной тени, иногда с плевро-перикардиальными спайками, которые хотя и с трудом, но поддаются редукции под влиянием активной терапии);
· на электрокардиограмме могут быть проявления кардиосклероза (постмиокардического), нарушения коронарного кровообращения, различного рода нарушения ритма, с трудом поддающиеся антиревматической терапии (электрокардиографическая симптоматика обычно бедна, но упорна в смысле динамики при антиревматическом лечении);
· изменения со стороны крови малочисленны и неопределенны: СОЭ слегка увеличена (если нет недостаточности кровообращения) или в пределах нормы, при недостаточности кровообращения понижена, СРБ отсутствует или обнаруживается в пределах одного плюса, количество глобулиновых фракций (главным образом гамма) слегка увеличено или в пределах верхней границ нормы, ДФА в пределах высокой нормы; содержание серомукоида в пределах нормы или понижено;
· серологические показатели в пределах высокой нормы или слегка повышены (важна динамика этих показателей в течение болезни и вне зависимости от интеркуррентной инфекции: низкие титры стрептококковых антител могут быть связаны с подавлением (истощением) иммунологической реактивности и не отражают истинного благополучия; периодическое повышение титров, тем более постепенное нарастание их при отсутствии инфицирования, может служить косвенным подтверждением активности ревматического процесса);
· повышение проницаемости капилляров в пределах I—II степени.
Клинико-лабораторная характеристика активности ревматического процесса
Пример:
ХСН II Б стадии, II ФК;
ХСН II А стадии, IV ФК
Параметры физической активности (ОССН, 2002)
Тест 6-минутной ходьбы
| ФК | Дистанция 6-минутной ходьбы (м) |
| 0 | > 551 |
| I | 426 - 550 |
| II | 301-425 |
| III | 151 - 300 |
| IV | < 150 |

Шкала оценки клинического состояния б-х с ХСН (модификация В.Ю.Мареева, 2000)
1. Одышка: 0 – нет, 1 – при нагрузке, 2 – в покое
2. Изменился ли за последнюю неделю вес:
0 – нет, 1 – увеличился
3. Жалобы на перебои в работе сердца: 0 – нет, 1 – есть
4. В каком положении больной находится в постели:
0– горизонтально, 1– с приподнятым головным концом
(2+ подушки), 2 – плюс просыпается от удушья; 3 - сидя
5. Набухшие шейные вены: 0 – нет, 1 – лежа, 2 – стоя
6. Хрипы в легких: 0 – нет, 1 – нижние отделы (до 1/3),
2 -до лопаток (до 2/3), 3 – над всей поверхностью легких
7. Наличие ритма галопа: 0 – нет, 1 – есть
8. Печень: 0 – не увеличена, 1 – до 5 см, 2 – более 5 см
9. Отеки: 0 – нет, 1 – пастозность, 2 – отеки, 3 – анасарка
10.Уровень САД: 0 - > 120, 1 – (100-120), 2 – < 100мм. Hg

Пять целей при лечении ХСН
Устранение симптомов ХСН
Замедление прогрессирования ХСН и защита органов-мишеней (сердце, мозг, почки, сосуды)
Улучшение «качества жизни»
Уменьшение госпитализаций (и расходов)
Улучшение прогноза
Диета больных с ХСН
1. Ограничение поваренной соли
I ФК - не употреблять соленой пищи (до 3 г NaCl)
II ФК - плюс не досаливать пищу (до 1.5 г NaCl)
III ФК – плюс продукты с уменьшенным содер-жанием соли и приготовление без соли ( < 1.0 г NaCl)
2. Умеренное ограничение жидкости (до1,5л/сут)
3. Пища калорийная, легко усвояемая, с достаточным содержанием витаминов, белка
NB! Прирост веса >2 кг за 1- 3 дня - риск декомпенсации
ИАПФ
ИАПФ показаны всем больным с ХСН. При любой этиологии и стадии процесса
ИАПФ улучшают клиническую симптоматику, КЖ, замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных с ХСН
ИАПФ эффективны от самых начальных (включая бессимптомную ДЛЖ и ХСН с сохраненной систолической функцией сердца) до самых поздних стадий декомпенсации
Чем раньше начинается лечение, тем большие шансы на успех и продление жизни пациентов
Не назначение ИАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти б-х
Назначение всех ИАПФ начинается с маленьких доз, при их постепенном титровании до оптимальных доз
При исходно низком АД (систолическое выше 85 мм. Hg) эффективность ИАПФ сохраняется, поэтому их всегда следует назначать, снижая стартовую дозу (для всех ИАПФ)
Абсолютными противопоказания к лечению ИАПФ беременность;
двусторонний стеноз почечных артерий, непереносимость
Побочные эффекты (требующие остановки лечения) :
1-2% азотемия (кроме фозиноприла); 2-3% сухой кашель; 3-4% гипотония. В этих (до 7-9%) случаях ИАПФ могут быть заменены на АРА- II
ИАПФ в лечении ХСН:
В России зарегистрировано 11 ИАПФ, но степень доказанности иъ эффективности при лечении ХСН различна.
ИАПФ, доказавшие способность предотвращать развитие ХСН и/или успешно лечить больных ХСН:
-Каптоприл
-Периндоприл могут быть в первую очередь рекомендованы для профилактики и
- Эналаприл
-Фозиноприл лечения ХСН
-Дизиноприл
АРА в лечении ХСН:
| Кандесартан | ХСН I-IV ФК, ХСН с сохранной ФВ ЛЖ |
| Валсартан | ХСН I-IV ФК, после ОИМ, у больных ИБС |
| Лозартан | Непереносимость ИАПФ, профилактика ХСН |
Антагонисты рецепторов к ангиотензину II (кандесартан) – могут применяться наряду с ИАПФ в качестве средства первой линии для блокады РААС у больных с клинически выраженной ХСН
БЕТА- АДРЕНОБЛОКАТОРЫ
- Рекомендованы кардиоселективные: бета-адреноблокаторы бисопролол, метопролол и небиволол, а также некардиоселективный с дополнительными свойствами a 1-блокатора карведилол - доказали способность улучшать прогноз больных с ХСН
-БАБ должны применяться всем больным с ХСН не имеющим противопоказаний (обычных для этой группы лекарств)
-БАБ должны применяться только «сверху», т.е. дополнительно к ИАПФ и больным, у которых достигнута стабилизация состояния
- Лечение БАБ при ХСН должно начинаться осторожно, с 1/8 терапевтической дозы с медленным ее повышением до оптимальной
Место антагонистов альдостерона у пациентов с ХСН:
АМКР – применятеся у всех больных с ХСН I-IV ФК и ФВ ЛЖ <40% для снижения риска смерти, повторных госпитализаций и улучшения клинического состояния вместе с ИАПФ (АРА) и b-АБ.


Профилактика обострений .
Лечение больных с ХСН в рамках диспансерного наблюдения (таблица 1). Цели терапии больных с ХСН в рамках диспансерного наблюдения предполагают:
А) предотвращение развития симптомной ХСН (для I стадии ХСН);
Б) устранение симптомов ХСН (для стадий IIA–III);
В) замедление прогрессирования болезни путем защиты сердца и других органов–мишеней (мозг, почки, сосуды, для стадий I–III);
Г) улучшение качества жизни (для стадий IIA–III);
Д) уменьшение количества госпитализаций (и расходов для стадий I–III);
Е) улучшение жизненного прогноза (для стадий I–III).
К универсальным рекомендациям независимо от типа и выраженности ХСН относятся: ограничение потребления соли, нормализация и контроль массы тела, отказ от курения и алкоголя, регулярная аэробная циклическая физическая нагрузка с учетом результатов 6МТХ, вакцинация гриппозной и пневмококковой вакциной.
Диспансерное наблюдение пациентов с ХСН осуществляют:
• врач-терапевт (врач-терапевт участковый, врач-терапевт участковый цехового врачебного участка, врач общей практики (семейный врач);
• врачи-специалисты (по профилю заболевания);
• фельдшер фельдшерско-акушерского пункта (фельдшерского здравпункта) в случае возложения на него руководителем медицинской организации отдельных функций лечащего врача, в том числе по проведению диспансерного наблюдения, в установленном порядке
Вопросы консультирования по коррекции факторов риска могут быть возложены на врача (фельдшера) отделения (кабинета) медицинской профилактики и/или врача (фельдшера) центра здоровья.
| Заболевание, состояние | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений |
| ХСН I-IIА стадии, стабильное состояние | Не менее 1 раза в год | - измерение АД при каждом посещении; - измерение массы тела или оценка дневника веса при каждом посещении; - общий (клинический) анализ крови, развернутый при взятии под ДН, далее по показаниям; - анализ крови биохимический с определением содержания натрия, калия, креатинина при взятии под ДН, далее по показаниям; - расчет скорости клубочковой фильтрации при взятии под ДН, далее по показаниям; - лабораторный контроль за терапией непрямыми антикоагулянтами (варфарин), кратность |
| ХСН IIБ-III стадии, стабильное состояние | Не менее 2 раз в год | - измерение АД при каждом посещении; - измерение массы тела или оценка дневника веса при каждом посещении - анализ крови биохимический с определением содержания натрия, калия, креатинина при взятии под диспансерное наблюдение, далее по показаниям; - расчет скорости клубочковой фильтрации при взятии под диспансерное наблюдение и по показаниям; - лабораторный контроль за терапией непрямыми антикоагулянтами (варфарин), кратность исследований МНО в зависимости от достижения целевых значений; - определение концентрации предшественника мозгового натрийуретического пептида (NT-proBNP) или мозгового натрийуретического пептида (МНП или BNP) по показаниям; - ЭКГ менее 2 раз в год; - ЭхоКГ ежегодно; - рентгенография органов грудной клетки при взятии под диспансерное наблюдение далее по показаниям; - суточный мониторинг ЭКГ по показаниям; - консультация врача-кардиолога при дестабилизации течения и рефрактерной к терапии ХСН с оценкой показаний к высокотехнологичной медицинской помощи (ИКД, СРТ, трансплантация сердца и т.д.); - ежегодная вакцинация против гриппа; - корректировка терапии (при необходимости). |
Проведение школ по сердечной недостаточности для пациентов и их родственников способствует лучшему пониманию плана лечения, что в конечном итоге приводит к большей приверженности пациентов и улучшению клинических исходов. Проведение школ пациентов на базе стационаров, как правило, более эффективно, вследствие большей сосредоточенности пациентов на своем состоянии.
Удаленный контроль пациентов с помощью телефонных звонков с использованием структурированных опросников также может значительно улучшать клинические исходы (смертность и сердечно-сосудистые госпитализации) на 38%.
Классификации
Общепринятой клинической классификацией является Хьюстенская модификация гастритов, 1996 г (Таблица 1).
Таблица 1. Сиднейская система классификации хронических гастритов
| Тип гастрита | Этиологические факторы | Синонимы (прежние классификации) |
| Неатрофический | Helicobacterpylori Другие факторы | Поверхностный Хронический антральный Гастрит типа В Гиперсекреторный гастрит |
| Атрофический аутоиммунный | Иммунные механизмы | Гастрит типа А Диффузный гастрит тела желудка, ассоциированный с В12-дефицитной анемией и с пониженной секрецией |
| Атрофический мультифокальный | Helicobacter pylori Нарушения питания Факторы среды | Смешанный гастрит типа А и В |
| Особые формы | ||
| Химический | Химические раздражители: Желчь (ДГР) Приём НПВП | Реактивный гастрит типа С Реактивный рефлюкс-гастрит |
| Радиационный | Лучевое поражение | |
| Лимфоцитарный | Идиопатический Иммунные механизмы Глютен | Гастрит, ассоциированный с целиакией |
| Гранулематозный | Болезнь Крона Саркоидоз ГранулематозВегенера Инородные тела Идиопатический | Изолированный гранулематоз |
| Эозинофильный | Пищевая аллергия Другие аллергены | Аллергический |
| Другие инфекционные | Бактерии (кроме Helicobacter pylori) Грибы, Паразиты | |
| Гигантский гипертрофический | Болезнь Менетрие | |
Описание морфологических изменений дополняются характеристикой эндоскопических категорий гастритов:
· эритематозный/экссудативный гастрит (поверхностный гастрит);
· плоские эрозии;
· приподнятые эрозии;
· геморрагический гастрит;
· гиперпластический гастрит;
· гастрит, сопровождающийся дуоденогастральным рефлюксом (ДГР) - рефлюкс-гастрит.
Для оценки гистологической выраженности атрофии и воспаления применяется новая система оценки гастрита OLGA (OperativeLinkforGastritisAssessment).
Таблица 2. Классификация атрофического гастрита (OLGA 2007 г.)
| Антрум | Тело | |||
| 0 | I | II | III | |
| 0 | Степень 0 | Степень I | Степень II | Степень II |
| I | Степень I | Степень II | Степень II | Степень III |
| II | Степень II | Степень II | Степень III | Степень IV |
| III | Степень II | Степень III | Степень IV | Степень IV |
Интегральный показатель стадии гастрита в системе OLGA
| Антрум | Тело | |||
| 0 | I | II | III | |
| 0 | Стадия 0 | СтадияI | СтадияII | СтадияII |
| I | СтадияI | СтадияII | СтадияII | СтадияIII |
| II | СтадияII | СтадияII | СтадияIII | СтадияIV |
| III | СтадияII | СтадияIII | СтадияIV | СтадияIV |
В каждом столбце атрофия показана по четырехуровневой шкале (0-3) в соответствии с визуальной аналоговой шкалой модифицированной Сиднейской системы классификации гастрита. Под степенью гастрита подразумевается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии.
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии:
| Жалобы | При хронических гастритах выраженных клинических симптомов не наблюдается, возможныесимтомы: • при хроническом антральном поверхностном H.pylori- ассоциированном гастрите возможны «язвенноподобный» вариант диспепсии (тупые боли в эпигастриии/или в пилородуоденальной зоне» или дискинетический вариант «желудочной диспепсии» - чувство быстрого насыщения, переполнения после еды, вздутия живота, тошнота; • при хроническом атрофическом мультифокальном гастрите возможны симптомы «желудочной диспепсии» – чувство быстрого насыщения, переполнения после еды, вздутия живота, тошнота; • при аутоиммунном атрофическом – симптомы В-12-дефицитной анемии и могут быть симптомы «желудочной диспепсии» (смотреть выше). |
| Анамнез | • при хроническом антральном поверхностном H.pylori- ассоциированном гастрите в анамнезе: отягощенная наследственность по гастродуоденальной патологии (ГДП). Нарушение режима питания, сухоедение злоупотребление острой, копченной и жаренной пищи, газированных напитков; • при хроническом атрофическом мультифокальном гастрите – в анамнезе длительное течение хроническогоантрального поверхностногоH.pylori- ассоциированного гастрита; • при аутоиммунном атрофическом гастрите – наличие аутоиммунных заболеваний (аутоиммунныйтиреоидит, гипо-или гиперфункция щитовидной и паращитовидных желез, СД Iтипа, аутоиммунная (пернициозная) анемия). |
| Физикальное обследование | • при хроническом антральном поверхностном H.pylori- ассоциированном гастрите могут быть при пальпации живота умеренная болезненность в эпигастральной и в пилоро-дуоденальной области, метеоризм; • при хроническом атрофическом мультифокальном гастрите – "полированный" язык, или обложенный густым белым налетом.При пальпации живота умеренная разлитая болезненность в эпигастральной области; • при аутоиммунном атрофическом гастрите –признаки авитаминоза, глоссит, фуникулярныймиелоз, симптомы анемии, гепатомегалия, реже –спленомегалия. |
| Лабораторные исследования – тест на H.pylori: | |
| быстрый уреазный тест в биоптатах СОЖ | Взятый при эндоскопии биоптат помещается в специальный раствор с содержанием мочевины и при добавлении индикатора происходит изменение цвета от слабо розового до темно-красного при наличии H.pylori |
Профилактика
При ХГ профилактика состоит в рациональном питании и соблюдении режима питания, а также в борьбе с употреблением алкогольных напитков и курением. Необходимо следить за состоянием полости рта, носоглотки, своевременно лечить другие заболевания органов брюшной полости, устранять профессиональные вредности и глистно-протозойные инвазии.
Профилактика обострения ХГ должна предусматривать противорецидивное лечение тех больных, у которых заболевание имеет тенденцию к рецидивированию.
В проведении вторичной профилактики большое значение имеет диспансеризация больных ХГ. Она включает комплексное обследование и противорецидивное профилактическое лечение 1-2 раза в год.
Профилактика
В целях профилактики ЯБ рекомендовано устранение нервного напряжения, отрицательных эмоций, интоксикаций; прекращение курения, злоупотребления алкоголем; нормализация питания; соответствующее трудоустройство, активная лекарственная терапия хеликобактерной инфекции у больных ХГ.
Профилактическая терапия «по требованию» назначается при появлении симптомов, характерных для обострения ЯБ и включает в себя:
• прием одного из антисекреторных препаратов (ранитидин, фамотидин, омепразол) в полной суточной дозе в течение 2-3 дней, а затем в половинной дозе - в течение 2 нед.
+
Лечение язвенной болезни проводится амбулаторно.
Цели лечения:
· быстрая ликвидация тягостных для больного симптомов заболевания;
· заживление язвы;
· ликвидация инфекционного агента Н.pylori для предотвращения рецидивов заболевания и профилактика его обострений;
· при осложненном течении заболевания – лечение осложнений и устранение опасности для жизни больного.
Лечение ЯБ комплексное и включает:
- диетическое питание;
- прекращение курения и употребления алкоголя;
- отказ от приема препаратов, обладающих ульцерогенным действием;
- нормализация режима труда и отдыха, санаторно-курортное лечение.
Отсутствуют различия в подходах к лечению ЯБЖ и ЯБДПК. При подтверждении доброкачественного характера язв желудка лечение больных проводится так же, как и лечение при дуоденальных язвах. Различие по срокам лечения, при язвах желудка – с учетом их более значительного размера и более медленного рубцевания – более продолжительные.
Немедикаментозное лечение:
Режим:
Лечение комплексное и включает – диетическое питание, прекращение курения и употребление алкоголя, отказ от ульцерогенных препаратов (прежде всего НПВП). Диетическое питание, должно быть частым, дробным, механически и химически щадящим.
Диета:
Рекомендуется частое (5-6 раз в сутки), дробное питание, соответствующие правилу «6 маленьких приемов пищи лучше, чем 3 больших», механического, термического и химического щажения СОЖ.
Диета должна быть богатой белками, так как терапевтический эффект в этом случае наступает быстрее, ускоряется заживление язв и стихание воспалительного процесса (Таблица 2).
Таблица 2. Диета при ЯБ
| Продукты, подлежащие исключению из рациона | Продукты, предпочтительные для употребления | Допустимые к употреблению продукты |
| • мясные и рыбные бульоны; • жареная и наперченная пища; • копчености и консервы; • приправы и специи (лук, чеснок, перец, горчицу); • соления и маринады; • газированные фруктовые воды, пиво, белое сухое вино, шампанское, кофе; • цитрусовые | • мясо и рыба (отварные или приготовленные на пару); • яйца; • молоко и молочные продукты | • макаронные изделия; • черствый белый хлеб; • сухой бисквит и сухое печенье; •молочные и вегетарианские супы; •овощи (картофель, морковь, кабачки, цветная капуста) – тушеные или в виде пюре и паровых суфле; • каши, кисели из сладких сортов ягод, муссы, желе, сырые тертые и печеные яблоки; • какао с молоком, некрепкий чай. |
*Источник: 2013 Клинические рекомендации по диагностике и лечению язвенной болезни (Российская Гастроэнтерологическая Ассоциация)
Медикаментозное лечение
Отсутствие принципиальных различий в подходах к лечению язв желудка и ДПК – важный момент в современной фармакотерапии ЯБ. Различие заключается в продолжительности курса фармакотерапии.
Принципы фармакотерапии:
· одинаковый подход к лечению язв желудка и двенадцатиперстной кишки;
· обязательное проведение базисной антисекреторной терапии;
· выбор антисекреторного препарата, поддерживающего внутрижелудочную рН>3 около 18 часов в сутки;
· назначение антисекреторного препарата в строго определенной дозе;
· эндоскопический контроль с 2–х недельным интервалом;
· длительность антисекреторной терапии в зависимости от сроков заживления язвы;
· эрадикационная антихеликобактерная терапия у НР–положительных больных;
· обязательный контроль эффективности антихеликобактериной терапии через 4–6 недель;
· повторные курсы антихеликобактерной терапии при ее неэффективности;
· поддерживающая противорецидивная терапия антисекреторным препаратом у НР–негативных больных;
· влияние на факторы риска плохого ответа на терапию (замена НПВП парацетамолом, селективными ингибиторами ЦОГ–2, сочетание НПВП с мизопростолом, обеспечение комплаентности больных и др.).
Ингибиторы протонной помпы –ИПП являются средством базисной терапии ЯБ. Они назначаются с целью купирования болевого синдрома и диспепсических расстройств, а также для достижения рубцевания язвенного дефекта в возможно более короткие сроки [1,2].
Антациды способны поддерживать уровень внутрижелудочного рН> 3 на протяжении 4-6 часов в течение суток, что определяет их недостаточно высокую эффективность при применении в качестве монотерапии. Тем не менее, больные с ЯБ принимают антациды для купирования болей и диспепсических жалоб, что во многом объясняется быстротой их действия и безрецептурным отпуском [2].
Принципы ведения пациентов с H. Pylori:
· для контроля эрадикации, который проводят через 4-6 недель после окончания эрадикационной терапии – с помощью С13 мочевинного дыхательного теста или БУТ диагностики H. Pylori в биоптате СОЖ, взятого при ФЭГДС;
· проблема диагностики инфекции Н. pylori заключается в настоящее время в возможности получения ложноотрицательных результатов, связанных, главным образом, с тем, что исследование проводится на фоне терапии ИПП или вскоре после нее.
· Во избежание ложноотрицательных результатов прием ИПП необходимо прекратить за 2 недели до предполагаемого контрольного исследования. Кроме того, отрицательный результат исследования на инфекцию Н. pylori должен быть обязательно подтвержден двумя методами диагностики (гистологический метод, С13 мочевинный дыхательный тест и БУТ) [1].
· Контроль рубцевания язв желудка проводят через 4, 6, 8 недель после начала приема препаратов, а дуоденальных – через 2, 4, 6 недель (в зависимости от размера язвенного дефекта).
Успешность эрадикации H. Pylori, обуславливает безрецидивное течение, что является положительным прогностическим признаком в лечении ЯБ.
| Рекомендуемые схемы эрадикации(Маастрихт-V, 2015) |
| Терапия первой линии (10-14 дней): • 3-х компонентная схема: ИПП +амоксициллин +кларитромицин; • квадротерапия без висмута: ИПП+амоксициллин+кларитромицин +нитроимидазол. Терапия второй линии(10-14 дней): • 3-х компонентная схема: ИПП+амоксициллин+фторхинолон • квадротерапия без висмута: ИПП+амоксициллин+кларитромицин +нитроимидазол[8,9,10], (УД А); • квадротерапия с висмутом: ИПП+амоксициллин+кларитромицин +висмута трикалиядицитрат. Эффективность лечения повышается при назначении дважды в день повышенной дозы ИПП (удвоенной стандартной) [11,12], (УД B). При 14-дневной терапии увеличение частоты эрадикации более значительно, чем при 10-дневной [11,12,13],(УД С). Эрадикационная терапия H. pylori может приводить к развитию антибиотико-ассоциированной диареи [14],(УД С). Добавление к стандартной тройной терапии пробиотикаSaccharomycesboulardiiповышает скорость эрадикацииH.pylori [11,12, 13](УД D). |
Возможные причины неэффективности и ошибки лечения ЯБ
· часто рецидивирующее течение заболевания (частота рецидивов> 2 раз в год);
· формирование трудно рубцующихся язв, не заживающих в течение 12 недель непрерывного лечения.
Факторы, способствующие частым рецидивам язв и замедленному заживлению:
· персистенция инфекции Н. pylori;
· прием НПВП;
· наличие у больного скрыто протекающего синдрома Золлингера-Эллисона;
· низкая приверженность больных к лечению (курение, злоупотребление алкоголем, неправильный прием лекарственных препаратов) [2].
Ошибки при проведении эрадикационной терапии:
· отсутствие тестирования на наличие инфекции Н. pylori у больных ЯБ, в результате которого пациенты получают только антисекреторную терапию;
· неправильное лечение Н.pylori-негативной ЯБ;
· использование в схемах эрадикации лекарственных препаратов, не входящих в утвержденные схемы (например, Н2-блокаторов);
· применение препаратов в недостаточных дозах;
· к снижению эффективности эрадикации приводит назначение 7-дневных курсов эрадикации вместо 10-14 дневные;
· отказ (по разным причинам) от проведения контроля эрадикации в установленные сроки;
· прежде чем вынести заключение о неэффективности консервативного лечения ЯБ у пациента, необходимо убедиться, что лечение и обследование было проведено в строгом соответствии с существующим протоколом.
Профилактические мероприятия:
· одновременное назначение ИПП при необходимости приема НПВП и антикоагулянтов (особенно больным пожилого возраста, пациентам с ЯБ в анамнезе, больным с сопутствующими заболеваниями сердечно-сосудистой системы и циррозом печени);
· устранение факторов, способствующих язвообразованию: устранение вредных привычек (курение и злоупотребление алкоголем);
· нормализацию режима труда и отдыха;
· организация правильного режима и характера питания,
Проведение С13 мочевинного дыхательного теста на наличие Н. pylori и применение эрадикационной антихеликобактерной терапии в случае обнаружения Н. pylori [2].
Дальнейшее ведение:
Динамическое наблюдение за больным, 1 раз в год проводить ФЭГДС, диагностику инфекции Н. pylori. При обострении – проводить эрадикционную терапию (смотреть выше). При непрерывно рецидивирующем течении – консультация хирурга (особенно при ЯБЖ)
Индикаторы эффективности лечения и безопасности методов:
· заживление язвенного дефекта в СО ГДЗ;
· эффективная эрадикация Н.pylori;
· обеспечение стойкой ремиссии ЯБ;
· отсутствие осложнений.
Хирургическое вмешательство:
Показания для хирургического вмешательства – осложненные формы заболевания – перфорация и пенетрация язвы, рубцово-язвенный стеноз привратника, малигнизация язвы.
При выборе способа хирургического лечения предпочтение следует отдавать органосохраняющим операциям, дающим меньшую частоту постгастрорезекционных
Профилактические мероприятия:
· организация правильного режима и характера питания;
· борьба с вредными привычками;
· отказ от приѐма лекарственных препаратов, оказывающих ульцерогенное действие;
· инвазивный метод исследования на предраковое поражение желудка: исследование крови на гастрин-17, пепсиноген -1 и пепсиноген -2 (метод «Гастропанели»);
· тестирование на наличие Н.pylori (С13 мочевинный дыхательный тест) и проведение эрадикационной антихеликобактерной терапии в случае обнаружения Н. pylori.
Первый этап профилактики ЯБ:
· предотвращение развития и инфицирования Helicobacter pylori;
· неукоснительное соблюдение гигиены полости рта;
· полностью отказаться от табакокурения и употребления спиртосодержащих напитков;
· еда должна быть сбалансированной исходя из возраста человека – организма. Следует так же категорически исключить из рациона острую, копченую и другую подобную пищу, а обратить внимание на приемлемую кулинарную обработку продуктов. Ограничить себя от газированных напитков, кофеинсодержащих, а так же сильно холодных и горячих продуктов;
· недопущение неоправданного, бессистемного приема лекарств, способных спровоцировать язву;
· привлечение к спортивным, трудовым мероприятиям, рекомендованному отдыху. Отводить время для сна не менее 6-8 часов в сутки, соблюдая режим дня. Детям и подросткам выполнять свои возрастные нормы;
· избегать психоэмоциональных перегрузок.
Второй этап профилактики ЯБ:
· немедленная госпитализация с впервые выявленным заболеванием дуоденальной язвы и язвы желудка;
· врач должен назначить медикаментозную терапию, фитотерапию, прием минеральной воды, физиотерапевтические процедуры с противорецидивной помощью в периоды весны и осени;
· лечебные и всесторонние меры инфекционных заболеваний, которые способны привести к язвенной болезни;
· соблюдение специальной противоязвенной диеты.
ФТ методы

При язве желудка физиотерапевтические процедуры не проводят до полного подтверждения доброкачественного характера поражения.
Стадии развития ХАП.
1) Воспалительная – выявляются повреждения эпителиальных клеток панкреатических протоков, воспалительная инфильтрация паренхимы различных участков ПЖ;
2) Кальцифицирующая – развиваются фиброз и обтурация протоков, а также появляются очаги обызвестления в паренхиме ПЖ и формируются камни в ее протоках.
Факторы патогенеза ХАП.
1. Токсико-метаболическое и повреждающее действие на ПЖ (развиваются дегенеративные и выраженные гипоксические изменения в ацинарных клетках, образуются очаги дегенерации в цитоплазме АК эпителия протоков, некроз, атрофия, фиброз, кальцификация железы).
2. Нарушение функции сфинктера Одди (уменьшение амплитуды его сокращений и увеличение количества ретроградных перистальтических волн) и повышение давления в панкреатическом протоке.
3. Нарушение секреторной функции ПЖ и преципитация белка в ее протоках (снижается преимущественно секреция воды и бикарбонатов, секреция пищеварительных ферментов уменьшается в меньшей степени. В итоге – уменьшение объема жидкой части П секрета, увеличение его вязкости и преципитация белка).
4.Усиленное выделение с желчью продуктов окисления жирных кислот и перекисных соединений, которые попадают в П проток при наличии дуодено-панкреатического рефлюкса.
Повышение давления в протоках и расстройство оттока секретов вызывают обострения ХП.Постепенно железа замещается фиброзной тканью, масса паренхимы становится меньше и меньше, обострения возникают реже, вместо боли появляются признаки экскреторной и инкреторной недостаточности ПЖ.
Патогенез ХКП.
· Нарушение формирования растворимых белково-кальциевых асссоциатов, которые представляют собой нерастворимый фибриллярный белок (литостатин – в норме присутствует в панкреатическом соке здоровых людей и ингибирует агрегацию и образование кристаллов солей кальция) в сочетании с отложениями карбонатов кальция.
· При ХКП уменьшен синтез литостатина в условиях повышенной потребности в нем.
Оцениваемые параметры.
1. кальцификация поджелудочной железы ---------------------4
2. характерные гистологические изменения-------------------4
3. характерные изменения по УЗИ или ЭРХПГ (см. Кембриджскую классификацию) -------3
4. экзокринная недостаточность поджелудочной железы----2
5. приступы панкреатита и/или хроническая абдоминальная боль-------------------------------2
6. сахарный диабет----------------------------------------------------1
ОСЛОЖНЕНИЯ
• кисты/псевдокисты с инфекцией и без, абсцессы
• портальная гипертензия,вызванная тромбозом воротной или селезеночной вены
• кровотечение/псеадоаневризмы
• асцит
• непроходимость/стриктура прооков ПЖ и/или желчного протока
• свищ ПЖ
• дуоденальный стеноз
• рак ПЖ
КЛИНИЧЕСКИЕ СИМПТОМЫ
Эндокринная недостаточность
• нет
• латентный сахарный диабет
• клинически выраженный сахарный диабет
Клиника.
1. Боль в эпигастральной области и(или) в правом и(или) левом подреберье.
2. Нарушения пищеварения (различные диспептические расстройства, панкреатогенные поносы, обусловленные нарушениями выделения ферментов ПЖ, кишечного пищеварения и раздражением кишечника ненормальным составом химуса. Характерны полифекалия со стеатореей).
3. Развитие механической желтухи.
4. Синдром недостаточности кишечного всасывания (синдром мальабсорбции).
5. Симптомы вторично присоединившегося сахарного диабета.
Варианты патогенеза панкеатической боли у больных ХП:
1. «Болезнь малых протоков»
*воспалительно-деструктивные изменения паренхимы, интерстиция, капсулы ПЖ
*повышение давления в ткани ПЖ (растяжение капсулы)
*ишемия ПЖ
*псевдокисты и кисты ПЖ
*внешнесекреторная недостаточность ПЖ
2.«Болезнь больших протоков»
*внутрипротоковая гипертензия
-деструкция протокового эпителия;
3.Паранкреатические боли
*парапанкреатит
*пара- и перипанкреатический фиброз с вовлечением нервных стволов, развитием холедохо- и/или дуоденостеноза,
кист сальниковой сумки;
4.Боли, связанные с осложнениями ХП со стороны других органов
*панкреатогенные гастродуоденальные язвы
*тромбоз селезеночной, портальной вен
*абдоминальный ишемический синдром (ишемия др.органов брюшной полости как следствие ХП)
*раздражение (воспаление) брюшины
*плеврит
*компрессия и/или смещение желудка, ДПК, портальной вены;
*соляропатия (солярит);
5. Псевдопанкреатические боли.
Причины стеатореи.
1. Деструкция ацинарных клеток ПЖ и уменьшение синтеза и секреции панкреатической липазы.
2. Обтурация протоковой системы и нарушение поступления панкреатического секрета в 12 ПК.
3. Снижение секрета бикарбонатов протоковыми клетками железы, уменьшение рН содержимого 12 ПК и денатурация при этих условиях липазы.
Лечение.
1. Диета с резким ограничением жира, органических кислот, молока – 4-х разовое питание.
2. Чреззондовая аспирация желудочного сока.
3. Антациды.
4. Н2-гистаминоблокаторы.
5. Диуретики.
6. Холинолитики, миотропные спазмолитики.
7. Гемодез, р-р альбумина, плазма.
8. Антибиотики широкого спектра действия.
9. Подавление активности панкреатических ферментов.
10. Устранение этиологического фактора (алкоголизм, ЖКБ).
11. Ферменты (при стеатореи с потерей жира более 15 г/сутки, сочетающуюся с поносом и уменьшением массы тела).
12. Компенсация нарушенных процессов всасывания в тонкой кишке.
13. Хирургическое лечение.
Эффективность лечения препаратами панкреатических ферментов и контроль правильности и адекватности подобранной дозы препаратов осуществляется, ориентируясь на динамику субъективных ощущений больных и некоторых объективных показателей:
ü Уменьшение диспептических проявлений, метеоризма, тенденция к нормализации стула (частоты и его характера).
ü Положительная динамика копрологических исследований.
Рекомендации по подбору дозы полиферментного препарата у больных ХП в соответствии данными фекальной эластазы
| Состояние экзокринной функции ПЖ | Данные эластазы кала(мкг/г) | Рекомендуемая доза препарата ЕД Р1Р липазы в сутки |
| Нормальная экзокринная функция ПЖ | Более 200 | 50 000 (1 капсула креона 10000-5 раз в день) |
| Умеренно выраженная экзокринная недостаточность | 100-199 | 100 000 (2 капсулы креона 10000- 5 раз в день) |
| Выраженная экзокринная недостаточность | Менее 100 | 150 000 (1 капсула креона 25000 - 6 раз в день) |
Жалобы.
| Симптомы | Определение |
| Боли в эпигастрии | Под эпигастрием понимается область, расположенная между мечевидным отростком грудины и пупочной областью и ограниченная справа и слева соответствующими среднеключичными линиями. Некоторые больные могут интерпретировать свои жалобы не как боли, а как неприятные ощущения. |
| Чувство жжения в эпигастрии | Представляет собой неприятные жгучие ощущения в эпигастральной области. |
| Чувство переполнения в эпигастрии после еды | Представляет собой неприятное ощущение длительной задержки пищи в желудке. |
| Раннее насыщение | Чувство, что желудок переполняется вскоре после начала приема пищи независимо от объема съеденной пищи, в результате чего прием пищи не может быть завершен. |
О синдроме боли в эпигастрии (СБЭ) принято говорить в тех случаях, когда у больного, по меньшей мере, 1 раз в неделю, отмечаются умеренные или выраженные боли или чувство жжения в эпигастральной области. При этом боли не носят постоянный характер, связаны с приемом пищи или возникают натощак, не локализуются в других отделах живота, не уменьшаются после дефекации и не сопровождаются признаками дисфункции желчного пузыря или сфинктера Одди. Синдром боли в эпигастрии может сочетаться с постпрандиальным дистресс-синдромом.
В свою очередь, наличие постпрандиального дистресс-синдрома (ППДС) можно предполагать в тех ситуациях, когда у больного чаще 3 раз в неделю, после еды, при приеме обычного объема пищи возникают чувство переполнения в эпигастрии или раннее насыщение. При этом постпрандиальный дистресс-синдром может сочетаться с тошнотой и синдромом боли в эпигастрии.
Физик.обследование. При осмотре пациента специфических симптомов не обнаруживается.
Лабораторная диагностика. К основным методам диагностики относятся клинический и биохимический анализы крови, анализ кала, гастродуоденоскопия, ультразвуковое исследование, исследование инфекции H.pylori.
Инструментальная диагностика. Всем больным с подозрением на ФД рекомендовано проведение эзофагогастродуоденоскопии. Всем больным с подозрением на ФД рекомендуется проведение ультразвукового исследование органов брюшной полости
Дифференциальный диагноз с воспалительными заболеваниями кишечника.
ФД – это диагноз исключения, который может быть поставлен только после тщательного обследования больного.
При постановке диагноза СРК, как и в предыдущих версиях, остается важным не только сопоставление соответствия выявленных симптомов Римским IV диагностическим критериям, но обязательно должны быть исключены симптомы «тревоги», представленные в табл. 7


Причины ГН
Инфекционные заболевания
| Сосудистая патология | Патология клубочка почки |
| Гранулематоз Вегенера | Синдром Гудпасчера |
| Чарга-Стросса васкулит | Постинфекционный гломерулонефрит |
| Пурпура Шонляйна-Геноха | IgA-нефропатия (болезнь Бергера) |
| Узелковый полиартериит | СКВ |
| Гемолитико-уремический синдром | Идиопатический БПГН |
| Криоглобулинемия | Синдром Альпорта (наследственная патология почек+зрение+слух) |
| Амилоидоз |
Патогенез. Патогенез гломерулонефрита связывают с иммунными нарушениями. В ответ на проникновение в организм инфекционного агента образуются антитела к антигенам стрептококка, которые, соединяясь с ними, образуют иммунные комплексы, активирующие комплемент. Наибольшее значение имеет антиген стрептококка эндострептозин (цитоплазматический антиген со стрептокиназной активностью) и нефритогенный плазминсвязывающий белок, обладающий высоким сродством к структурам почечного клубочка. Иммунные комплексы сначала циркулируют в сосудистом русле, а затем откладываются на поверхности базальной мембраны клубочковых капилляров и в мезангии клубочков. Привлеченные в очаг провоспалительные клетки выделяют повреждающие лизосомальные ферменты (протеазы), способствующие стимуляции и пролиферации клеток клубочка и мезангия.
Кроме антигенов бактериального происхождения, в образовании иммунных комплексов могут принимать участие и другие экзогенные антигены (лекарственные препараты, чужеродные белки и др.). Фактор, непосредственно вызывающий клубочковое поражение, - комплемент: продукты его расщепления вызывают локальные изменения стенки капилляров и повышают ее проницаемость.
Пролиферация клеток мезангия и эндотелия способствует элиминации иммунных комплексов из организма. Если этот процесс оказывается достаточно эффективным, то наступает выздоровление. Патогенез ОГН называют иммунокомплексным (в состав иммунных комплексов входит стрептококковый антиген). Если иммунных комплексов много и базальная мембрана существенно повреждается, то выраженная мезангиальная реакция будет приводить к хронизации процесса и развитию неблагоприятного варианта болезни - быстро прогрессирующего экстракапиллярного гломерулонефрита.
Клиническая картина.
ОГ развивается через 2-3 недели после стрептококковой инфекции. Проявляется острым нефритическим синдромом (гематурия и протеинурия до 3,5 г/л), гипергидратацией и повышением артериального давления.
+ Симптоматология. Общие проявления*
- Розовая или цвета колы или «мясных» помоев» моча – гематурия.
- Моча с хлопьями – протеинурия
- Высокое артериальное давление
- Признаки задержки жидкости (отеки лица, рук, стоп и живота)
- Слабость (анемия, ХПН)
*зависит от причины и характера течения болезни
Мочевой синдром
Изменения в моче – микрогематурию, лейкоцитурию, цилиндрурию и протеинурию менее 3,5 г/сут называют мочевым синдромом. Иногда он бывает единственным проявлением заболевания почек, в таких случаях ставят диагноз изолированного мочевого синдрома.
Формулы для определения СКФ
1.
2.
3. Формула CKD-EPI
Для мужчин: СКФ= 141 x min (Scr**/0,9), 1)-0,411 x max (Scr**/0,9), 1)-1,209 x 0,993Возраст
Для женщин: СКФ= 144 x min (Scr**/0,7), 1)-0,329 x max (Scr**/0,7), 1)-1,209 x 0,993Возраст
**креатинин сыворотки, мг/дл
Диагностика.
1. Общий анализ мочи.
2. Анализ мочи по Нечипоренко.
3. Общий анализ крови.
4. Биохимическое исследование крови с определением уровня креатинина, общего белка и его фракций, электролитов, параметров коагклограммы.
5. Определение уровня сывороточного комплемента, титров антител к стрептолизину – О, стрептогиалуронидазе, стрептокиназе, зимогену или ДНКазе В (особое диагностическое значение имеет прирост титра антител, сохраняющийся на протяжении месяца от дебюта инфекции с последующим снижением).
6. Проба Реберга
7. Проба Зимницкого или Фольгарда.
8. Посев мочи на стерильность.
9. Офтальмоскопия (осмотр глазного дна).
10. ЭКГ и регистрация артериального давления.
11. УЗИ почек и мочевого пузыря.
12. Контроль поступления и потери жидкости.
Исходы.
При ОГН прогноз благоприятный при постстрептококковом ГН: спонтанное выздоровление наступает почти у всех пациентов (85–90%), даже с ОПН острой фазы и с полулуниями в ранней почечной биопсии. При эпидемических постстрептококковых ОГН: более 95% детей и взрослых клинически выздоравливают в течение 3–6 мес, при спорадических — лишь 60%. Постстрептококковый ОГН постепенно разрешается после того, как инфекция исчезла, нормализация уровня комплемента происходит в течение 6 недель, гематурия исчезает за 3-6 месяцев, микрогематурия может сохраняться до 1 года, восстановление диуреза происходит в первую неделю, нормализация креатинина — через 3-4 нед одновременно с гистологическим улучшением, уровень C3 нормализуется в течение 8 недель после начала постстрептококкового ГН. Протеинурия снижается медленнее, в течение 6 мес и в минимальном количестве сохраняется у 15 % в течение 3 лет и у 2 % — от 7 до 10 лет. Протеинурия нефротического уровня может сохраняться в течение 6 мес или более после исчезновения гематурии. Рецидивы постстрептококкового ГН не характерны из-за стойкого продолжительного иммунитета к M–протеину стрептококка. Нефрит, ассоциированный с MRSA и хроническими инфекциями, обычно разрешается после устранения инфекции. У 5% детей и 10% взрослых развивается ХГН (с прогрессированием ХБП) и крайне редко - быстропрогрессирующий гломерулонефрит. Прогрессирование нефрита с развитием почечной недостаточности через 10 - 40 лет после начала болезни обусловлено развитием гломерулосклероза. Прогноз у взрослых и особенно у пожилых менее благоприятный, чем у детей. Необратимая ОПН развивается у 1 % детей и несколько чаще у взрослых. Летальность невелика и связана в основном с осложнениями — кровоизлияниями в мозг, острой сердечной недостаточностью, инфекционными осложнениями и тромбозами при развитии ОПН.
Осложнения.
Осложнения ГН
- ОПН (Острая потеря фильтрационной способности почки (требуется проведение острого диализа))
- ХПН (Постепенная потеря фильтрационной способности почки (диализ, трансплантация))
- Артериальная гипертензия (За счет снижения СКФ и накопления в крови азотистых оснований)
- Нефротический синдром (за счет потери белка)
Причины ГН
Инфекционные заболевания
| Сосудистая патология | Патология клубочка почки |
| Гранулематоз Вегенера | Синдром Гудпасчера |
| Чарга-Стросса васкулит | Постинфекционный гломерулонефрит |
| Пурпура Шонляйна-Геноха | IgA-нефропатия (болезнь Бергера) |
| Узелковый полиартериит | СКВ |
| Гемолитико-уремический синдром | Идиопатический БПГН |
| Криоглобулинемия | Синдром Альпорта (наследственная патология почек+зрение+слух) |
| Амилоидоз |
Патогенез. Существует два возможных механизма поражения почек: иммунокомплексный и антительный.
Иммунокомплексный механизм аналогичен таковому при ОГН. ХГН развивается в тех случаях, когда гиперплазия эндотелия и мезангиальных клеток оказывается недостаточной и иммунные комплексы не удаляются из почки, что приводит к хроническому течению воспалительного процесса. Развитие ХГН также обусловлено и антительным механизмом, когда в ответ на внедрение в организм различных антигенов иммунокомпетентная система вырабатывает тропные к базальной мембране капилляров антитела, которые фиксируются на ее поверхности. Происходит повреждение мембраны, и ее антигены становятся чужеродными для организма, в результате чего вырабатываются аутоантитела, которые также закрепляются на базальной мембране. Комплемент оседает на мембране в зоне локализации комплекса «аутоантиген-аутоантитело». В дальнейшем происходит миграция клеток воспаления (нейтрофилов, макрофаговмоноцитов, тромбоцитов) в очаг повреждения. Они выделяют повреждающие факторы - активные радикалы кислорода, прокоагулянтные молекулы, протеазы, вазоактивные субстанции (эндотелин, эндотелиальный релаксирующий фактор), а также цитокины (ИЛ-1, фактор некроза опухолей, тромбоцитарный фактор роста и др.), которые стимулируют пролиферацию собственных клеток почечных клубочков (мезангиальных, эндотелиальных и эпителиальных). Активация свертывающей системы усиливает коагулирующую активность и отложение фибрина в зоне расположения антигена и антитела. Хроническое течение процесса обусловлено постоянной выработкой аутоантител к антигенам базальной мембраны капилляров.
В процессе прогрессирования ХГН также принимают участие неиммунные механизмы: гемодинамические, среди которых следует упомянуть повреждающее действие АГ, внутриклубочковой гипертензии и гиперфильтрации, и метаболические (гиперхолестеринемия, гиперкоагуляция, усиление активности перекисного окисления липидов, отложение солей кальция в ткани почек). Кроме того, отмечают уменьшение синтеза простагландинов, ухудшающее почечную гемодинамику.
Длительный волнообразно протекающий воспалительный процесс с периодами ремиссий и обострений, в конце концов приводит к склерозу, гиалинозу, запустеванию клубочков и развитию ХПН. Морфологические варианты ХГ: пролиферативные (IgA-нефропатия, мезангиопролиферативный, мембранопролиферативный) и непролиферативные (болезнь минимальных изменений или липоидный нефроз, мембранозный гломерулонефрит, фокально-сегментарный гломерулосклероз).
Клиническая картина.
Жалобы на головную боль, потемнение мочи, отеки или пастозность ног, лица или век. Могут быть жалобы на тошноту, рвоту, головную боль. ОГН следует заподозрить при впервые развившемся нефритическом синдроме (С) ― появлении через 1–3 нед после стрептококковой или другой инфекции триады симптомов: гематурии с протеинурией, АГ и отёков. При позднем обращении к врачу (через неделю от начала и позже) возможно обнаружение изменений только в моче без отеков и АГ (С). Изолированная гематурия при постинфекционном нефрите разрешается в течение 6 мес.
При ХГН выявляется один из клинико-лабораторных синдромов (мочевой, гематурический, гипертонический, нефротический, смешанный). При обострении появляются или нарастают отеки век/нижних конечностей, уменьшение диуреза, потемнение мочи, повышение АД, головная боль; при латентном ХГН клинических проявлений заболевания может не быть. В ремиссию клинические проявления и жалобы могут отсутствовать. Для IgA нефрита, как и для ОГН, характерна гематурия, однако стойкая микрогематурия более типична для IgA нефропатии. При IgA нефрите инкубационный период чаще короткий ― менее 5 дней.
При ХГН в отличие от ОГН, выявляется гипертрофия левого желудочка; ангиоретинопатия II–III степени; признаки ХБП. Для БПГН характерно острое начало с нефритического, нефротического или смешанного синдромов, прогрессирующее течение с появлением в течение первых месяцев заболевания признаков почечной недостаточности. Клинические проявления заболевания неуклонно нарастают; присоединяются азотемия, олигоанурия, анемия, никтурия, резистентная артериальная гипертензия, сердечная недостаточность. Прогрессирование до терминальной почечной недостаточности возможно в течение 6-12 мес, при эффективности лечении возможно улучшение прогноза.
+Клинические синдромы: мочевой, нефритический, нефротический. Мочевой синдром – гематурия и/или протеинурия менее 3,5 г/сут. Нефритический синдром – мочевой синдром + гипергидратация + артериалная гипертензия. Нефротический синдром – облигатные критерии: протеинурия более 3,5 г/сут, гипоальбуминемия менее 30 г/л, факультативные критерии: гиперлипидемия, гиперкоагуляция, гипергидратация и др.
+ N.B.: Относительное соответствие морфологических вариантов и клинических форм
| Пролиферативные | НЕПРОлиферативные |
| Нефритический синдром | НЕФРОтический синдром |
| Протеинурия < 3,5 г/л Гематурия (эритроцитарные цилиндры) Гипертензия Олигурия | ПРОтеинурия > 3,5 г/сут Гипоальбуминемия Отеки Гиперлипидемия |
Мочевой синдром
Изменения в моче – микрогематурию, лейкоцитурию, цилиндрурию и протеинурию менее 3,5 г/сут называют мочевым синдромом. Иногда он бывает единственным проявлением заболевания почек, в таких случаях ставят диагноз изолированного мочевого синдрома.
Формулы для определения СКФ
1.
2.
3. Формула CKD-EPI
Для мужчин: СКФ= 141 x min (Scr**/0,9), 1)-0,411 x max (Scr**/0,9), 1)-1,209 x 0,993Возраст
Для женщин: СКФ= 144 x min (Scr**/0,7), 1)-0,329 x max (Scr**/0,7), 1)-1,209 x 0,993Возраст
**креатинин сыворотки, мг/дл
Диагностика.
Для диагностики ГН абсолютно необходима биопсия почки – позволяет определить морфологический тип (вариант) ГН, единственным исключением является стероид- чувствительный НС у детей, когда диагноз устанавливается клинически, биопсия у таких пациентов остается в резерве на случай атипичного НС (ГН KDIGO, 2012). На амбулаторном этапе необходимо заподозрить ГН и направить пациента в нефрологическое отделение для проведения биопсии и установления окончательного диагноза ГН. Однако при отсутствии или ограниченной возможности проведения биопсии диагноз ГН устанавливается клинически.
Общие принципы лечения ГН
- Оценить, на сколько велики активность и вероятность прогрессирования нефрита и оправдывают ли они риск применения тех или иных терапевтических воздействий
- Добиться обратного развития поражения почек (в идеале полного выздоровления)
- Остановить прогрессирование нефрита или хотя бы замедлить темп нарастания почечной недостаточности
Глюкокортикоиды
- Противовоспалительное и иммунодепрессивное действие
- Нарушают адгезию нейтрофилов к эндотелию капилляров, блокируют выделение цитокинов
- Тормозят противоопухолевую и антимикробную активность макрофагов
- Назначение: в зависимости от тяжести назначают 1-2 мг/кг в сут в течение 1-6 месяцев. Можно давать внутрь в 2-3 приема.
- Пульс-терапия проводится внутривенно капельно в течение 20-40 мин 0,5-1,5 г метилпреднизолона. Ее повторяют затем еще 2 раза в последующие 2 дня до достижения общей дозы 3-4 г.
Побочные действия (увеличение массы тела, диабет, остеопороз)
Отмена преднизолона [2,5 г/нед], т.е. постепенно
Цитостатические препараты
Циклофосфамид
- Механизм действия: перекрестное связывание нуклеиновых кислот, что нарушает процесс необходимой для синтеза белка транскрипции информации и соответственно клеточного деления
- Назначают 2-2,5 мг/кг в сут.
- Контроль числа лейкоцитов в крови!
Побочные эффекты циклофосфамида (рак, бесплодие, инфекция)
2. Азатиоприн. Ингибирует ферменты, необходимые для синтеза ДНК, поэтому подавляет любой иммунный ответ, требующий клеточного деления.
- Назначается 1-3 мг/кг в сут.
- По сравнению с ЦФМ действует менее активно, однако вызывает меньшее число побочных явлений.
Циклоспорин А.
- Подавляет активность – Т-хелперов, способствует синтезу ИЛ-2, активации В-клеток.
- Может быть альтернативным методом лечения больных ГН с резистентным к стероидам или зависимым от стероидов НС.
- Показан при минимальных изменениях и ФСГС
4.Такролимус. Ингибитор лейкотриена. Похож по действию. На Циклоспорин А.
5.Мофетила микофенолат. Ингибитор инозин-монофосфат-дегидрогеназы.
Последний повышает выживаемость больных из-за меньшего числа септических осложнений.
Микроцитарные анемии. ЖДА.
- гипохромия
- микроцитоз
- снижение уровня сывороточного железа
- повышение ОЖСС
- снижение ферритина сыворотки
Этиопатогенез:
Внешние причины: алиментарные и токсические
Внутренние причины:
- Физиологические: детский юношеский возраст, профессиональный спорт, беременность
Патологические: кровопотери, нарушение всасывания, опухоли
+
Этиология
Существует несколько основных причин дефицита железа.
• Скрытые (оккультные) кровотечения:
- желудочно-кишечные (язвенная болезнь, геморрой, рак, диафрагмальная грыжа, НЯК, полипоз желудка и кишечника);
- маточные (дисфункция яичников, фибромиома матки, рак шейки матки, эндометриоз и др.);
- легочные (рак, бронхоэктазы, изолированный легочный гемосидероз).
• Недостаточное потребление железа с пищей.
• Повышенный расход железа:
- беременность, лактация;
- период роста и полового созревания;
- хронические инфекционные заболевания, опухоли.
• Нарушение всасывания железа:
- резекция желудка;
- энтерит;
- спру.
• Нарушение транспорта железа (дефицит белка плазмы крови трансферрина).
Из перечисленных причин следует, что ЖДА чаще развивается у женщин в результате обильных маточных кровотечений и повторных беременностей, а также у подростков.
Патогенез
Важнейшая функция железа в организме - его участие в синтезе гема, служащего составной частью гемоглобина. При дефиците железа прежде всего возникает нарушение синтеза гемоглобина, что приводит к развитию ЖДА. Недостаточное образование гемоглобина служит причиной гипоксии тканей и развития циркуляторно-гипоксического синдрома. Дефицит железа также способствует нарушению синтеза тканевых ферментов, что приводит к изменению тканевого метаболизма, при этом происходит поражение быстро обновляющихся эпителиальных тканей - слизистой оболочки ЖКТ, кожи и ее дериватов.
Анемический синдром.
2. Сидеропенический синдром обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов:
- Извращение вкуса (желание есть землю, глину, мел и др.)
- Извращение обоняния
- Выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы
- Дистрофические изменения кожи и ее придатков (сухость, шелушение, образование трещин на коже, тусклость, ломкость волос, истончение, ломкость, поперечная исчерченность ногтей)
- «Заеды» в углах рта (ангулярный стоматит)
- Ощущение боли и распирания в области язвка, пораснение его кончика, атрофия сосочков (глоссит)
- Атрофические изменения слизистой оболочки ЖКТ: сухость слизистой оболочки пищевода с затруднением и болью при глотании пищи, особенно сухой
- Императивные позывы на мочеиспускание, невозможность удержать мочу при смехе, кашле и др.
- «Сидеропенический субфебрилитет»
- Предрасположенность к ОРВИ
- Снижение репаративных процессов в коже и слизистых
+Клиническая картина болезни, как это вытекает из схемы патогенеза, складывается из следующих синдромов:
• циркуляторно-гипоксического (при достаточной выраженности анемии и кислородного голодания тканей);
• поражения эпителиальных тканей (гастроэнтерологические расстройства, трофические нарушения кожи и ее дериватов);
• гематологического (анемия гипохромного типа и признаки дефицита железа).
Кроме этих синдромов, клиническую картину также определяет заболевание, на основе которого развилась ЖДА (например, язвенная болезнь желудка или двенадцатиперстной кишки с повторными кровотечениями, мено- и метроррагии, какие-либо хронические инфекционные поражения и др.). Имеет значение и стадия течения анемии:
• скрытый дефицит железа, манифестирующий снижением концентрации сывороточного железа при отсутствии уменьшения содержания гемоглобина;
• тканевый сидеропенический синдром (манифестирует гастроэнтерологическими расстройствами, трофическими изменениями кожи и ее дериватов);
• анемия (снижение концентрации гемоглобина).
При исследовании периферической крови обнаруживают снижение концентрации гемоглобина, микроцитоз (увеличение количества эритроцитов малого диаметра) и гипохромию эритроцитов, снижение цветового показателя и среднего содержания гемоглобина в эритроците (массовое и процентное). Содержание ретикулоцитов в норме или повышено. Изменяются показатели обмена железа: уменьшается содержание свободного железа в сыворотке крови и насыщение трансферрина железом; повышается общая железосвязывающая способность сыворотки и концентрация общего трансферрина. Это связано с тем, что в организме снижено содержание железа. Для определения его резервов железа в организме применяют десфераловую пробу. В норме взрослый человек после введения дефероксамина в дозе 500 мг теряет 0,6-1,3 мг железа с мочой. При ЖДА содержание железа в моче после введения препарата значительно ниже (0,2-0,4 мг), что указывает на уменьшение запасов железа в организме. Дефероксамин - продукт метаболизма актиномицетов, способный связывать железо. Известное представление об уменьшении запасов железа в организме можно получить, изучая всасывание радиоактивного железа. При ЖДА оно повышается.
В костном мозге при ЖДА отмечают уменьшение количества сидеробластов - эритрокариоцитов, содержащих железо (как известно, в норме 20-40% эритрокариоцитов костного мозга содержат единичные гранулы железа). В ряде случаев гранулы обнаружить не удается.
Критерии диагноза:
Диагноз ОЛЛ ставится на основании обнаружения в пунктате костного мозга более 25% лейкемических клеток, для которых с помощью мультипараметрической проточной цитометрии и данных цитохимии доказан один из вариантов лимфоидной дифференцировки бластных клеток и показано отсутствие активности миелопероксидазы и неспецифической эстеразы, как ключевых маркёров нелимфоидных клеток-предшественников
Диагноз нейролейкоза (инициальное поражение ЦНС) ставится на основании наличия бластных клеток в ликворе и/или наличия парезов черепно-мозговых нервов, не связанных с другими заболеваниями или повреждениями и/или наличия образования в ЦНС или оболочках по данным КТ/МРТ. В результате анализа ликвора возможны следующие варианты (группа БФМ):
• CNS1 пункция не травматичная (< 10 RBC/µl), отсутствие лейкемических клеток
• CNS2 пункция не травматична, £ 5 лейкоцитов/µl ,
• CNS3 пункция не травматична, > 5 лейкоцитов/µl CSF, наличие лейкемических клеток после цитоцентрифугирования
• TLP+ - травматичная пункция с примесью лейкемических клеток
• TLP- - травматичная пункция, отсутствие примеси лейкемических клеток
Диагноз рецидива ОЛЛ:
Костномозговой рецидив: изолированный КМР диагностируется при обнаружении в костном мозге 25% и более лимфобластов, без одновременного поражения ЦНС и/или другого экстрамедулярного поражения. Одновременно увеличение печени, селезенки, лимфоузлов или миндалин допустимо при данном диагнозе.
ЦНС–рецидив: изолированный ЦНС-рецидив доказывается содержанием лимфобластов в ликворе при цитологическом исследовании, а также неврологическими симптомами, не связанными с дркгими заболеваниями и повреждениями. При внутричерепном образовании на КТ/МРТ и при отсутствии бластов в ликворе, крови и костном мозге, для диагностирования изолированного рецидива ЦНС необходимо получить гистологическое подтверждение или провести однофотонную эмиссионную КТ головного мозга. В костном мозге число бластных клеток должно составлять менее 5%.
Тестикулярный рецидив: диагноз изолированного рецидива яичка диагностируется при появлении одно- или двустороннего безболезненного яичка и значительного увеличения его плотности при пальпации (объем яичка с отклонением от нормы более чем на 2 единицы, измеряемое орхидометром Прадер) и требует гистологического подтверждения манифестации ОЛЛ в одном или двух яичках. Диагноз изолированного рецидива яичка ставится только в том случае, когда в костном мозге менее 5% лимфобластов и нет поражения ЦНС.
Особые локализации рецидивов: первичный рецидив в коже, кости, орбите, средостении, изолированном лимфоузле, миндалине. Поражение костного мозга (25% и более лимфобластов) представляют собой КМР с одновременным увеличением лимфоузлов и миндалин. Особые локализации рецидивов - это те, которые поражены изолированно от костного мозга, ЦНС или яичек. Для постановки диагноза рецидива особой локализации необходимо подтверждение с помощью биопсии. В случае рецидива в сетчатке достаточно обнаружения при офтальмологическом обследовании специфической картины лейкемической инфильтрации.
Комбинированные рецидивы: сочетание двух и более поражений различной локализации. При комбинированных рецидивах костный мозг считается пораженным при наличии 5% и более лимфобластов.
По времени возникновения рецидивы подразделяю на очень ранний, ранний и поздний:
Таблица 5. Распределение рецидивов ОЛЛ у детей по времени возникновения
| Тип рецидива | Отношение к инициальному диагнозу | Отношение к окончанию поддерживающей терапии |
| Поздний | Не имеет значения | Более 6 месяцев |
| Ранний | Более 18 месяцев | Менее 6 месяцев |
| Очень ранний | Менее 18 месяцев | Менее 6 месяцев |
+Диагноз острого лейкоза устанавливается на основании морфологического исследования периферической крови и аспирата костного мозга.
Методы исследования:
- морфологические
- цитохимические
- иммунофенотипирование
- цитогенетический анализ
- молекулярно – генетический анализ
- инструментальные (рентгенологический, УЗИ, МРТ, СКТ, ЭКГ, ЭхоКГ, люмбальная пункция)
- Дополнительные (коагулограмма, вирусологические, биохимические)
Существуют три варианта ОЛЛ - L1, L2, L3 и семь вариантов ОМЛ:
· М0 - недифференцированный ОМЛ;
· М1 - миелобластный лейкоз без созревания клеток;
· М2 - миелобластный лейкоз с неполным созреванием клеток;
· М3 - промиелоцитарный лейкоз;
· М4 - миеломоноцитарный лейкоз;
· М5 - монобластный лейкоз;
· М6 - эритролейкоз;
· М7 - мегакариобластный лейкоз.
FAB - классификация ОЛЛ:
L1 – Мелкоклеточный мономорфный тип – мелкие одинаковые бластные клетки, единичные незаметные нуклеолы, правильное очертание ядра, частый вариант.
L2 – Крупноклеточный гетерогенный тип – крупные бласты, больше нуклеол разных размеров, неправильной формы, часто расщепленные ядра с отчетливыми ядрышками.
L3 – Беркитг- тип большие одинаковые бласты, сильно выраженная базофильная цитоплазма с вакуолями, ассоциируется с В-клеточным фенотипом.
Иммунологическая классификация ОЛЛ:
| В-линейная ОЛЛ | |
| Про-В ОЛЛ | у 5% детей, 11% взрослых |
| Общий ОЛЛ | у 65% детей, 51% взрослых |
| Пре-В ОЛЛ | у 15% детей, 10% взрослых |
| В- клеточный | у 3% детей, 4% взрослых |
| Т-линейная ОЛЛ | |
| Пре-Т ОЛЛ | у 1% детей, 7% взрослых |
| Т-клеточный ОЛЛ | у 11% детей, 17% взрослых |
Фазы заболевания:
Различают:
- Первично-активную фазу острого лейкоза (вновь диагностированный лейкоз до момента достижения ремиссии)
- Ремиссию заболевания
- Рецидив заболевания (ранний – до года, поздний – через год)
- Резистентная форма
Ремиссия острого лейкоза может быть клинико-гематологической, цитогенетической, молекулярно-генетической в зависимости от наличия соответствующих признаков заболевания.
Полная клинико-гематологическая ремиссия определяется по критериям CALGB как наличие менее 5% бластов в морфологически нормальном костном мозге при нормальной периферической крови (т.е. гемоглобин более 120г/л, полиморфоядерные нейтрофилы более 1,5х109/л, тромбоцитов более 100х103). Рецидив острого лейкоза означает появление признаков заболевания после некоторого периода ремиссии.
Дифференциальная диагностика
- Бластный криз хронического миелолейкоза
- Инфекционный мононуклеоз
- Агранулоцитоз
- Миелодиспластический синдром
- Гипопластическая анемия
Осложнения ОЛЛ:
1. Кровотечения (носовые, из слизистых, из глаз, может быть кровотечение в головной мозг).
2. Септические состояния (некротическая ангина, фурункулез, сепсис).
3. Гиперурикемия - увеличение мочевой кислоты, наблюдается при многих опухолях и лейкозах, особенно часто при остром лейкозе. В мочевую кислоту переходят пуриновые основания. Мочевая кислота блокирует почечные канальцы и может привести к анурии. Для предупреждения этого дают препарат аллопуринол, который снижает уровень мочевой кислоты + обильное питье.
4. Нейролейкомия - размножение клеток в костном мозге. Чаще встречается при лимфобластном варианте острого лейкоза. Проявляется упорными головными болями, неврологической симптоматикой. Для лечения в этом случае препараты вводят эндолюмбально, то есть минуя гематоэнцефалический барьер.
5. Анемия.
6. Геморрагический диатез.
Хронический миелолейкоз
ХМЛ - злокачественное заболевание гемопоэтической ткани, при котором неопластическая трансформация связана с поражением полипотентной стволовой клетки. В системе гемопоэза у больных ХМЛ происходит чрезмерное неконтролируемое нарастание количества миелоидных клеток-предшественников.
ХМЛ- миелопролиферативное заболевание, характеризующееся клональным распространением патологических полипотентных стволовых клеток, которые имеют специфическую хромосомную аномалию – так называемую филадельфийскую хромосому (Ph’). Суть данной аномалии состоит в том, что часть длинного плеча 22-й хромосомы перемещается на 9-ю, а часть 9-й на 22-ю, отчего возникает реципрокная (взаимная) транслокация t (9;22)(q34;q11).
Заболеваемость ХМЛ остается постоянной на протяжении последних десятилетий – ежегодная заболеваемость – 1-1,5 человека на 100 000 населения. В целом количество больных ХМЛ составляет около 15% от общего числа больных лейкозами.
Общепризнанными является выделение фаз ХМЛ: различают хроническую, прогрессирующую и бластную фазы ХМЛ. Существует разделение хронической фазы на раннюю и позднюю: ранняя диагностируется в период до 1 года поле установочная диагноза, поздняя – после этого. Каждая фаза, идентифицируемая клинически, представляет собой этап в развитии лейкозного процесса. Определение терапевтической тактики происходит в зависимости от фазы заболевания.
Хроническая фаза
- Сочетанное или изолированное увеличение селезенки
- Содержание лейкоцитов в периферической крови >80%х109/л.
- Сдвиг в лейкоцитарной формуле влево с общим количеством миелобластов и промиелоцитов более 5%
- Общая клеточность костного мозга >85%
- Общее количество клеток базофильного и эозинофильного рядов в костном мозге >6,5%
- Содержание клеток эритроидного ряда в костном мозге <5%
- Активность щелочной фосфатазы нейтрофилов периферической крови не более 20% при коэффициенте не выше 0,25
- Гиперплазия гемопоэтической ткани за счет клеток гранулоцитарного (часто в сочетании с мегакариоцитарным) ростка в трепанобиоптате костного мозга
Прогрессирующая фаза
Один из следующих признаков:
- Содержание бластных клеток в периферической крови не менее 15%
- Персистирующая тромбоцитопения (<100х10/л), не поддающаяся терапии
- Нарастающая спленомегалия и рост числа лейкоцитов, не отвечающие на лечение
- Обнаружение дополнительных хромосомных аномалий
Бластный криз – увеличение бластных клеток в периферической крови или костном мозге до 30% и более, а также выявление экстрамедуллярных бластных пролифератов и крупных скоплений из бластных клеток в биоптатах костного мозга.
Диагностика:
-ОАК
- Миелограмма
- Цитогенетика (Ph- хромосома)
- Молекулярно-генетическое исследование (BCR-ABL)
Лечение ХМЛ:
1. Химиотерапия (гидроскикарбромид, бусульфан, циторабин и др.)
2. Интерферонотерапия
3. Ингибиторы тиразинкиназы (иматиниб – гливек, нилотиниб – тасигна, дезатиниб – спрайсел и др.)
4. Трансплантация костного мозга
Диагностика. В большинстве случаев, диагноз базируется на характерных изменениях в числе лейкоцитов в периферической крови и лейкоцитарной формуле (более или менее выраженный левый сдвиг в гранулоцитарном ростке с определением клеток на всех уровнях созревания, тромбоцитоз, базофилия и эозинофилия). Спленомегалия, тромбоцитоз и базофилия также являются типичными для ХМЛ в первой хронической фазе. Тем не менее, у 40% больных симптомы болезни отсутствуют. Диагноз считается доказанным при обнаружении Филадельфийской (Ph) хромосомы (22q-), возникающей в результате сбалансированной транслокации t(9;22)(q34;q11), и/или при выявлении химерного онкогена BCR-ABL в клетках периферической крови или костного мозга. В некоторых случаях (примерно в 5%) Ph хромосома не обнаруживается, и подтверждение диагноза основывается на молекулярно-генетических методах, например, флюоресцентной in situ гибридизации (FISH) или обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР). Атипичный ХМЛ, по классификации ВОЗ, негативен по BCR-ABL, протекает без базофилии и сочетается с более или менее выраженной дисплазией эритроидного, миелоидного и мегокариоцитарного ростков кроветворения.
Лечение. По результатам рандомизации по генетическому маркеру, лекарственная терапия рекомендована в качестве первой линии лечения при ХМЛ, относительно аллогенной трансплантации стволовых гемопоэтических клеток (ТГСК), в связи с высоким риском токсичности, связанной с трансплантацией. Таким образом, аллогенная ТГСК, как правило, не рассматривается как терапия первой линии. На основе рандомизированного исследования, сравнивавшего применение иматиниба и ИФН-α (IRIS), селективный ингибитор тирозинкиназы ABL иматиниб в дозе 400 мг в
сутки был рекомендован в качестве стандарта терапии хронической фазы ХМЛ. Результаты этого исследования через 5 лет наблюдения подтвердили высокие уровни достигнутой гематологической ремиссии (98%), большого цитогенетического ответа (92%), полного цитогенетического ответа (87%) и выживаемости без прогрессии (84%). Уровень прогрессии заболевания в течение года составил 4% (включая потерю гематологической ремиссии и большого цитогенетического ответа), уровень развития фаз акселерации и бластного криза составил 2%. Два ретроспективных исследования иматиниба и интерферона также представили данные по приоритету выживаемости больных, получающих иматиниб. Базируясь на последних исследованиях по иматинибу, группа международных экспертов предложила алгоритм определения резистентности к иматинибу или его непереносимости
Альтернативные подходы при резистентности к иматинибу следующие:
• Аллогенная ТГСК
• ИФН-α в сочетании с гидроксимочевиной или малыми дозами цитозара
• Новые препараты: дазатиниб или нилотиниб
Принятие решений во всех случаях должно быть тщательно взвешенным и коллегиальным.
Наблюдение. Во время лечения иматинибом пациент должен наблюдаться еженедельно в течение первого периода лечения (с контролем общего анализа крови), далее – один раз в 1-2 месяца. Цитогенетическое исследование костного мозга должно производиться каждые 3 месяца, пока не достигнут ПЦО, далее – один раз в год. Пациентам с ПЦО должно проводиться исследование клеток периферической крови с помощью количественной ПЦР на транскрипт BCR-ABL раз в три месяца. Целью лечения должно быть достижение полного молекулярного ответа (ПМО), соответствующее определению относительного уровня BCR-ABL менее 0,1% по международной шкале. Пациенты, достигнувшие ПМО, рецидивируют редко. Мутационный анализ BCR-ABL должен выполняться в случаях развития резистентности, субоптимального ответа¸ или возрастания уровня транскрипта.
ГКС
7. лечение инфекционных осложнений (Посиндромная терапия)
Клиника. Начальный период
1. увеличение лимфатических узлов,
2. Лейкоцитоз
3. лимфоцитоз;
Основными критериями начального периода хронического лимфолейкоза являются:
• незначительное или умеренное увеличение нескольких лимфатических узлов одной или двух групп;
• лейкоцитоз, не превышающий 50 х 109/л;
• отсутствие тенденции к значительному увеличению лейкоцитоз
• удовлетворительное состояние больного, отсутствие нарушения функции других органов и систем (состояние компенсации).
Период выраженных клинических проявлений
• Синдром интоксикации;
• Прогрессирующая лимфоаденопатия (как проявление гиперпластического синдрома)
• Параллельное увеличение печени и селезенки;
• Инфильтрация всех отделов и органов ЖКТ;
• Инфильтрация легких;
• Инфильтрация всех отделов нервной системы;
• Инфильтрация проводящей системы сердца;
• Полиорганная недостаточность.
Клиника (объективно) ХЛЛ
• Спленомеглаия и гиперспленизм → анемия и тромбоцитопения;
• Инфильтрация всех органов и систем с развитием снижения их функций
- ЖКТ (язвы, диспепсия, мальабсорбция,
- инфильтрация легких (пневмонии, ДН по рестриктивному типу, очень частые воспалительные процесс на любом уровни;
•Гепатомегалия (синдрома портальной гипертензии и холестатической желтухи)
Период выраженных клинических проявлений
В общем анализе крови:
• количество лейкоцитов от 50х109/л до 100 х 109/л и даже 200х109/л;
• резкое увеличение количества лимфоцитов до 100 х 109/л или до 80-90% в лейкоцитарной формуле;
• клетки Боткина-Гумпрехта—- полуразрушенные ядра лимфоцитов;
• нормохромная нормоцитарная анемия
• тромбоцитопения;
• увеличение СОЭ;
Показатели лейкоцитарной формулы
| Лейкоциты | юные ( 0% ) | эоз (1-5) | баз (0-1) | п/я (1-6) | с/я (47-72) | л/ф (19-37) | мон (2-8) |
| 88,2 | 2 | 16 | 81 | 1 |
Примерно у 50% больных ХЛЛ обнаруживается нормохромная нормоцитарная анемия.
Этиология:
• лейкозная инфильтрация костного мозга (обычно развивается через 3-7 лет от начала заболевания);
• появление антител класса IgG к эритроцитам (аутоиммунная гемолитическая анемия). Гемолитическая анемия сопровождается неконъюгированной гипербилирубинемией и ретикулоцитозом;
• повышенное разрушение эритроцитов в селезенке;
Аутоиммунные осложнения
• Иммунная тромбоцитопения;
• Иммунная нейтропения;
• Паранеопластическая пузырчатка;
Терминальная стадия
• резким прогрессирующим ухудшением общего состояния;
• истощение;
• выраженная интоксикация;
• постоянная лихорадка;
• тяжелый инфекционно-воспалительные процессы с локализацией в различных органах и системах. (тяжелая генерализованная инфекция, пневмококковая, стафилококковая, стрептококковая пневмония, герпетическая инфекция и др).
• тяжелая почечная недостаточность;
• выраженная анемия;
Классификация нарушений ритма сердца. Особенности клинических проявлений. Принципы диагностики нарушений ритма сердца.
234-240 стр. методички
Аритмии сердца – это любой сердечный ритм, не являющийся регулярным синусовым ритмом нормальной частоты (60-90 уд/мин), а также нарушение проводимости электрического импульса по разным отделам проводящей системы сердца.
| Нарушения образования импульса | Нарушения проводимости | Комбинированные аритмии |
I. Патология САУ
 Синусовая тахикардия Синусовая тахикардия
 Синусовая брадикардия Синусовая брадикардия
 Синусовая аритмия Синусовая аритмия
 Миграция источника ритма
II. Эктопические ритмы Миграция источника ритма
II. Эктопические ритмы
 Экстрасистолия Экстрасистолия
 Пароксизмальная тахикардия Пароксизмальная тахикардия
 Трепетание предсердий Трепетание предсердий
 Мерцание предсердий Мерцание предсердий
 Трепетание и мерцание желудочков Трепетание и мерцание желудочков
|  Синоатриальная блокада Синоатриальная блокада
 Предсердная блокада Предсердная блокада
 Атриовентрикулярная блокада Атриовентрикулярная блокада
 Внутрижелудочковая блокада (ножек или ветвей пучка Гиса) Внутрижелудочковая блокада (ножек или ветвей пучка Гиса)
|  Синдром слабости синусового узла (синдром Шорта) Синдром слабости синусового узла (синдром Шорта)
 Синдром предвозбуждения желудочков (WPW, CLC). Синдром предвозбуждения желудочков (WPW, CLC).
 Синдром замедленной реполяризации желудочков Синдром замедленной реполяризации желудочков
 Парасистолии Парасистолии
 Ускальзывающие (выскальзывающие) сокращения и ритмы Ускальзывающие (выскальзывающие) сокращения и ритмы
|
КЛАССИФИКАЦИЯ НАРУШЕНИЙ РИТМА СЕРДЦА
(по Katz L.,Pick A.,1953 в модификации Дощицина В.Л.)
Дата: 2019-07-24, просмотров: 593.