
Т. гондий может передаваться через плаценту к плоду, вызывая врожденный токсоплазмоз и связанный с ним энцефалит (ЦНС инфекция)
(Martin, 2001). В зависимости от гестационного возраста инфекции, клинической болезни колеблется через аборт, гидроцефалия, внутричерепной кальцификации и аномалии сетчатки. Даже при отсутствии симптомов при рождении, аномалии сетчатки и центральной нервной системы могут subse-тельно развиваться, с риском долгосрочных последствий. CD8+ Т-клетки и IFN- &γ от матери являются Протек-онно против врожденного токсоплазмоза, а матер-NAL CD4+Т-клетки и антитела, с другой стороны, не оказывает никакого влияния на передачу для плода (Abou-Bacar и др., 2004). Некоторые в пробирке исследования исследовали иммунные эффекторные механизмы, участвующие в врожденного токсоплазмоза. Т. гондий вторгается в эндотелиальных клетках пупочной вены, а затем распространяются по всему плоду. У овец, обработка клеток пупочной вены с IFN-γблокирует рост T.gondii, с помощью механизма NO- и ROI-Inde-подвешенного (Dimier и Бута, 1996). В эндотелиальных клетках человека, IFN-γиндуцирует ингибирование Т. гондий через NO-, ROI- и IDO-независимый механизм (Дровосек и др., 1991). Таким образом, аналогично хронической инфекции в ЦНС и глазной токсоплазмоз, IFN-γиндуцированная ингибирование Т. гондий в эндотелиальных клетках пупочной, вероятно, важную роль в предотвращении трансплацентарной передачи врожденного токсоплазмоза.
ВЫВОДЫ

IFN-γопосредованный иммунный ответ играет центральную роль в сопротивлении против Т. гондий в головном мозге. IFN-γПроизводство нескольких типов клеток, в том числе Т-клетки, необходимо для сопротивления. Микроглии являются один тип IFN-γ-продуцирующих клетки, которые, вероятно, играют важную роль в борьбе с паразитом. IL-12, Bcl-3, NF-κВ (2), с-Rel и CD40-CD40L взаимодействие лиганда имеют важное значение для повышающей регуляции и от IFN- ОБСЛУЖИВАНИЕγПроизводство Т-клетки для профилактики ТЕ (табл 21.1). С другой стороны, IL-10 и Lipoxin A4, кажется, играют решающую роль в понижающей регуляции ИФНγопосредованная реакция, препятствующие Devel-витие иммунного ответа, опосредованная патология.
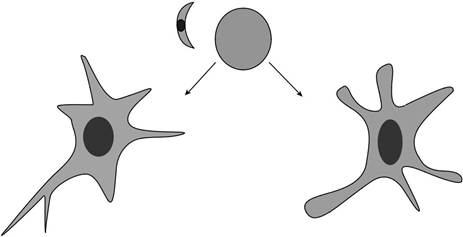
IFN-γактивизирует микроглии и астроцитов, чтобы ингибировать внутриклеточный репликацию тахизоитов (рис 21.1). На сегодняшний день три механизма были идентифицированы

| ВЫВОДЫ | 585 | ||
| макрофаг | Т-клетки |
Астроциты или
Тохо
IFN-γ IFN-γ
ФНО-α
ФНО-α
| NO-зависимый | НЕТ-независимый | |
| (Мышь) | ||
| (Мышь) | ||
Рисунок 21.1 Контроль токсоплазма в головном мозге требует два популяций эффекторов.
Таблица 21,1 IFN-γопосредованное сопротивление Т. гондий в головном мозге

| молекула | функция | ячейки | Рекомендации |
| IL-12 | Поддержание IFN-γ Производство Т-клетки | дендритные клетки | Фишер и др., 2000; Яп и др., 2000 |
| Bcl-3 | Поддержание IFN-γ Производство Т-клетки | Т-клетки | Franzoso и др., 1997 |
| NF-κБИ 2) | Поддержание IFN-γ Производство Т-клетки | Т-клетки | Caamaño и др., 2000 |
| с-Rel | повышающая регуляция IFN-γ Производство Т-клетки | Т-клетки, дендритные | Мейсон и др., 2004 |
| ячейки | |||
| CD40L | повышающая регуляция IFN-γ производство по | Т-клетки | Subauste и др., 1999; Райхман |
| Т-клетки (в человеке, но не в мыши) | и другие., 2000 | ||
| IFN-γ | Активация эффекторных клеток для контроля | γδ Т-клетки (?) | Сузуки и др., 1997; Лейва и др., |
| Т. гондий | 1998; Лепаж и др., 1998 | ||
| микроглии и | Сузуки и др., 2005 | ||
| макрофаги | |||
| αβ Т-клетки | Сузуки и др 1989a. Браун и | ||
| Маклеода, 1990; Gazzinelli и др., | |||
| 1992; Кан и Сузуки, 2001; | |||
| Wang и др., 2004, 2005 | |||
| иОАС | Производство NO для управления T.gondii, | Микроглия | Чао и др, 1993a. Фрейнд и др., |
| в эффекторных клеток | (Мышь) | 2001 | |
| астроциты | Петерсон и др., 1995 | ||
| (человек) | |||
| Я ДЕЛАЮ | Триптофан деградация для контроля | астроциты | Daubener и др., 1993 |
| Т. гондий в эффекторных клеток | (человек) | ||
| кровоснабжения головного мозга | Daubener и др., 2001 | ||
| (эндотелиальный | |||
| клетки человека) | |||
| IGTP | Неопознанный механизм контроля | астроциты | Халонен и др, 1998, 2001. |
| Т. гондий в эффекторных клеток | (Мышь) | Халонен и Weiss, 2000 | |

586 Церебральный токсоплазмоз: ПАТОГЕНЕЗ И HOST СОПРОТИВЛЕНИЕ
Контроль Т. гондий в IFN-γ-активированные эффекторные клетки в головном мозге: НЕТ производство на иСОА, триптофан деградации по Идо, и неизвестные механизмы, опосредованных IGTP. Кроме того, астроциты и микроглии играют важную регуляторную роль в IFN-γопосредованного иммунного ответа по производству цитокинов, таких как TNF-α, ИЛ-1, ИЛ-6 и ИЛ-10, и хемокины. Нейроны-видимому, участвуют в этих взаимодействиях. Важно, чтобы выяснить подробные механизмы взаимодействия между Т-клеток, глиальных клеток и нейронов, и молекулярной основы их защитных функций, для того, чтобы получить лучшее представление о immunopathogene-лиза церебрального токсоплазмоза.
БЛАГОДАРНОСТЬ

Мы благодарим Рене Миллер и Брэдли Данфорда за помощь в подготовке рукописи. Эта работа проводится при поддержке службы общественного здравоохранения гранта AI 047730 (YS).
РЕКОМЕНДАЦИИ

Abou-Bacar, А., Pfaff, AW, Letscher-Брю, В. и др. (2004). Роль гамма-интерферона и Т-клеток при врожденной передачи Toxoplasma. Паразит Immunol. 26, 315-318.
Адамс, Л. Б., Хиббс, JB-младший, Тейнтор, РР и Кренбюля, JL (1990). Бактериостатический эффект мышиных активированных макрофагов для токсоплазма. Роль для СЕНТ-лиза неорганических оксидов азота из L-аргинина. J. Immunol. 144, 2725-2729.
Адамс, Л. Б., Fukutomi, Ю. и Кренбюля, JL (1993). Регулирование мышиных макрофагов функций эффекторных по lipoarabinomannan из штаммов микобактерий с различной степенью вирулентности. Infect. Имун. 61, 4173-4181.
Айзенберг Д., Конья, Н., Париж, Л. и др. (2002). Генотип 86 токсоплазма изоляты, связанные с врожденным токсоплазмозом человека, и корреляции с клиническими данными. J. Infect. Дис. 186, 684-689.
Akira, S., Taga, Т. и Kishimoto, Т. (1993). Интерлейкина-6 в биологии и медицине. Adv. Immunol. 54, 1-78.
Александр, J., Jebbari H., Bluethmann, H., Brombacher, Ф. и Робертс, CW (1998). Роль IL-4 у взрослых приобретенного и врожденного токсоплазмоза. Int J. Parasitol. 28, 113-120.
Aliberti J., Reis е Соуза, С., Schito, M. и др. (2000). CCR5, обеспечивает сигнал для микробной индуцированной продукции IL-12 CD8 альфа+дендритные клетки. Природа Immunol. 1, 83-87.
Aliberti, J., Serhan, С. и Sher, A. (2002). Паразит-индуцированной lipoxin А4 является эндогенным регулятором IL-12 производства и иммунопатологии в токсоплазма инфекции. J. Exp. Med. 196, 1253-1262.
Aliberti J., Валенсуэла, JG, Каррузерс, В. Б. и др. (2003). Молекулярная мимикрия в CCR5-связывающий домен в микробной активации дендритных клеток. Природа Immunol. 4, 485-490.
Алин, Ф. Бут, Д. и Dimier-Пуассона, И. (2002). Дендритные клетки в качестве эффекторных клеток: гамма-интерферон активация мышиных дендритных клеток вызывает кислородное-зависимое ингибирование репликации токсоплазма. Infect. Имун. 70, 2368-2374.
Araujo, FG и Slifer, Т. (2003). Различные штаммы токсоплазма вызывают различные реакции цитокинов у мышей линии CBA / Ca. Infect. Имун. 71, 4171-4174.
Биман, MH, Вонг, С. Ю., Абрамс, JS и Ремингтон, JS (1993). Селезеночной секрецию ИЛ-4 не связан с развитием токсоплазматического энцефалита {81} абстрактным. Программа и тезисы 2-го Международного конгресса модификаторов биологического ответа, Сан-Диего.
Bliss, SK, Butcher, BA и Denkers, EY (2000). Быстрое набора нейтрофилов, содержащие предварительно сохранено IL-12 в ходе микробной инфекции. J. Immunol. 165, 4515-4521.
Bliss, СК, Гаврилеск, ЛК, Алькарас, А. и Denkers, Е.Ю. (2001). Нейтрофильная истощение во токсоплазме инфекции приводит к нарушению иммунитета и летальной системной патологии. Infect. Имун. 69, 4898-4905.
Bohne, В., Heesemann, Дж и Гросс, У. (1994). Снижение репликация токсоплазма необходима для индукции брадизоитных специфических антигенов: возможная роль оксида азота в инициировании конверсии стадии. Infect. Имун. 62, 1761-1767.
Бут Д., Moretto, М., Dimier-Пуассона, И. и Gatel, Д. Б. (1999). Взаимодействие между токсоплазмом и энтероцитами. Иммунобиологии 201, 225-228.
Браун, CR и Маклеод, Р. (1990). гены МНС класса I и CD8+Т-клетки определяют количество кист в токсоплазме инфекции. J. Immunol. 145, 3438-3441.
Браун, CR, Дэвид, CS, Кхаре, SJ и Маклеод, R. (1994). Влияние человеческого класса I трансгенов на формирование гондий цист токсоплазм. J. Immunol. 152, 4537-4541.
Браун, CR, Хантер, Калифорния, Эстес, Р. и др. (1995). Окончательное определение гена, который придает резист-ANCE против Toxoplasma кист бремени и encephali-тиса. Immunology 85, 419-428.
Мясник, Б. А., Грин, Род-Айленд, Генри, SC и соавт. (2005). P47 GTPases регулируют токсоплазма выживание в Acti-vated макрофагов. Infect. Имун. 73, 3278-3286.
Caamaño J., Тато, К., Кай, G. и др. (2000). Идентификация роли NF-каппа В2 в регуляции apopto-лизе и в поддержании Т-клеточный иммунитет к токсоплазму. J. Immunol. 165, 5720-5728.
Чакрун, М., Meyohas, МС, Pelosse, B. и др. (1990). Глазной токсоплазмоз СПИД. Энн. Med. Interne (Париж) 141, 472-474.
Чанг, HR и Pechere, JC (1989). Макрофаги oxida-онно метаболизма и внутриклеточного токсоплазма. Микроб. Pathog. 7, 37-44.
Дата: 2019-05-28, просмотров: 309.