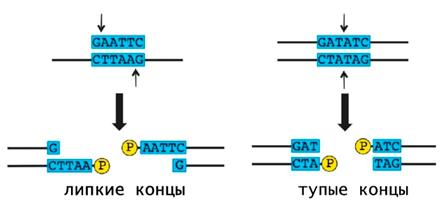
После связывания с последовательностью распознавания эндонуклеаза рестрикции поочередно расщепляются цепи ДНК. При этом могут образовываться два варианта концов: Липкие — одноцепочечные комплементарные друг другу последовательности, которые легко могут "сшиться" обратно. Формируются при ступенчатой траектории разрезания, когда точки расщепления двух цепей не совпадают; Тупые — одноцепочечные участки в месте разрыва ДНК не образуются, точки разрезания цепей находятся напротив друг друга.
Для осуществления эндонуклеазной активности рестриктазам требуется кофактор в виде Mg2+. Расположившись на месте разрыва этот ион вмешивается в конфигурацию ДНК, что способствует последующему расщеплению.
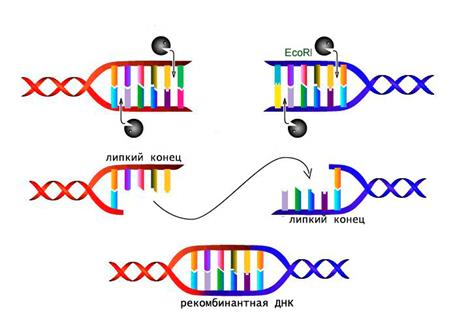
Применение рестриктаз Рестриктазы являются одним из главных молекулярных инструментов, используемых в технологии рекомбинантных ДНК. Благодаря этим ферментам стало возможным вырезать из геномов различных организмов определенные фрагменты или гены, а затем сшивать их с помощью лигаз . Особенно удобно использование в генной инженерии рестриктаз, образующих одинаковые липкие концы. Такие фрагменты ДНК легко соединяются по принципу комплементарности .
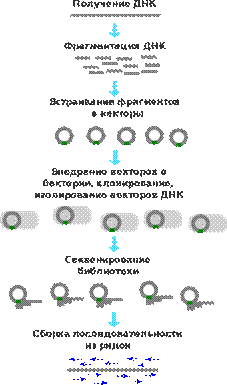
Используя микроорганизмы, можно создавать два типа библиотек ДНК: геномную и клоновую (кДНК). Геномная библиотека. Если геном какого-либо организма разрезать, вставить в плазмидные или вирусные вектора и ввести в клетку, то в таком виде его можно сохранить. При разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизмененных кусков генома высока. Такой способ называется «метод дробовика», т.к. геном в данном случае представлен отдельными фрагментами. Метод дробовика (англ. Shotgun sequencing) — метод, используемый для секвенирования длинных участков ДНК. Суть метода состоит в получении случайной массированной выборки клонированных фрагментов ДНК данного организма, на основе которых может быть восстановлена исходная последовательность ДНК.
Из вирусных ДНК лучше использовать ДНК фагов, т.к. они имеют большую емкость и позволяют вставлять более крупные куски генома. Очищенные кольцевые молекулы ДНК обрабатывают рестриктазой, получая линейную ДНК. Клеточную ДНК обрабатывают той же рестриктазой, добавляют к плазмидной, добавляют лигазы. Т.о., получают рекомбинантную плазмидную ДНК, которую вводят в бактериальные или дрожжевые клетки. Плазмида реплицируется с образованием многих копий. Многие плазмиды несут ген устойчивости к антибиотикам, и если в рекомбинантной плазмиде есть такой ген, то клетки легко выявлять, выращивая на среде с антибиотиком. Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид можно назвать библиотекой геномной ДНК. Недостаток такого метода в том, что фрагменты ДНК образуются в огромном кол-ве. Разрезание геномной ДНК опред-ся случаем, поэтому лишь часть фрагментов содержат полноценные гены. Некоторые фрагменты могут содержать только часть гена или же интронные последовательности. Создание кДНК начинается с синтеза на матрице РНК с помощью обратной транскриптазы комплементарной нити ДНК. Затем создают щелочные условия, разрушают цепь РНК на нуклеотиды, потом с помощью ДНК-полимеразы синтезируют комплементарную цепь ДНК. При этом образуется фрагмент ДНК с тупыми концами. Такую ДНК встраивают в плазмиды и вводят в клетки бактерий. При амплификации плазмиды образуется клон комплементарной копии ДНК (кДНК). Преимущества клоновой ДНК перед клонами геномной ДНК в том, что кодирующая белок нуклеотидная послед-ть гена ничем не прерывается. Гены эукариот содержат интроны, которые должны удаляться из транскриптной РНК перед превращением ее в матричную, после чего следует сплайсинг (сращивание). Бактериальные клетки не могут осуществлять такую модификацию РНК, образовавшуюся путем транскрипции гена эукариотической клетки. Поэтому если преследуют получение белка путем экспрессии клонированного гена, то лучше использовать банк кДНК, полученной на основе матричной РНК.
17 Опишите молекулярные механизмы и ферменты CRISPR-Cas как систему защиты бактерии от чужеродных ДНК (фагов, плазмид). Применение системы CRISPR-Cas9 в технологии редактирования геномов.
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассетыи прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
Гены cas кодируют белки, берущие на себя всю тяжесть работы по встраиванию спейсеров и уничтожению агентов с идентичными последовательностями (протоспейсерами) и помогающие процессировать CRISPR-транскрипт: разделять фото-гирлянду на отдельные портреты. Функцию уничтожения выполняют Cas-белки, называемые эффекторными. В зависимости от типа эффекторов все CRISPR-системы разделяют на два класса: у I класса мишень уничтожается мультибелковым комплексом, а у II — одним крупным белком. Далее эти классы подразделяются на шесть типов. Большинство эффекторов атакует ДНК, лишь один — исключительно РНК [10], редкие — обе молекулы. Один организм может содержать несколько разных систем, а спейсеры различаются в разных клетках даже одной популяции.
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
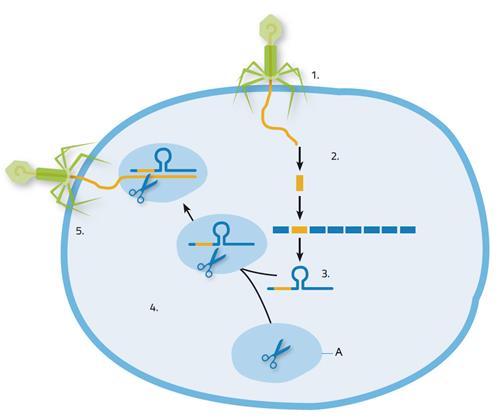
Вирус вторгается в бактериальную клетку; 2. Нуклеиновые кислоты вируса записываются в CRISPR участке; 3. Формирование CRISPR РНК; 4. CRISPR РНК прикрепляется к ферменту Cas9; 5. CRISPR РНК направляет фермент Cas9 к вирусу. Он разрезает и уничтожает вирусный геном.
Редактирование. Чтобы исправить «неправильный» ген, нам нужен очень точный молекулярный «скальпель», который найдет мутантную последовательность нуклеотидов и сможет «вырезать» ее из ДНК. Таким «скальпелем» и является Cas9. С помощью гида РНК, последовательность которой совпадает с искомым местом, он может внести разрыв в нужное место генома. Узнавание мишени происходит на участке длиной в 20–30 нуклеотидов. В среднем последовательности такой длины встречаются в геноме человека единожды, что позволяет обеспечить точность. Клетка не умрет от внесения разрыва в ДНК, так как он будет исправлен по здоровой копии из парной хромосомы за счет естественного процесса репарации ДНК. Если парной хромосомы нет, как в случае гемофилии, можно внести в клетку участок «правильного» гена одновременно с Cas9 и РНК-гидом и использовать его как матрицу для залечивания внесенного разрыва.
С помощью CRISPR/Cas9 можно делать мультиплексное редактирование сразу нескольких неправильных генов. Для этого достаточно ввести белок Cas9 и несколько разных РНК-гидов. Каждый из них направит Cas9 к собственной мишени, и вместе они устранят генетическую проблему.
В целом описанный механизм функционирует за счет принципа комплементарности, который впервые был предложен Джимом Уотсоном и Френсисом Криком в их знаменитой модели двуцепочечной ДНК. Цепочки двойной спирали ДНК «узнают» друг друга по правилам комплементарности. CRISPR РНК узнает свои мишени в двуцепочечной ДНК таким же образом, при этом образуется необычная структура, содержащая двуцепочечный участок взаимокомплементарных РНК и одной из цепей ДНК-мишени, а другая цепь ДНК оказывается «вытесненной».
Дата: 2019-05-28, просмотров: 451.