Наибольшее применение в генно-инженерных исследованиях находит ДНК-лигаза бактериофага Т4 . Реакция лигирования протекает в два этапа ( рис. II.3 ).
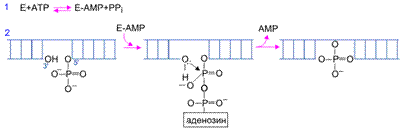
Вначале образуется промежуточный комплекс фермент-АМР (этап 1), после чего остаток АМР переносится на 5'-фосфатную группу концевого нуклеотида в точке разрыва ДНК (этап 2). Образовавшаяся фосфодиэфирная связь гидролизуется во время нуклеофильной атаки 3'-ОН группы соседнего нуклеотида, что приводит к образованию новой фосфодиэфирной связи, восстанавливающей целостность сахаро-фосфатного остова ДНК. Т4- ДНК-лигаза осуществляет соединение фрагментов двухцепочечной ДНК, обладающих комплементарными "липкими" или "тупыми" концами. Необходимым условием протекания лигирования является наличие 5'- концевого фосфата и 3'-концевого гидроксила в точках разрыва цепей ДНК. При этом эффективность соединения фрагментов ДНК по "тупым" концам Т4-ДНК-лигазой возрастает в присутствии Т4-РНК- лигазы, которая осуществляет ковалентное соединение 5'- фосфорилированных концов одноцепочечных ДНК или РНК с 3'-ОН группами одноцепочечных нуклеиновых кислот.
ДНК-полимераза — фермент, участвующий в репликации ДНК. Выделяют ДНК-зависимую ДНК-полимеразу, использующую в качестве матрицы одну из цепей ДНК, и РНК-зависимую ДНК-полимеразу (другое название обратная транскриптаза), способную также к считыванию информации с РНК (обратная транскрипция).
Как известно, две цепи молекулы ДНК антипараллельны. Разные концы одной цепи называются 3’-конец и 5’-конец. Репликация происходит путём непрерывного роста нуклеотида за нуклеотидом обеих новых цепей одновременно. Матрица считывается ДНК-полимеразой только в направлении 5’-3’, добавляя свободные нуклеотиды к 3’-концу собираемой цепочки. Поэтому синтез ДНК происходит непрерывно только на одной из матричных цепей, называемой «лидирующей». Во второй цепи («отстающей») синтез происходит короткими фрагментами.
Ни одна из известных ДНК-полимераз не может создать цепочку «с нуля»: они в состоянии лишь добавлять нуклеотиды к уже существующей 3’-гидроксильной группе. По этой причине ДНК-полимераза нуждается в праймере, к которому она могла бы добавить первый нуклеотид. Праймеры состоят из оснований РНК и ДНК, при этом первые два основания всегда РНК-основания. Праймеры синтезируются другим ферментом — праймазой. Ещё один фермент — хеликаза — необходим для раскручивания двойной спирали ДНК с формированием одноцепочечной структуры, которая обеспечивает репликацию обеих цепочек в соответствии с полуконсервативной моделью репликации ДНК.
Некоторые ДНК-полимеразы обладают также способностью исправлять ошибки во вновь собираемой цепочке ДНК. Если происходит обнаружение неправильной пары нуклеотидов, ДНК-полимераза откатывается на один шаг назад. Благодаря своей 3'-5'-экзонуклеазной гидролитической активности ДНК-полимераза может исключить неправильный нуклеотид из цепочки и затем вставить на его место правильный, после чего репликация продолжается в нормальном режиме.
Полинуклеотидкиназа (polynucleotide kinase): фермент , катализирующий присоединение фосфатной группы к концевым звеньям олигонуклеотидов и полинуклеотидов. Полинуклеотидкиназы осуществляют перенос гамма-фосфатных групп ATP на 5'-OH группы ДНК или РНК. Полинуклеотидкиназа бактериофага Т4 используется для введения радиоактивной метки в ДНК или РНК для получения радиоактивно меченных зондов или секвенирования нуклеиновых кислот.
Терминальная трансфераза из тимуса теленка (терминальная дезоксирибонуклеотидилтрансфераза), осуществляющая последовательное присоединение дезоксирибонуклеозидмонофосфатов из пула дезоксирибонуклеозидтрифосфатов к 3'-OH-группам молекул ДНК, используется для введения радиоактивной метки в составе меченых нуклеотидов в 3'-концы ДНК, а также присоединения к 3'- концам фрагментов ДНК (особенно кДНК) протяженных гомополимерных последовательностей нуклеотидов (коннекторов ) для последующего их клонирования.
Щелочные фосфатазы бактерий (BAP) и кишечника теленка (CIAP) катализируют удаление 5'-фосфатных групп ДНК или РНК, а также расщепление макроэргических связей рибо- и дезоксирибонуклеозидтрифосфатов. Их используют при подготовке фрагментов нуклеиновых кислот к введению 5'-концевой радиоактивной метки 32Р и для предотвращения лигирования векторных молекул ДНК самих на себя. ДНК-лигаза способна образовывать фосфодиэфирные связи в одноцепочечных разрывах лишь при наличии в них 5'-концевого фосфата. Удаление 5'-концевых фосфатных групп молекул вектора, лианеризованных с помощью одной рестриктазы во время его подготовки для клонирования соответствующего фрагмента ДНК, предотвращает образование кольцевых молекул вектора (без вставки), а также его олигомеров во время лигирования с клонируемой последовательностью. Необходимые для лигирования со вставкой фосфатные группы содержатся в самих клонируемых фрагментах ДНК, а остающиеся в результате неполного лигирования два одноцепочечных разрыва репарируются in vivo после введения вектора со вставкой в бактериальные клетки.
Нуклеазы (nucleases) - это гидролитические ферменты, расщепляющие нуклеиновые кислоты (ДНК и РНК). По механизму расщепления субстратов нуклеазы могут быть экзонуклеазами и эндонуклеазами. Экзонуклеазы осуществляют последовательное отщепление мононуклеотидов или небольших олигонуклеотидов с концов молекул ДНК или РНК, тогда как эндонуклеазы вносят в молекулы нуклеиновых кислот внутренние разрывы. Они могут быть рибонуклеазами и деоксирибонуклеазами, могут расщеплять либо одноцепочечные нуклеиновые кислоты, либо преимущественно двухцепочечные. Некоторые нуклеазы обладают более широкой специфичностью и могут гидролизовать как РНК, так и ДНК, а также одновременно проявлять эндо- и экзонуклеазную активности.
Дата: 2019-05-28, просмотров: 460.