Под эпигенетической регуляцией понимают механизмы изменения экспрессии генов, не затрагивающие последовательность нуклеотидов в ДНК. Эпигенетическая регуляция генов осуществляется на уровне траскрипции (время и характер транскрипции гена), при отборе зрелых мРНК для транспорта их в цитоплазму, при селекции мРНК в цитоплазме для трансляции на рибосомах, дестабилизации определенных типов мРНК в цитоплазме, избирательной активации, инактивации молекул белков после их синтеза. Совокупность эпигенетических маркеров представляет собой эпигеном. Эпигенетические преобразования могут влиять на фенотип. Эпигенетика играет важную роль в функционировании здоровых клеток, обеспечивая активацию и репрессию генов, в контроле транспозонов, т. е. участков ДНК, способных перемещаться внутри генома, а также в обмене генетического материала в хромосомах. Модификациям подвергаются различные части структуры генома. К концевым остаткам могут присоединяться метильные, ацетильные, фосфатные группы и более крупные белковые молекулы. Все модификации являются обратимыми и для каждой существуют ферменты, которые ее устанавливают или удаляют.
Метилирование ДНК
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома. Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца. Метилирование ДНК происходит путем обратимой химической реакции азотистого основания — цитозина, в результате чего метильная группа СН3 присоединяется к углероду с образованием метилцитозина. Этот процесс катализируется ферментами ДНК-метилтрансферазами. Для метилирования цитозина необходим гуанин, в результате образуется два нуклеотида, разделенные фосфатом (СрG). Скопление неактивных последовательностей СрG называется островками СрG. Последние представлены в геноме неравномерно . Большинство из них выявляются в промоторах генов. Метилирование ДНК происходит в промоторах генов, в транскрибируемых участках, а также в межгенных пространствах.
Гиперметилированные островки вызывают инактивацию гена, что нарушает взаимодействие регуляторных белков с промоторами. Метилирование ДНК оказывает огромное влияние на экспрессию генов и, в конечном счете, на функцию клеток, тканей и организма в целом. Установлена прямая зависимость между высоким уровнем метилирования ДНК и количеством репрессированных генов.
Ацетилирование гистонов
Существует большое число посттрансляционных модификаций гистонов, которые формируют хроматин. В 1960-е годы Винсент Олфри идентифицировал ацетилирование и фосфорилирование гистонов из многих эукариот. Ферменты ацетилирования и деацетилирования (ацетилтрансферазы) гистонов играют роль в ходе транскрипции. Эти ферменты катализируют ацетилирование локальных гистонов. Деацетилазы гистонов репрессируют транскрипцию. Эффект ацетилирования это ослабление связи между ДНК и гистонами из-за изменения заряда, в результате чего хроматин становится доступным для факторов транскрипции. Ацетилирование представляет собой присоединение химической ацетил-группы (аминокислоты лизин) на свободный участок гистона. Как и метилирование ДНК, ацетилирование лизина представляет собой эпигенетический механизм для изменения экспрессии генов, не влияющих на исходную последовательность генов. Шаблон, по которому происходят модификации ядерных белков, стали называть гистоновым кодом. Модификации гистонов играют фундаментальную роль в нормальных процессах и при заболеваниях.

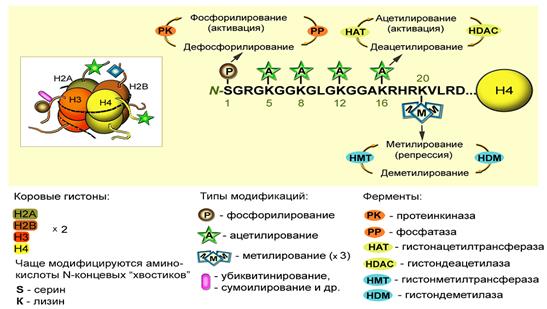
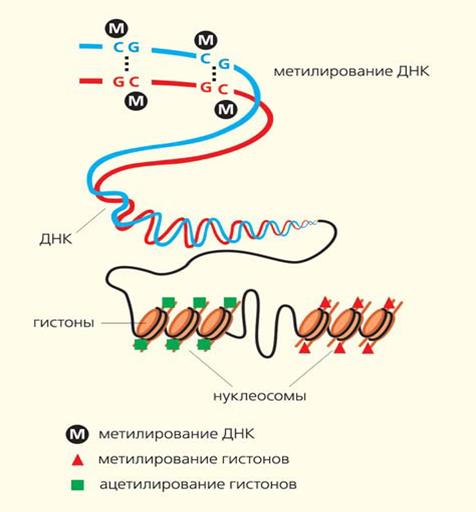
Механизм ремоделирования хроматина
Дата: 2019-05-28, просмотров: 482.