Затвердевание металлов и сплавов происходит в неравновесных условиях. В результате возникает неравномерное распределение легирующих элементов и сопутствующих примесей в пределах отдельных кристаллитов – микроскопическая химическая неоднородность.
 |
Характерные особенности химической неоднород-ности зависят от физико-химических процессов, протекающих в окрестности и непосредственно на движущейся межфазной границе твердая фаза – жидкий металл или сплав [7]. Существуют три взаимосвязанных условия, определяющие химическую неоднородность:
Термодинамические свойства металлической системы, в частности ее диаграмма состояния;
Кинетические процессы тепло- и массообмена в окрестности межфазной поверхности и в прилегающих фазах; Форма и кристаллографические особенности межфазной поверхности.
Наиболее полно поддается анализу перераспределение растворимых примесей при движении макроскопически гладкой поверхности в некоторых идеализированных условиях, которые могут выполняться при направленной кристаллизации. Направленную кристаллизацию можно осуществить, если расплав охлаждать с одной стороны (рис. 6.4). В зависимости от конкретных условий затвердевания будет изменяться распределение примесей между твердой и жидкой фазами в процессе кристаллизации и окончательное распределение примесей по длине образца после полного затвердевания.
 Одним из предельных случаев затвердевания является равновесный процесс. Концентрация твердой и жидкой фаз в каждый момент устанавливается в соответствии с требованием равенства химических потенциалов примеси в этих фазах и характеризуется равновесным коэффициентом распределения w 0, равным отношению концентраций примеси в твердой и жидкой фазах СТВ/СЖ . Обычно равновесный коэффициент распределения определяется из диаграммы состояния. Если линии ликвидус и солидус наклонены книзу, в этом случае примесь понижает точку плавления растворителя и w 0 < 1. Если примесь повышает точку плавления растворителя, w 0 > 1. Как правило, w 0 зависит от концентрации, за исключением очень разбавленных растворов. При равновесном затвердевании имеется достаточное время для диффузионных процессов выравнивания концентрации в жидкой и твердой фазах. Поэтому после завершения направленной кристаллизации наблюдается равномерное распределение примеси. Равновесное затвердевание реализуется на практике очень редко.
Одним из предельных случаев затвердевания является равновесный процесс. Концентрация твердой и жидкой фаз в каждый момент устанавливается в соответствии с требованием равенства химических потенциалов примеси в этих фазах и характеризуется равновесным коэффициентом распределения w 0, равным отношению концентраций примеси в твердой и жидкой фазах СТВ/СЖ . Обычно равновесный коэффициент распределения определяется из диаграммы состояния. Если линии ликвидус и солидус наклонены книзу, в этом случае примесь понижает точку плавления растворителя и w 0 < 1. Если примесь повышает точку плавления растворителя, w 0 > 1. Как правило, w 0 зависит от концентрации, за исключением очень разбавленных растворов. При равновесном затвердевании имеется достаточное время для диффузионных процессов выравнивания концентрации в жидкой и твердой фазах. Поэтому после завершения направленной кристаллизации наблюдается равномерное распределение примеси. Равновесное затвердевание реализуется на практике очень редко.
Для многих реальных условий кристаллизации, ввиду отсутствия равновесия между объемами твердой и жидкой фаз, необходимо рассматривать эффективные значения w, которые для примесей, понижающих точку плавления, будут возрастать, принимая значения w 0 < w £ 1. При этом обычно считают, что непосредственно на межфазной поверхности достигается равновесие между фазами.
Если предположить, что в процессе направленной кристаллизации k остается постоянным, диффузия в твердой фазе незначительна, а в жидком сплаве происходит полное перемешивание, то распределение примеси в твердой фазе может быть выражено уравнением:
С= w С0Ж (1- g ) w -1 , (4.21)
где С0Ж – первоначальная (средняя) концентрация примеси в жидком сплаве; g – закристаллизовавшаяся часть отливки.
В зависимости от условий роста удовлетворительное перемешивание в расплаве можно осуществить различными способами, например вращением растущего кристалла и остающейся жидкой фазы в противоположных направлениях.
Более сложное распределение примеси по длине образца возникает, когда наблюдаемая диффузия в твердой фазе пренебрежимо мала, а перенос примеси в жидкой фазе осуществляется только диффузионным путем, т.е. конвективные потоки и механическое перемешивание отсутствуют. В этих условиях концентрация расплава стано-вится неравномерной. При w <1 примесь накапливается впереди движущейся меж-фазной границы, образуя концентрационное уплотнение (диффузионный слой). Когда максимальная концентрация на межфазной поверхности достигает значения С0Ж/ w 0, устанавливается стационарное состояние, при котором кристаллизуется твердая фаза состава С0Ж, т.е. эффективный коэффициент распределения достигает 1.
Конечное распределение примеси по длине образца при указанных предположениях схематично показано на рис. 4.7.
Это распределение, состоящее из трех характерных участков А, В, С, существенно отличается от рассмотренного ранее, которое образуется при полном перемешивании в расплаве. На концентрационной кривой появляется характерный прямой участок, когда эффективный коэффициент распределения равен 1.
Коэффициент распределения и скорость кристаллизации, – постоянные величины. Рассмотрение последовательных этапов кристаллизации показывает, что в начальной стадии кристаллизации (участок А) впереди перемещающейся межфазной границы происходит постепенное накопление примеси и образование обогащенного слоя – концентрационного уплотнения. Конец участка А соответствует стабилизации концентрационного уплотнения, характер распределения примеси в котором не меняется на протяжении кристаллизации участка В.
Протяженность начального участка А определяется при помощи выражения
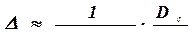 ; (4.22)
; (4.22)
распределение примеси в стабилизировавшемся концентрационном уплотнении описывается выражением
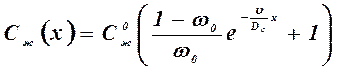 , (4.23)
, (4.23)
где DС – коэффициент диффузии примеси в расплаве, v - скорость движения межфазной границы (скорость роста кристалла), w 0 – коэффициент распределения на межфазной поверхности, равный равновесному значению, х – расстояние, измеряемое от межфазной границы в глубь расплава.
Из приведенной зависимости следует, что в состоянии стабилизации концентрационного уплотнения (участок В) концентрация примеси на межфазной границе (х=0) 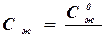 . При этом в кристалл врастает примесь в концентрации, равной среднему составу расплава:
. При этом в кристалл врастает примесь в концентрации, равной среднему составу расплава:
Ств= w 0 СЖ=С0Ж (4.24)
Протяженность концентрацион-ного уплотнения принято описывать характеристическим состоянием (толщиной) d x = D ж / u, в пределах которого начальная концентрация уменьшается в е-1 раз.
Было показано, что при изменении скорости движения межфазной поверхности в состоянии стабилизации концентрационного уплотнения в твердой фазе образуется локальное изменение концентрации. Увеличение скорости приводит к созданию прослойки с более высоким содержанием примеси по сравнению со средним составом твердой фазы, и наоборот. Поэтому при периодическом изменении скорости движения межфазной границы будет возникать слоистая химическая неоднородность.
Участок С соответствует моменту кристаллизации, когда концентрационное уплотнение подошло к задней стенке тигля. При этом стабильность процесса нарушается. Очевидно, что протяженность конечного участка С равна примерно характеристической толщине концентрационного уплотнения.
Рассмотренные случаи соответствуют наиболее простым условиям кристаллизации – полному перемешиванию в расплаве и отсутствию перемешивания, когда процесс переноса примеси осуществляется только путем диффузии.
В общем случае кристаллизации оба процесса протекают одновременно, причем в зависимости от конкретных условий преимущественное развитие получает первый или второй процесс переноса. При любом виде перемешивания в расплаве уменьшается протяженность концентрационного уплотнения (диффузионного слоя). Предполагается, что какое бы ни было перемешивание, к межфазной поверхности примыкает обогащенный примесями слой расплава толщиной d, в котором диффузия контролирует процессы переноса. В остальной массе расплава перемешивание в каждый момент времени поддерживает равномерную концентра  цию СЖ. Изменение скорости перемешивания приведет к образованию соответствующей слоистой неоднородности.
цию СЖ. Изменение скорости перемешивания приведет к образованию соответствующей слоистой неоднородности.
При очень больших скоростях охлаждения следует ожидать изменения процессов обмена на межфазной поверхности в направлении врастания примеси в твердую фазу и, следовательно, более быстрого увеличения эффективного коэффициента распределения.
Кривая ТЖ отображает равновесную температуру начала кристаллизации соответствующих участков концентрационного уплотнения по мере удаления от межфазной границы в глубь расплава. Значения этих температур для известных составов можно определить по кривой ликвидуса соответствующей диаграммы состояния.
Линия ТД представляет действительное распределение температур, наиболее часто встречающееся в практике при затвердевании слитков, отливок и сварных швов. Область между кривыми соответствует объему сплава, находящемуся при температуре ниже его равновесной температуры начала кристаллизации, т.е. в переохлажденном состоянии. Это явление составляет сущность концентрационного переохлаждения, связанного с составом жидкой фазы перед фронтом кристаллизации в отличие от обычного термического переохлаждения для чистых металлов.
Межфазная поверхность будет теперь стимулировать самопроизвольное затвердевание переохлажденного расплава, стремясь устранить переохлаждение.
На первоначально плоском фронте кристаллизации возникает ряд выступов, прорастающих в расплав. Возникший градиент концентраций вызывает диффузию примеси от вершины выступа в боковом направлении и обогащение пограничных зон между выступами. В результате образуется характерная ячеистая структура, вытянутая в направлении роста. Отдельный кристаллит можно представить в виде связки карандашей, оси которых совпадают с направлениями роста, а границы между ними обогащены примесями.
Граница устойчивости плоского фронта кристаллизации определяется условием:
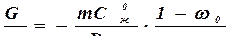 , (4.25)
, (4.25)
где G – температурный градиент в расплаве у фронта кристаллизации; m – наклон линии ликвидус.
Если правая часть соотношения (4.25) меньше левой, происходит развитие ячеистой структуры.
При больших значениях концентрационного переохлаждения происходит увеличение протяженности ячеистых выступов и искривление границ ячеек. Ячеистая межфазная поверхность становится неустойчивой, и при определенном отношении длины ячеек к их ширине возникают боковые ответвления, т.е. начинается развитие дендритных форм. Также дендритная структура возникает и при термическом переохлаждении, когда температура расплава не возрастает по мере удаления от межфазной поверхности, как при концентрационном переохлаждении, а наоборот, понижается.
Рассмотренная выше структура фронта кристаллизации в отличие от идеализированной макроскопически гладкой поверхности раздела более детально характеризует развитие микроскопической химической неоднородности при росте ячеистых или дендритных форм.
Из общей теории роста кристаллов следует, что в процессе роста любая поверхность кристалла принимает ступенчатую форму, состоящую из отдельных слоев. Слои растут путем присоединения атомов на своих краях. При скоплении большого числа атомных слоев, характеризующихся одинаковым направлением их фронтов, наблюдается тенденция к группировке многих слоев и созданию большой ступени толщиной до 1 мкм. В металлических кристаллах с ГЦК решеткой, растущих в условиях отсутствия концентрационного переохлаждения, плоскостью слоев являются [111] или [100].
Рис. 4.9. Схема бокового роста слоев ориентации [111] на межфазной поверхности
 |
На рис. 4.7 схематично изображено сечение кристалла плоскостью, перпендикулярной поверхности раздела. Кристаллизация происходит путем бокового роста пластинчатых слоев ориентации [111], составляющих угол Q со средней поверхностью раздела.
Возможно, во внутренних углах между отдельными слоями или ступенями в условиях стационарного роста возникает более высокая концентрация примеси по сравнению с внешними углами. В результате этого в твердой фазе образуется слоистая микроскопическая неоднородность.
Концентрированное переохлаждение позволяет объяснить рост дендритов в направлении повышения температуры жидкого сплава, что имело место при кристаллизации слитка в обычных условиях.
Концентрационное переохлаждение может вызвать образование новых центров кристаллизации в жидкой фазе впереди фронта кристаллизации. Это является одной из причин развития зоны равновесных кристаллитов в центральных областях слитка.
Дата: 2019-04-23, просмотров: 314.