При охлаждении жидкого металла ниже определенной температуры в его отдельных микроскопических объемах начинается возникновение и рост кристаллов. Соединяясь между собой после исчезновения жидкости, они образуют микроструктуру. Процесс образования структуры при переходе из жидкого состояния в твердое называется кристаллизацией.
Кристаллизацию можно представить в виде следующей модели. Пусть железные кубики при температуре выше точки Кюри, когда железо немагнитно, беспорядочно насыпаны в сосуд. Они имитируют жидкость. При охлаждении кубики намагничиваются и между ними возникают силы притяжения. Однако трение не позволяет им образовать структуру и в таком виде они имитируют аморфное твердое тело. Если при охлаждении сосуд встряхивается, то кубики изменяют свое положение и образуют некоторую структуру. В таком виде они имитируют твердое кристаллическое тело. Энергия, затраченная на встряхивание, соответствует скрытой теплоте кристаллизации.
Переохлаждение при кристаллизации как явление было открыто Фаренгейтом в 1724 г. в опытах на воде. Русский академик Т. Ловиц провел его систематическое изучение в 1785 г. Переохлаждение при кристаллизации легкоплавких металлов на 2— 10° С начали фиксировать сразу же, как только были найдены средства измерять их температуру. В начале 40-х годов было достигнуто переохлаждение железа до 200° С. В. И. Данилов и Д. С. Каменецкая, наблюдая за кристаллизацией мелких капель металлов, зафиксировали еще большие переохлаждения. И. С. Мирошниченко, изучая кристаллизацию тонких пленок, достиг огромных скоростей охлаждения (до 108 град/с), при которых удалось получить металлы в аморфном состоянии.
Температура в центре небольших масс кристаллизующегося металла после снятия перегрева, при наличии переохлаждения, продолжает опускаться ниже точки равновесной кристаллизации (рис. 35), достигнув некоторого минимального значения, температура поднимается. Это соответствует началу кристаллизации. Теплота кристаллизации нагревает переохлажденный металл до равновесной температуры кристаллизации. После этого процесс приостанавливается, температура в течение некоторого времени сохраняется постоянной и соответствует точке кристаллизации (кривая /). Если скорость охлаждения очень велика, то переохлаждение оказывается настолько значительным, что кристаллизация полностью подавляется (кривая 2). При этом получается твердое аморфное тело.
Одновременные измерения температур в различных точках тигля средних размеров на разных расстояниях от центра показали, что переохлаждение в них имеет очень близкие значения.
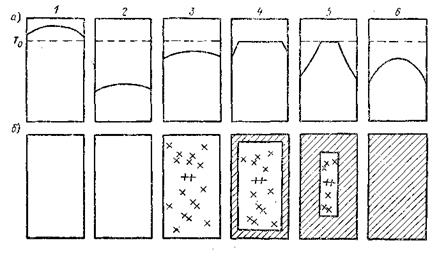
Рис. 4.1. Объемная и последовательная стадии кристаллизации отливки; а –температурное поле; б – схема кристаллизации
Термопары, установленные у поверхности, показывали лишь незначительное его увеличение по сравнению с центром. Следовательно, при быстром охлаждении переохлаждение охватывает весь объем металла.
Помимо природы сплава и скорости охлаждения на величину переохлаждения оказывает большое влияние степень чистоты металла. Переохлаждения оказываются наибольшими при проведении опытов с наиболее чистыми металлами в вакууме.
В общем случае, при не очень больших количествах металла, объемная кристаллизация из переохлажденного состояния и последовательная кристаллизация отливки представляют собой две фазы единого процесса (рис. 6.1.).
В момент 1 температура металла во всех точках лежит выше температуры кристаллизации — Т0, и твердая фаза в отливке отсутствует. В момент 2 металл переохлаждается и его температура во всех точках лежит ниже Т0; твердая фаза отсутствует. В момент 3 температура, перейдя через минимум, повышается, и начинается объемная кристаллизация, более или менее равномерно заполняющая весь объем металла. В момент 4 температура в средней части отливки достигала, температуры кристаллизации, а в поверхностном твердом, слое опускалась ниже ее, образовав определенный перепад. Во внутренней части сосуществуют жидкая фаза и кристаллы, образовавшиеся за счет объемной кристаллизации переохлажденного металла. В момент 5 последовательная кристаллизация продолжается при понижении температуры в наружной корочке. Наконец, в момент 6 вся отливка затвердевает, и температура во всех ее точках опускается ниже температуры кристаллизации.
Кинетика процессов теплообмена между отливкой и литейной формой определяется термодинамическими свойствами сплава в жидком и твердом состояниях, видом литья, теплофизическими характеристиками материала формы, размерами отливки. Фазовые превращения в литейном сплаве происходят в процессе охлаждения и термообработки отливки в соответствии с равновесными и неравновесными диаграммами состояния. Таким образом, в процессе формирования отливки из полиморфного сплава многофакторный технологический процесс определяет многообразие возможных результатов, обусловленных взаимодействием различных физико-химических механизмов. При этом исходные факторы – химический состав, технология литья и режим термообработки – влияют на комплекс свойств, определяющих качество, через кинетику протекания взаимосвязанных физико-химических процессов. В соответствии с принятой схемой формирование химической неоднородности в отливке происходит на ряде последовательных этапов. Для сталей можно выделить четыре этапа [11].
 |
Ликвация легирующих элементов, происходящая при дендритной кристаллизации расплава с образованием твердого раствора. На нее влияют следующие факторы: состав сплава; обобщенная характеристика диаграммы состояния-коэффициент распределения, определяющий соотношение растворимости в твердой и жидкой фазах, т. е. мощность источника или стока вещества; технология изготовления отливки, в данном случае определяющая скорость охлаждения и кристаллизации и задающая вид и дисперсность структуры; диффузионная подвижность элемента добавки в твердой и жидкой фазах.
Самопроизвольная гомогенизация при первичном охлаждении (автогомогенизация), определяемая уровнем сформировавшейся на первом этапе дендритной ликвации, скоростью охлаждения, дисперсностью структуры и диффузионной подвижностью растворенного элемента.
Перераспределение добавки при фазовом превращении  , обусловленное диаграммой состояния, скоростью охлаждения, неоднородностью состава сплава после первых двух этапов.
, обусловленное диаграммой состояния, скоростью охлаждения, неоднородностью состава сплава после первых двух этапов.
Формирование зернограничных обогащений и рост частиц новой фазы, определяемый кинетикой распада пересыщенных химически неоднородных растворов.
Для кристаллов характерно наличие дальнего порядка в расположении атомов, т.е. в кристаллах существует строго определенное геометрически правильное расположение атомов, которое наблюдается на любом расстоянии от произвольно выбранного атома кристаллической решетки вплоть до границы кристаллов. При плавлении кристаллов дальний порядок нарушается и сохраняется ближний порядок в расположении атомов, при котором в расплаве сохраняется некоторая упорядоченность лишь вблизи произвольно выбранного атома, по мере удаления от которого степень упорядоченности быстро падает. Переход кристаллического вещества из жидкого состояния в твердое заключается в установлении дальнего порядка в расположении атомов вещества [7].
Зарождение кристаллов
Система, состоящая из большого числа атомов, молекул и ионов, стремится к такому состоянию, которому в данных условиях соответствует минимальное значение свободной энергии (при постоянном объеме системы) или термодинамического потенциала (при постоянном давлении). Такое состояние будет стабильным. Если вещество может существовать в жидком и твердом кристаллическом видах, то устойчивость в данных условиях жидкой или твердой фазы определяется относительной величиной свободной энергии или термодинамического потенциала обеих фаз.

При температуре Т0 система фаз находится в динамическом равновесии, так как свободная энергия обеих фаз одинакова. С изменением температуры Т относительно Т0 равновесие нарушается и начинается превращение, в результате которого система придет в стабильное состояние.
При любой температуре Т, меньшей Т0 (температуру Т0 можно принять приблизительно равной температуре плавления вещества), расплав должен кристаллизоваться, так как устойчивой будет твердая кристаллическая фаза. Однако для начала кристаллизации в переохлажденном расплаве, т.е. охлажденном ниже Т0 данного металла или сплава, должны появиться зародыши кристаллов (центры кристаллизации). Если они не появятся, то переохлажденный расплав окажется в метастабильном состоянии, которое не соответствует минимальной, для данных условий, свободной энергии системы.
Центры кристаллизации (зародыши кристаллов) могут возникать в переохлажденном расплаве вследствие наличия в нем фазовых (или гетерофазных) флуктуаций.
Фазовые флуктуации – участки с таким же расположением атомов, как и в кристалле, т.е. участки, в которых устанавливается дальний порядок в расположении атомов и, следовательно, создается поверхность, отделяющая эти участки от остального расплава.
Такие участки расплава называются сиботаксическими группами или класторами.
Фазовые флуктуации в переохлажденном расплаве возможны вследствие флуктуации энергии расплава, так как для образования в переохлажденном расплаве участков, обладающих свойствами кристаллов, необходимо затратить работу, равную разности энергии, требующейся на создание поверхности раздела, и энергии, выделяющейся при переходе данных участков расплава из метастабильного состояния в стабильное.
Если размеры таких участков (по существу кристалликов) очень малы, то дальнейший рост будет невозможен, так как затрата энергии на создание поверхности раздела фаз будет превышать ту энергию, которая выделяется при переходе участков переохлажденного расплава в стабильное состояние. Это приведет к увеличению свободной энергии кристалликов, и они, возникнув, сразу же распадутся. Если размер кристалликов равен или больше критического, то при их росте выигрыш энергии будет превышать затрату – такие кристаллики станут зародышами кристаллов (центрами кристаллизации).
Расчеты показывают, что для образования зародыша критического размера необходимо затратить работу АК, равную одной трети свободной энергии поверхности кристаллика:
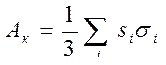 , (4.1)
, (4.1)
где Si – поверхность i-й грани зародышевого кристаллика;
si - поверхностное натяжение расплава на этой грани.
Если равновесной формой кристаллика является куб, то
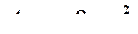 , (4.2)
, (4.2)
где  - радиус сферы, вписанной в куб критического размера,
- радиус сферы, вписанной в куб критического размера,
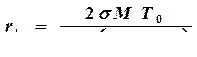 , (4.3.)
, (4.3.)
где М – молекулярная масса вещества; r - плотность вещества; L – теплота плавления одной моли вещества.
Очевидно, что с увеличением переохлаждения DТ расплава критический размер зародыша уменьшается и, следовательно, повышается вероятность его возникновения, так как с увеличением переохлаждения расплава существенно уменьшается работа образования зародыша; из (4.1) и (4.2):
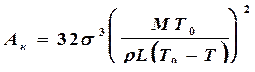 . (4.4)
. (4.4)
Для любого данного переохлаждения в силу хаотичности теплового движения атомов в расплаве число фазовых флуктуаций критического размера пропорционально вероятности энергетической флуктуации АК:
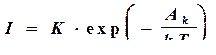 , (4.5)
, (4.5)
где k – постоянная Больцмана; К – кинетический коэффициент, величина которого определяется скоростью обмена атомами между зародышем и расплавом.
 Если принять, что вероятность перехода атомов из расплава в зародыш пропорциональна подвижности их в расплаве при температуре, то имеем:
Если принять, что вероятность перехода атомов из расплава в зародыш пропорциональна подвижности их в расплаве при температуре, то имеем:
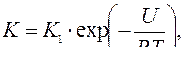 (4.6)
(4.6)
так как U – энергия активации атомов в расплаве и R – газовая постоянная; К1 – множитель пропорциональности, равный приблизительно числу атомов в рассматриваемом объеме расплава (для одной моли К1»1023).
Из формулы (4.3) с учетом (4.4) и (4.6) получается зависимость скорости n зарождения центров кристаллизации от переохлаждения DТ=Т0 – Т расплава:
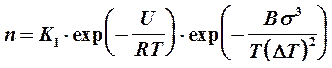 , (4.7)
, (4.7)
где 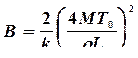 - постоянная вещества.
- постоянная вещества.
 На рис. 4.5 приведена зависимость n(DT) скорости зарождения центров кристаллизации от переохлаждения; с ростом переохлаждения скорость кристаллизации увеличивается, достигает максимума и с дальнейшим ростом переохлаждения уменьшается до нуля.
На рис. 4.5 приведена зависимость n(DT) скорости зарождения центров кристаллизации от переохлаждения; с ростом переохлаждения скорость кристаллизации увеличивается, достигает максимума и с дальнейшим ростом переохлаждения уменьшается до нуля.
Непосредственно вблизи температуры плавления вещества имеется область переохлаждения, в которой скорость зарождения практически равна нулю; заметное увеличение скорости начинается только по достижении определенного переохлаждения. Интервал температуры DТ/, в котором центры кристаллизации практически не возникают, является интервалом метастабильности расплава вещества в данных условиях. Кривая рис.4.5. обладает всеми свойствами тамановской кривой.
Для металлов, в том числе технических, фактор U/RT (4.7), тормозящий процесс зарождения кристаллов, имеет весьма малое значение, так как атомы металлов достаточно подвижны (U достаточно мала, а температура плавления большинства металлов сравнительно высока). В соответствии с этим в формуле (4.7) первый экспоненциальный множитель можно принять приблизительно равным единице. Тогда
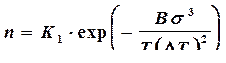 , (4.8)
, (4.8)
т.е. зависимость скорости самопроизвольного зарождения центров кристаллизации от переохлаждения выразится кривой, имеющей только восходящую ветвь.
Рост кристаллов
Согласно современной теории кристаллизации, кристаллы растут по-разному, в зависимости от состояния поверхности их граней.
Для атомарно-гладких поверхностей характерен послойный рост путем образования на гранях двухмерных зародышей, которые затем разрастаются вдоль этих граней. Разрастание происходит в результате присоединения атомов расплава на ступенях, возникших между гранью кристалла и образовавшимися на ней двухмерными зародышами. В этом случае линейная скорость v роста кристаллов будет определяться вероятностью образования двухмерных зародышей и выразится формулой, аналогичной (4.7):
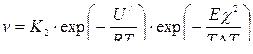 , (4.9)
, (4.9)
где К2 – множитель пропорциональности, равный приблизительно числу атомов на поверхности рассматриваемого объема (для одной моли К2»1016); U/ - некоторая энергия активации, аналогичная U в формуле (4.7), определяющая скорость обмена атомами между двухмерными зародышами и расплавом (U/»1/4U); Е – постоянная вещества, аналогичная по смыслу величине В (4.7) ( 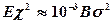 ); c - «граничное» натяжение расплава на периферии двухмерного зародыша.
); c - «граничное» натяжение расплава на периферии двухмерного зародыша.
Кривая зависимости линейной скорости роста кристаллов от переохлаждения аналогична кривой скорости зарождения (рис. 4.3).
Восходящий участок кривой определяется вероятностью зарождения, нисходящий – замедлением перехода атомов из расплава в кристалл при увеличении переохлаждения.
Рост кристалла начинается только при определенном переохлаждении DТ//, однако оно значительно меньше интервала метастабильности расплава при зарождении центров кристаллизации.
Учитывая, что атомы металлов в расплаве достаточно подвижны (U/ - достаточно мала, а температура их плавления сравнительно высока), первый экспоненциальный множитель в (4.9) аналогично (4.7) можно принять равным единице. Тогда для металлов:
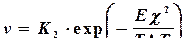 , (4.10)
, (4.10)
т.е. зависимость линейной скорости послойного роста кристаллов металлов с атомарно-гладкими поверхностями граней от переохлаждения выразится кривой, имеющей только восходящую ветвь.
Кристаллы, на гранях которых имеются готовые ступеньки, возникшие в результате выхода винтовых дислокаций, растут также послойно в результате присоединения атомов расплава к этим ступенькам. В этом случае зависимость линейной скорости роста от переохлаждения выражается формулой:
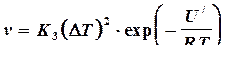 , (4.11)
, (4.11)
где К3 – кинетический коэффициент, характеризующий свойства вещества; при малых переохлаждениях он принимается постоянным.
Для металлов формулу (6.11) можно представить (учитывая (4.9) в виде:
v = K3(DT) . (4.12)
Экспериментально установлено, что дислокационный послойный рост кристаллов происходит при значительно меньших переохлаждениях, чем послойный рост в результате образования двухмерных зародышей.
Для атомарно-шероховатых поверхностей граней кристаллов характерен так называемый нормальный рост в результате беспорядочного присоединения атомов расплава к любым точкам таких поверхностей. В результате грань растущего кристалла перемещается однородно, нормально к самой себе. В этом случае зависимость линейной скорости роста от переохлаждения выражается формулой:
n = K4(DT) , (4.13)
где К4 – кинетический коэффициент, аналогичный по смыслу К3.
Предполагается, что нормальный рост кристаллов происходит при малых переохлаждениях.
Дата: 2019-04-23, просмотров: 375.