При изучении выщелачивания кобальта из алюмо-кобальтового остатка (кека) после выщелачивания молибдена водными растворами Na2CO3 из обожженного АКМ катализатора, использовали водные растворы NH4OH и смешанные растворы (NH4)2CO3+NH4OH, (NH4)2CO3+NH4НCO3. Для окисления кобальта(II) до кобальта(III) использовали продувку воздуха или водный раствор H2O2. Содержание молибдена в исходном кеке составляло – 0,1-3,5% (в зависимости от условий проведения процесса выщелачивания молибдена), кобальта – 3,5%, алюминия – 32%.
3.3.2 Разработка метода спектрофотометрического определения кобальта в водных растворах
Был разработан метод определения кобальта в водных растворах по спектрам собственного поглощения соединений кобальта.
Построена калибровочная зависимость по спектрам собственного поглощения для систем (NH4)2CO3-NH4OH,рис.3.14.
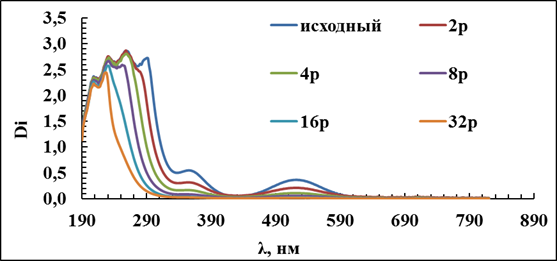
Рис.3.14. Спектры собственного поглощения кобальта. Разбавление в исходном растворе. Условия: t=25C, (NH4)2CO3+NH4OH-1,25M. (Исх. – исходный раствор, 2р – разбавление в 2 раза в исходном растворе, 4р - разбавление в 4 раза в исходном растворе, 8р - разбавление в 8 раз в исходном растворе, 16р - разбавление в 16 раз в исходном растворе, 32р - разбавление в 32 раза в исходном растворе)
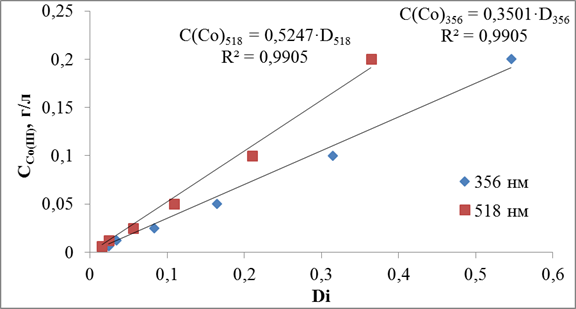
Рис.3.15. Калибровочная зависимость в системах (NH4)2CO3-NH4OH.
Так же была построена калибровочная зависимость по спектрам собственного поглощения для систем (NH4)2CO3 – NH4HCO3.
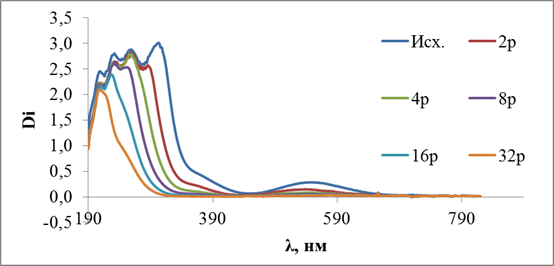
Рис.3.16. Спектры собственного поглощения. Разбавление в исходном растворе. Условия: t=25C, (NH4)2CO3 – NH4HCO3 - 1M. (Исх. – исходный раствор, 2р – разбавление в 2 раза в исходном растворе, 4р - разбавление в 4 раза в исходном растворе, 8р - разбавление в 8 раз в исходном растворе, 16р - разбавление в 16 раз в исходном растворе, 32р - разбавление в 32 раза в исходном растворе)
По данным спектрам построена калибровочная зависимость для систем (NH4)2CO3 – NH4HCO3, рис.3.17.
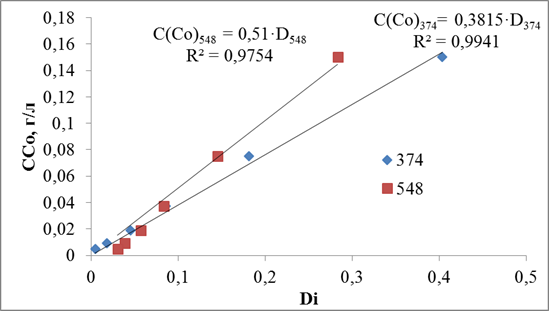
Рис.3.17. Калибровочная зависимость для систем (NH4)2CO3 – NH4HCO3.
Для каждой из систем были выведены уравнения для определения концентраций кобальта в растворах после выщелачивания по двум λ собственного поглощения.
Для системы (NH4)2CO3-NH4OH выведены уравнения () и (), которые соответствуют λ собственного поглощения равным 356 и 518.
С(Со)356=0,3501·D356 ()
С(Со)518=0,5247·D518 ()
А для системы (NH4)2CO3-NH4HCO3 выведены уравнения () и (), которые соответствуют λ собственного поглощения равным 374 и 548.
C(Co)374= 0,3815·D374 ()
C(Co)548 = 0,51·D548 ()
3.3.3 Выщелачивание кобальта из алюминий-кобальтового кека водными растворами NH 4 OH
При выщелачивании кобальта из алюминий-кобальтового кека 5,8 М водным раствором NH4OH в присутствии 0,01 M H2O2 при Т:Ж=1:6, t=20±2°С, τПЕР.=300 мин., скорость перемешивания пульпы – 1000 об/мин., величина αСо за 2 ступени выщелачивания составила 26,7%, табл. 3.26. При увеличении количества ступеней выщелачивания до 3, αСо не увеличивалась.
Таблица 3.26
Выщелачивание кобальта из алюминий-кобальтового кека 5,8 М NH4OH в присутствии 0,01 М H2O2.
Условия выщелачивания: Т:Ж=1:6, t=20±2°С, τПЕР.=300 мин., скорость перемешивания пульпы – 1000 об/мин.
| № ступени | ССо, г/л | αСо, % |
| 1 | 1,1 | 10,6 |
| 2 | 1,5 | 16,1 |
| 3 | 0,0 | 0,0 |
В табл. 3.27 представлены кинетические данные выщелачивания кобальта 6,8 М NH4OH в присутствии 0,18 М H2O2 при Т:Ж=1:50, t=50°С. Концентрацию кобальта в аммиачных растворах измеряли спектрофотометрическим методом по собственному поглощению Co(III).
Таблица 3.27
Кинетика выщелачивания кобальта из алюминий-кобальтового кека 6,8 М NH4OH в присутствии 0,18 М H2O2 (по данным спектрофотометрического определения)
Условия выщелачивания: Т:Ж=1:50, t=50°С, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| τ, мин | 0 | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III)), г/л | 0 | 0,06 | 0,08 | 0,10 | 0,11 | 0,11 | 0,12 |
| α(Со(III)), % | 0 | 7,9 | 10,8 | 13,6 | 14,6 | 15,2 | 16,4 |
После 180 мин выщелачивания, равновесная концентрация NH4OH в растворе составила 5,1 М. В растворах по истечению 5-8 ч наблюдали образование вторичных осадков розового цвета. В результате вторичного осадкообразования концентрация кобальта в растворе снижалась. По результатам гравиметрического определения концентрации кобальта в растворе после 180 мин. выщелачивания (0,19 г/л), величина αСо составила 25,7%.
При снижении температуры выщелачивания с 50°С до 25°С, концентрация кобальта, достигаемая за 180 мин выщелачивания снижалась с 0,19 г/л до 0,14 г/л, а величина αСо с 25,7% до 19,4% (по данным гравиметрии) при прочих равных условиях (Рис.). Снижение концентрации NH4OH с 6,8М до 1,1М также приводило к снижению извлечения кобальта в раствор. Концентрация металла в растворе снижалась до 0,07 г/л, а величина αСо до 10,2% (выщелачивание 1,1М NH4OH при 25°С, Т:Ж=1:50). Во всех случаях по истечению 5-8 ч наблюдали образование вторичных осадков.
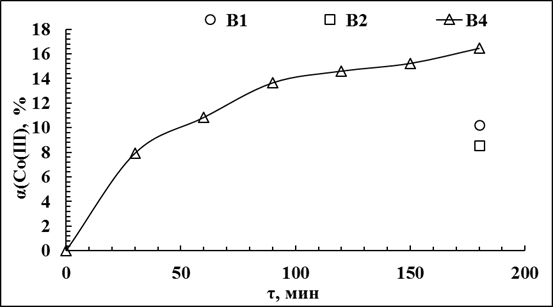
Рис.3.18. Кинетика выщелачивания кобальта растворами NH4OH .
Вторичные осадки представляют из себя очень рентгеноаморфный порошок, поэтому фазы было сложно идентифицировать. Таким образом были определены только соединения кобальта и алюминий представленные Al2.66O4 и Co3O4.
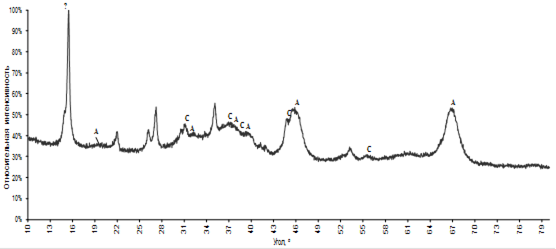
Рис.3.19. Рентгенограмма вторичного осадка.
A-Al2.66O4 (JSPDC № 77-0403), C - Co3O4 (JSPDC № 42-1467)
Некоторые рефлексы не удалось идентифицировать.
3.3.3 Выщелачивание кобальта из алюминий-кобальтового кека водными растворами NH4OH-(NH4)2CO3
При выщелачивании кобальта из алюминий-кобальтового кека водным смешанным раствором 0,58 М NH4OH+0,9 M (NH4)2CO3 при барботаже воздуха (расход 10 л/ч), Т:Ж=1:5, t=20±2°С, τПЕР.=180 мин., скорость перемешивания пульпы – 1000 об/мин., величина αСо за одну ступень составила 11,4% (концентрация кобальта в растворе составляла 1,02 г/л). При увеличении концентрации аммиака в составе смешанного раствора с 0,58 М до 1,15 М, величина αСо за одну ступень увеличивается с 11,4% до 19%. Суммарная величина степень αСо за 4 ступени при выщелачивании смешанным раствором 1,15 М NH4OH+0,8 М (NH4)2CO3 составила 51%, табл. 3.28.
Таблица 3.28
Выщелачивание кобальта из алюминий-кобальтового кека смешанным раствором состава 1,15М NH4OH+0,8 M (NH4)2CO3.
Условия выщелачивания: барботаж воздуха (расход 10 л/ч), Т:Ж=1:5, t=20±2°С, τПЕР.=180 мин., скорость перемешивания пульпы – 1000 об/мин.
| № контакта | 1 | 2 | 3 | 4 |
| ССо, г/л | 1,7 | 1,3 | 1,2 | 0,3 |
| αСо, % | 19,0 | 14,4 | 13,2 | 3,9 |
При изучении кинетики выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 1,15 М NH4OH+0,8 M (NH4)2CO3 при Т:Ж=1:5, t=25°C, было установлено, что равновесие в системе достигается за 480 мин. проведения процесса, табл. 3.29, при этом αСо составила 18,6% (концентрация кобальта в растворе 1,7 г/л). Величина αAl за 480 мин. составила 4,1% (концентрация Al в растворе составила 3 г/л).
Таблица 3.29
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 1,15 М NH4OH+0,8 M (NH4)2CO3.
Условия выщелачивания: Т:Ж=1:5, t=25°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | τПЕР., мин | ССо, г/л | αСо, % |
| 1 | 0 | 0,0 | 0,0 |
| 2 | 120 | 1,1 | 12,8 |
| 3 | 240 | 1,3 | 14,4 |
| 4 | 480 | 1,7 | 18,6 |
| 5 | 540 | 1,6 | 17,9 |
При увеличении температуры процесса c 25°C до 50°C, величина αСо за одну ступень увеличивалась более чем в 2 раза (с 11,4% до 24,2%), табл. 3.30, при выщелачивании смешанным раствором состава 1,15 М NH4OH+0,8 M (NH4)2CO3 в присутствии 0,05 М H2O2 при Т:Ж=1:5.
Таблица 3.30
Выщелачивание кобальта из алюминий-кобальтового кека смешанным раствором состава 1,15 М NH4OH+0,8 M (NH4)2CO3 в присутствии 0,05 М H2O2.
Условия выщелачивания: Т:Ж=1:5, τПЕР.=180 мин., скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | ССо, г/л | αСо, % |
| t=25°C | ||
| 1 | 1,0 | 11,4 |
| t=50°C | ||
| 2 | 2,1 | 24,2 |
Таблица 3.31
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,8 М NH4OH+1,8 M (NH4)2CO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=25°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III)), г/л | 0,00 | 0,14 | 0,18 | 0,20 | 0,20 | 0,20 |
| α(Со(III)), % | 0,0 | 20,0 | 25,7 | 28,0 | 28,4 | 28,6 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III)), г/л | 0,20 | 0,22 | 0,22 | 0,22 | 0,22 | 0,21 |
| α(Со(III)), % | 29,0 | 31,4 | 31,6 | 31,2 | 31,1 | 30,0 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 в растворе составила 0,9 М. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом ICP-MS в аналитическом центре АО «Институт «ГИНЦВЕТМЕТ» (0,2 г/л), величина αСо составила 29,9%, а по данным гравиметрии (0,19 г/л) – 28,6%.
Таблица 3.32
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,825 М NH4OH+1,775 M (NH4)2CO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=50°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III)), г/л | 0,00 | 0,20 | 0,24 | 0,25 | 0,26 | 0,26 |
| α(Со(III)), % | 0,0 | 28,4 | 34,1 | 35,5 | 36,9 | 37,4 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III)), г/л | 0,26 | 0,28 | 0,30 | 0,30 | 0,30 | 0,32 |
| α(Со(III)), % | 37,4 | 39,8 | 43,1 | 43,1 | 42,7 | 45,7 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация NH4OH и (NH4)2CO3 в растворе составила 0,15 М и 0,4 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,28 г/л) – 39,8%.
Таблица 3.33
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,825 М NH4OH+1,775 M (NH4)2CO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=75°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,35 | 0,37 | 0,38 | 0,39 | 0,40 |
| α(Со(III), % | 0,0 | 48,9 | 51,7 | 53,1 | 54,5 | 55,9 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,39 | 0,39 | 0,39 | 0,39 | 0,40 | 0,40 |
| α(Со(III), % | 54,9 | 54,9 | 55,0 | 55,1 | 55,3 | 55,3 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация NH4OH и (NH4)2CO3 в растворе составила 0,15 М и 0,4 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,40 г/л) – 56,1%.
Таблица 3.34
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,2 М NH4OH+1,9 M (NH4)2CO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=75°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,34 | 0,37 | 0,39 | 0,39 | 0,39 |
| α(Со(III), % | 0,0 | 48,3 | 52,8 | 55,1 | 55,6 | 55,5 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,39 | 0,40 | 0,40 | 0,37 | 0,36 | 0,33 |
| α(Со(III), % | 55,5 | 56,7 | 57,0 | 52,9 | 52,0 | 47,1 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация NH4OH и (NH4)2CO3 в растворе составила 0,15 М и 0,4 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,26 г/л) – 37,7%.
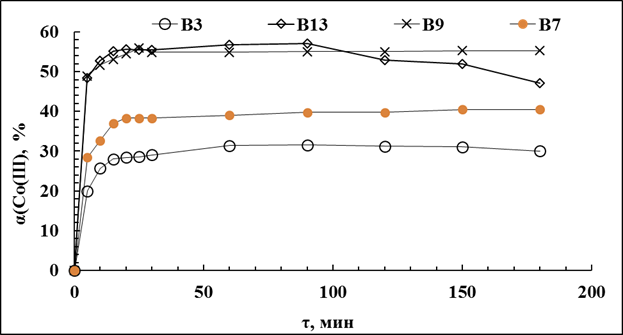
Рис.3.20. Кинетики выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором NH4OH+(NH4)2CO3
1 – Условия: (В3- Исх. р-р: 0,8МNH4OH+1,8М(NH4)2CO3. t=25°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М,
В7- Исх. р-р: 0,825М NH4OH+1,775М (NH4)2CO3. Равн. р-р: 0,15М NH4OH+0,4М (NH4)2CO3. t=50°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М,
В9 - Исх. р-р: 0,825МNH4OH+1,775М(NH4)2CO3. Равн. р-р: 0,15МNH4OH+0,4М(NH4)2CO3. t=75°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М,
В13 - Исх. р-р: 0,2МNH4OH+1,9М(NH4)2CO3. Равн. р-р: 0,15МNH4OH+0,4М(NH4)2CO3. t=75°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М)
3.3.4 Выщелачивание кобальта из алюминий-кобальтового кека водными растворами (NH4)2CO3-NH4НCO3
Таблица 3.35
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,7M (NH4)2CO3 + 0,2М NH4НCO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=25°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,08 | 0,13 | 0,15 | 0,16 | 0,15 |
| α(Со(III), % | 0,0 | 11,4 | 18,6 | 20,7 | 22,2 | 21,4 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,16 | 0,17 | 0,16 | 0,15 | 0,16 | 0,16 |
| α(Со(III), % | 22,2 | 24,2 | 22,6 | 21,6 | 22,9 | 22,9 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 и NH4НCO3 в растворе составила 0,4 М и 0,2 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,15 г/л) – 22,5%.
Таблица 3.36
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,7M (NH4)2CO3 + 0,58М NH4НCO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:83, t=50°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,11 | 0,15 | 0,18 | 0,19 | 0,19 |
| α(Со(III), % | 0,0 | 26,2 | 35,7 | 42,9 | 44,0 | 45,3 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,19 | 0,20 | 0,20 | 0,20 | 0,19 | 0,18 |
| α(Со(III), % | 45,3 | 47,1 | 47,3 | 47,6 | 45,1 | 42,2 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 в растворе составила 0,5 М. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,22 г/л) – 41,3%.
Таблица 3.37
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,7M (NH4)2CO3 + 0,58М NH4НCO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=50°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,10 | 0,15 | 0,19 | 0,20 | 0,20 |
| α(Со(III), % | 0,0 | 14,3 | 21,4 | 26,4 | 27,9 | 28,6 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,22 | 0,24 | 0,24 | 0,24 | 0,24 | 0,23 |
| α(Со(III), % | 31,4 | 34,0 | 34,5 | 34,5 | 34,5 | 33,3 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 в растворе составила 0,5 М. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,24 г/л) – 34,5%.
Таблица 3.38
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 0,7M (NH4)2CO3 + 0,55М NH4НCO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=75°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,14 | 0,20 | 0,24 | 0,26 | 0,27 |
| α(Со(III), % | 0,0 | 20,0 | 28,6 | 34,3 | 37,1 | 39,3 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,27 | 0,31 | 0,31 | 0,31 | 0,30 | 0,29 |
| α(Со(III), % | 39,3 | 44,4 | 44,3 | 44,9 | 42,9 | 41,2 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 и NH4НCO3 в растворе составила 0,4 М и 0,2 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,33 г/л) – 38,1%.
Таблица 3.39
Кинетика выщелачивания кобальта из алюминий-кобальтового кека смешанным раствором состава 1,2M (NH4)2CO3 + 0,9М NH4НCO3 в присутствии 0,18 М H2O2.
Условия выщелачивания: Т:Ж=1:50, t=75°C, скорость перемешивания пульпы – 1000 об/мин.
| № п.п. | 1 | 2 | 3 | 4 | 5 | 6 |
| τ, мин | 0 | 5 | 10 | 15 | 20 | 25 |
| С(Со(III), г/л | 0,00 | 0,11 | 0,19 | 0,30 | 0,35 | 0,36 |
| α(Со(III), % | 0,0 | 16,3 | 27,1 | 42,8 | 49,9 | 51,4 |
| № п.п. | 7 | 8 | 9 | 10 | 11 | 12 |
| τ, мин | 30 | 60 | 90 | 120 | 150 | 180 |
| С(Со(III), г/л | 0,34 | 0,34 | 0,33 | 0,31 | 0,31 | 0,30 |
| α(Со(III), % | 49,2 | 48,2 | 46,7 | 45,0 | 44,3 | 43,5 |
По данным потенциометрического титрования равновесного раствора в присутствии стеклянного электрода после 180 мин выщелачивания, концентрация (NH4)2CO3 и NH4НCO3 в растворе составила 1,1 М и 0,15 М соответственно. Вторичного осадкообразования в растворах не наблюдали. По результатам определения концентрации кобальта в растворе после 180 мин. выщелачивания методом гравиметрии (0,61г/л) – 75,2%.
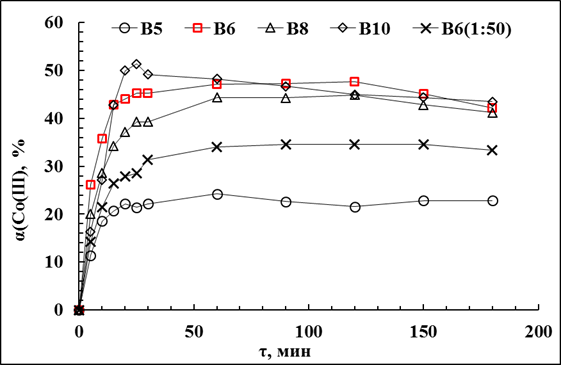
Рис.3.21. Кинетики выщелачивания кобальта из алюмо-кобальтового кека смешанным раствором (NH4)2CO3 + NH4НCO3 (В5 - Исх. р-р: 0,7М(NH4)2CO3+0,55МNH4HCO3.Равн.р-р:0,4М(NH4)2CO3 + 0,2М NH4HCO3. t=25°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М, В6 - Исх. р-р: 0,7М(NH4)2CO3+0,58МNH4HCO3. Равн. р-р: 0,5М(NH4)2CO3. t=50°C,Т:Ж=1:83, τ=3ч, С(H2O2)=0,18М, В8 - Исх. р-р: 0,7М(NH4)2CO3+0,55МNH4HCO3. Равн. р-р: 0,4М(NH4)2CO3+0,2МNH4HCO3. t=75°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М, В10 - Исх. р-р: 1,2М(NH4)2CO3+0,9МNH4HCO3. Равн. р-р: 1,1М(NH4)2CO3+МNH4HCO3. t=75°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М, В6(1:50) - Исх. р-р: 0,7М(NH4)2CO3+0,58МNH4HCO3. Равн. р-р: 0,5М(NH4)2CO3. t=50°C,Т:Ж=1:50, τ=3ч, С(H2O2)=0,18М).
При различном соотношении Т:Ж наибольшая степень извлечения кобальта из раствора наблюдалась при Т:Ж равном 1:50 и составила 52,5%. При соотношении 1:25 степень извлечения Со(III) была немного меньше - 51,2%. При дальнейшем увеличении Т:Ж степень извлечения падала, как видно из табл 3.37. Слева степени извлечения полученные спектрофотрическим методом, справа степени извлечения полученные с помощью гравиметрии.
Таблица 3.37
Влияние соотношения Т:Ж на степень извлечения кобальта.
| Исх. р-р: 1,2М(NH4)2CO3+0,9МNH4HCO3. Равн. р-р: 1,1М(NH4)2CO3+0,15МNH4HCO3. t=75°C, τ=60 мин, С(H2O2)=0,18М | Гравиметрия | ||||
| № п.п. | Т:Ж | С(Со(III), г/л | α(Со(III), % | С(Со(III), г/л | α(Со(III), % |
| 1 | 1:50 | 0,35 | 49,9 | 0,36 | 52,5 |
| 2 | 1:25 | 0,43 | 30,8 | 0,72 | 51,2 |
| 3 | 1:10 | 1,06 | 30,3 | 1,38 | 39,4 |
| 4 | 1:5 | 1,69 | 24,1 | 3,11 | 44,5 |
| 5 | 1:2,5 | 1,70 | 12,1 | 2,05 | 14,6 |
| 6 | 1:1 | 2,38 | 6,6 | 3,27 | 9,1 |
Исходя из полученных данных, был построен график зависимости степени извлечения кобальта из аммиачно-карбонатных растворов от соотношений Т:Ж. Как видно из графика, степень извлечения возрастает от 9% до 52,5%, если увеличить соотношение Т:Ж от 1:1 до 1:50.
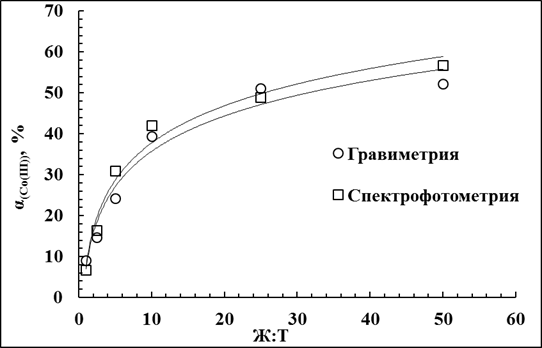
Рис.3.22.Зависимость степени извлечения кобальта из аммиачно-карбонатных растворов от соотношения Т:Ж.
Исходя из полученных данных таблицы 10 (приложение), был построен график (рис.3.23) зависимости степени извлечения кобальта из алюминий-кобальтого кека от температуры в зависимости от системы, в растворе которой проводилось выщелачивание. Видно, что степень извлечения возрастает при увеличении температуры, как в системе (NH4)2CO3, так и в системе (NH4)2CO3+NH4ОН.
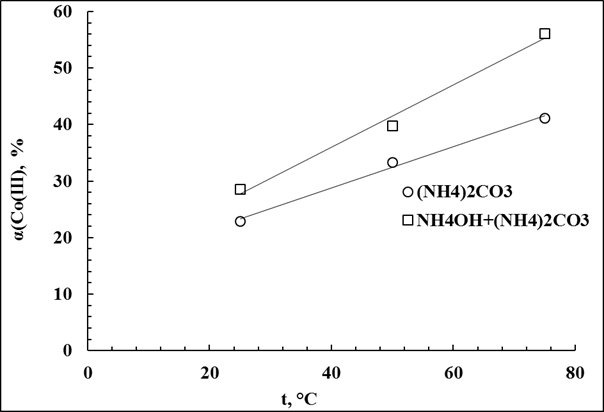
Рис.3.23 Зависимость степени извлечения кобальта от температуры для разных систем выщелачивания.
Проведенные исследования по выщелачиванию кобальта из алюминий-кобальтового остатка (кека) полученного при выщелачивании молибдена водными растворами Na2CO3 из обожженного АКМ катализатора, водными растворами NH4OH и смешанными растворами (NH4)2CO3+NH4OH, позволяют сделать следующие основные выводы:
Выводы:
1) Изучено выщелачивание кобальта из алюминий-кобальтового остатка водными растворами NH4OH. Показано, что равновесие в системе при выщелачивании 5,8 М раствором NH4OH в присутствии 0,01 М H2O2 при Т:Ж=1:6, t=20±2°С устанавливается за 300 мин., при этом αСо за 2 ступени выщелачивания составило 30,5%.
2) Изучено выщелачивание кобальта из алюминий-кобальтового остатка смешанными водными растворами NH4OH+(NH4)2CO3. Показано, что равновесие в системе при выщелачивании раствором 1,15 М NH4OH+0,8 M (NH4)2CO3 H2O2 при Т:Ж=1:5, t=25°C устанавливается за 480 мин., при этом αСо за ступень составила 21,2%. К увеличению αСо приводит повышение концентрации NH4OH в составе смеси NH4OH+(NH4)2CO3 и температуры процесса. Установлено, что при увеличении концентрации аммиака в составе смешанного раствора с 0,58 М до 1,15 М, величина αСо за одну ступень увеличивается с 13% до 21,7%. Суммарная величина степень αСо за 4 ступени при выщелачивании смешанным раствором 1,15 М NH4OH+0,8 М (NH4)2CO3 при барботаже воздуха (10 л/ч) и Т:Ж=1:5, t=20±2°С составила 58%. Установлено, что при увеличении температуры процесса c 25°C до 50°C, величина αСо за одну ступень увеличивалась с 13% до 27,6% при выщелачивании раствором 1,15 М NH4OH+0,8 M (NH4)2CO3 в присутствии 0,05 М H2O2 и Т:Ж=1:5.
Дата: 2019-04-23, просмотров: 418.