Рассмотрим концепцию так называемой деформационной электронной плотности. Эта функция d r помогает в концентрированном виде представить, как изменилось электронное распределение при образовании молекулы из атомов:
d r (r)=r мол(r) - å r атом (r), (3.12)
å r атом часто называют промолекулой r пром (атомы в å r атом расположены там же, где и ядра в реальной молекуле). Если промолекула есть совокупность атомов со сферически усредненными ЭП, то d r называется стандартной деформационной электронной плотностью (рис. 3.7,б). Хотя молекулы и кристаллы образуются именно из атомов, единственного определения промолекулы не существует. Можно выбрать промолекулу в виде совокупности атомов в тех или иных валентных состояниях, например, направить занятые одним электроном s -орбитали атомов вдоль межъядерных векторов, а ЭП на p -, d - и т. д. орбиталях усреднить.
Следует иметь в виду, что, независимо от определения, промолекулу нельзя описать детерминантом из атомных волновых функций, для нее также несправедливы теоремы вириала и Гельмана-Фейнмана (см. ниже), а также принцип Паули и т. д.
Чтобы лучше понять, какая информация содержится в деформационной ЭП в каждом случае, проанализируем ЭП отдельных атомов. В промолекуле атом должен в принципе находиться в низшем энергетическом (основном) состоянии. При этом нужно иметь ввиду, что волновая функция свободного атома может быть пространственно невырожденной (атомы H, Li, N и др.) или n-кратно пространственно вырожденной, если пренебречь спин-орбитальным взаимодействием (атомы B, С, O, F, где n=3 и др.). Когда вырождение существует, ЭП атома в основном состоянии теряет сферическую симметрию. Например, соответствующие атомы второго ряда таблицы Менделеева имеют в этом случае частично заполненную электронами р-подоболочку и в итоге они приобретают квадрупольную деформацию ЭП. Однако экспериментально определить, какие именно р- орбитали в этих атомах заняты электронами, невозможно, поэтому состояния атомов с пространственным вырождением следует описывать как смесь чистых основных состояний с одинаковой энергией, но с различным размещением электронов на вырожденных орбиталях. ЭП таких атомов следует рассматривать как статистическое среднее ЭП чистых состояний, причем заселенности орбиталей в “усредненном” атоме зависят от температуры и могут быть нецелочисленными.
По мере сближения атомов друг с другом их электронная структура перестраивается. Уже на очень больших расстояниях дальнодействующее влияние каждого из соседних атомов приводит к снятию вырождения и атом ориентируется в поле соседей таким образом, что парциальные электростатические силы, действующие на его ядро, оказываются направленными в сторону атомов, создающих поле. К такому же эффекту приводят электростатическое взаимодействие “жестких” атомов, а также поляризационное и дисперсионное взаимодействия, которые можно рассчитать по теории возмущений. Последние два эффекта вызывают также гибридизацию орбиталей и промотирование атома в некоторое валентное состояние. После того, как атомы сблизятся на расстояние менее 7А, начинают проявляться квантовомеханические эффекты: интерференция волновых функций, делокализация ЭП и обмен. Таким образом атом “готовится” к образованию химической связи.
Промолекула из сферических атомов и соответствующая ей стандартная деформационная ЭП применяются наиболее часто. Причина этого состоит в том, что при этом снимается вопрос выбора той или иной ориентации несферических атомов, нетривиальный в сложных гетеродесмических системах. Важно также, что классическая электростатическая энергия взаимодействия сферических атомов (кроме атомов Н) отрицательна; таким образом, силы, действующие на ядра в промолекуле, связывающие и промолекула всегда стабильна относительно атомов, удаленных на бесконечность. Стандартная деформационная ЭП дает полное (внутри- и межатомное) перераспределение электронов. В то же время, строя деформационные ЭП с промолекулой из атомов в различных валентных состояниях, можно выявить детали взаимодействия подготовленных атомов.
Чтобы унифицировать методику построения таких деформационных ЭП и распространить ее на случай атомов в высших и нестандартных валентных состояниях, было предложено рассчитывать промолекулу из несферических атомных ЭП, адаптированных к симметрии окружения. Разность между полной ЭП и ЭП промолекулы, рассчитанной по полученным параметрам, называется химической деформационной ЭП. Эта функция характеризует межатомные взаимодействия и лишь в минимальной степени зависит от внутриатомных взаимодействий.
Карты стандартных и химических деформационных ЭП для ординарных, двойных и тройных ковалентных, а также ролярных (ионных) связей в молекулах, состоящих из легких атомов приведены на рис. 3.8 – 3.11. Они вычислены с использованием расширенных базисных наборов, включающих поляризационные функции, и имеют погрешность не выше 0.05 эÅ-3. Можно видеть, что из-за перестройки электронных оболочек при образовании химической связи “подготовленных” атомов В и С вдоль оси межъядерного вектора ЭП оказывается выше, чем в сферически усредненном атоме, а в направлении, перпендикулярном этой оси, ниже. У подготовленных атомов О и F наблюдается обратная картина. В итоге, величины положительных максимумов и отрицательных минимумов в областях s - и p -связей на стандартных картах деформационной ЭП оказываются зависящими от соотношения величин эффектов перекрывания атомных (сферических) электронных облаков и квантовомеханических эффектов интерференции волновых функций, электронной делокализации и обмена. При более чем наполовину заполненных оболочках взаимодействующих атомов отталкивание электронов вследствие эффекта Паули приводит к уменьшению ЭП в межъядерном пространстве по мере увеличения числа валентных электронов. Одновременно вследствие конструктивной интерференции происходит лишь небольшая по величине концентрация электронов в этой области. Поэтому результирующее перераспределение ЭП вдоль межъядерного вектора может оказаться меньше, чем сумма сферических атомных ЭП. Так, величина положительной деформационной ЭП между ядрами уменьшается в ряду N2—02—F2, становясь в последнем случае даже отрицательной, причем все эти молекулы стабильны.
Малая и даже отрицательная плотность d r наблюдалась на стандартных картах деформационной ЭП на связях N—N производных гидразида, на связях О—О в перекиси водорода, С—F в тетрафтортерефталодинитриле, О¾ О, N¾ N, С—О, С—N в тетраазотетраоксатрициклотетрадекане, связах М—М (М=Сr, Мn, Мо) в биядерных комплексах и др.
Важное влияние на характер распределения ЭП оказывают также узлы волновых функций. По мере увеличения числа узлов у s -орбиталей требование ортогональности перекрывающихся волновых функций в совокупности с принципом Паули снижает величину s -плотности электронов. В то же время возрастает роль ЭП, связанной с p -, d - и т. д. орбиталями, создающими стабилизирующее электрическое поле на ядрах. Из-за этого ковалентная связь с участием атомов С, N, О, F более прочна, чем с участием атомов Si, P, S, C1. По этой же причине в полиядерных комплексах переходных металлов наиболее богатая деталями картин ЭП проявляется в стороне от линии связи металл-металл.
Можно заключить анализ карт деформационной ЭП следующими выводами. Электроны обычно концентрируются там, где в молекуле имеет место конструктивная интерференция АО. В районе занятых электронами разрыхляющих МО и близ узловых поверхностей МО ЭП уменьшается по сравнению с суперпозицией атомов. На хорошо локализованных несвязывающих МО, например, МО, описывающих неподеленные электронные пары, и в некоторых областях разрыхляющих МО, полностью занятых электронами, ЭП также возрастает. При взаимодействии атомов разного сорта ЭП смещается к более электроотрицательному атому, что отвечает случаю полярной ковалентной связи.
Топологическая теория
Иной подход к анализу химической связи дает топологическая теория молекулярной и кристаллической структуры, разработанная Бейдером. Этот подход, в отличие от концепции деформационной ЭП и ее разновидностей, имеет существенное преимущество: получаемые результаты не зависят от используемой модели промолекулы.
Положения топологической теории, существенные для рассматриваемых вопросов, следующие. Структура многоэлектронной системы при ядерной конфигурации R полностью определяется набором и сортами критических точек ЭП r (r,R), точек rc, где градиент ЭП Ñ r (r,R) равен нулю. Вторые производные ЭП, вычисленные в этих точках, составляют действительную симметричную матрицу размером 3´ 3 (гессиан). Главные компоненты кривизны ЭП в точке rc (собственные значения гессиана l i) определяют ранг р и признак q критической точки {p,q}; ранг есть число ненулевых собственных значений, признак-алгебраическая сумма их знаков. Возможны всего четыре невырожденные критические точки ЭП: (3, -3), (3, -1), (3, 1), (3, 3).
Критические точки (3, -3) отвечают локальным максимумам ЭП, которые совпадают с положениями ядер. Интегральные кривые r(s)=ro+ ò Ñ r [r(t),R]dt (градиентные траектории) составляют набор решений дифференциального уравнения dr(s)/ds=ò Ñ r [r(t),R] при начальном условии r(0)= r0. Все траектории, которые заканчиваются на некотором ядре, определяют область пространства химической системы, которая называется бассейном этого ядра. Совокупность ядра и ЭП в пределах его бассейна определяет атом в химической системе. Последняя оказывается разделенной на бассейны, каждый из которых содержит только одно ядро. Каждая пара смежных бассейнов разделяется межатомной поверхностью S(r), поток вектора Ñ r через которую равен нулю:
Ñ ρ(r) ∙ n(r) = 0, "r 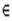 S(r). (3.13)
S(r). (3.13)
Здесь n(r)-единичный вектор, нормальный к поверхности в точке r. Благодаря условию (3.13), любая межатомная поверхность образуется градиентными траекториями, которые заканчиваются в критической точке связи (3, -1), лежащей на этой же поверхности. Ее положение обозначается rb. Собственный вектор гессиана, отвечающий положительной кривизне в точке rb, задает исходные направления двух градиентных траекторий, которые заканчиваются в двух соседних ядрах. Они определяют линию связи: вдоль этой линии ЭП максимальна по отношению к любым малым боковым смещениям. Существование линии связи является необходимым и достаточным условием образования связи между атомами.
Собственные векторы, отвечающие двум положительным собственным значениям гессиана, вычисленным в критической точке (3,1), генерируют поверхность, на которой ЭП минимальна именно в этой точке. Такая ситуация реализуется в циклических молекулах, поэтому точка (3,1) называется циклической критической точкой. Точка (3,3) соответствует локальному минимуму ЭП: собственные векторы, отвечающие трем его положительным собственным значениям, порождают бесконечное число градиентных траекторий, заключенных в области пространства, ограниченной несколькими циклами; это имеет место в клеточных молекулах.
Плоская циклическая молекула S2N2 (рис. 3.12) является примером системы, в которой реализуются все типы критических точек, кроме точки (3,3). Критические точки связи лежат на линиях S-N, которые таким образом являются связанными, однако на линиях S-S и N-N таких точек нет. В центре цикла ЭП минимальна, здесь находится критическая точка (3,1) и это единственное место, где соприкасаются бассейны пары атомов S и пары атомов N, химическая связь между которыми отсутствует. На рис. 3.12 хорошо видно, что у атома с большей электроотрицательностью расстояние от ядра до критической точки (3, -1) вдоль линии связи больше. Таким образом, размер бассейна и электроотрицательность атома коррелируют. Установлено, что значение ЭП в критической точке (3, -1) коррелирует с длиной линии связи L (которая в общем случае не совпадает с длиной межъядерного вектора) и с порядком связи по Льюису п. Эти зависимости имеют вид:
r(rb)=aL+b,
n=exp{A[ρ(rb)–B ]} (3.14)
(величины коэффициентов а, в, А и В зависят от базиса, в котором рассчитана ЭП и от сорта связанных атомов) и для связей углерод-углерод приведены на рис. 3.13 и 3.14.
ЭП s - и p -орбиталей пространственно не разделяются и критические точки (3, -1) наблюдаются как на простых, так и на кратных связях. Однако форма распределения ЭП в поперечном сечении для этих связей различается; соответственно различается здесь и кривизна ЭП в разных направлениях. Для оценки ассимметрии распределения ЭП в этой плоскости, проявляющейся на картах d r в виде удлинения избыточного пика, в топологической теории используется параметр эллиптичности:
ε = λ1/λ2 – 1, | λ1|>| λ2|. (3.15)
ЭП быстрее уменьшается вдоль направления наибольшей кривизны. Если пренебречь взаимным влиянием связей и межмолекулярным взаимодействием, то можно ожидать для ординарных связей l 1=l 2 и e =0. Если для кратных связей e отлично от нуля, то этот параметр дает оценку p -характера связи. Например, в молекуле S2N2 e (S-N) =0,572 (расчет в базисе 6-21G*). Однако наличие двух указанных факторов приводит к e >0 для формально ординарных связей, например для связи С-О в молекуле a -щавелевой кислоты, в которой существенны эффекты сопряжения, и связи С-С в кристалле этана, где проявляется воздействие ближайших соседей. Таким образом, адекватная интерпретация причин ненулевой эллиптичности связи требует учета многих обстоятельств.
Ценную химическую информацию содержит лапласиан ЭП Ñ 2r . Если ЭП в данной точке превышает среднее значение ЭП в соседних точках, то Ñ 2r <0; в противном случае Ñ 2r >0. Разница между локальным значением и средним в ближайшей окрестности максимальна в критических точках ЭП. Таким образом, электроны концентрируются в регионах, где Ñ 2r <0 и деконцентрируется там, где Ñ 2r >0. Как видно из рис. 3.12, г, отрицательные значения Ñ 2r проявляются в межъядерном пространстве вдоль линии ковалентной связи S-N, где наличествует малая положительная кривизна ЭП вдоль этой линии и большая отрицательная кривизна в других направлениях, а также в области неподеленных электронных пар атомов N.
Лапласиан ЭП прямо связан с локальными вкладами в электронную энергию молекулы и кристалла плотностей кинетической g(r) и потенциальной v(r) энергий:
(ħ2/4m)Ñ 2ρ(r) = 2G(r) +V(r). (3.16)
Поскольку g>0, a v<0, то в областях, где происходит концентрация электронов, плотность потенциальной энергии выше.
Важной характеристикой является значение лапласиана ЭП в критической точке связи. Оно определяется соотношением между отрицательными и положительными собственными значениями гессиана l 1, l 2 и l 3, и, таким образом, зависит от характера химической связи. Эта характеристика позволяет естественным образом разделить все атомные взаимодействия на два класса, в зависимости от распределения ЭП между ядрами. Если для ЭП здесь характерно доминирование отрицательной кривизны, то это означает, что ЭП концентрируется вокруг критической точки (3-1) и взаимодействие атомов можно отнести к ковалентному типу. Потенциальная энергия электронов в области, окружающей точку rb, по меньшей мере, в два раза будет превосходить кинетическую энергию. Если же положительная кривизна ЭП доминирует в точке rb, то ЭП оказывается смещенной к каждому из взаимодействующих атомов и сконцентрированной в атомных бассейнах. Это отражает действие принципа Паули. Такие атомные взаимодействия считаются взаимодействиями ионного типа. В области, окружающей критическую точку связи, доминирует кинетическая энергия, а области, где доминирует потенциальная энергия, оказываются пространственно-разделенными. Конечно, приведенное разделение носит очень грубый характер, а названия взаимодействий не отражают реального многообразия их проявлений. Тем не менее, как видно из табл. 3.3 и 3.4, где приведены расчетные данные, это разделение охватывает большинство разновидностей химических связей.
Таблица 3.3. Характеристики атомных взаимодействий в терминах локальных свойств электронной плотности
Таблица 3.4. Топологические и энергетические характеристики ковалентных связей в терминах локальных свойств электронной и энергетической плотности
Введем понятие плотности локальной электронной энергии:
Не(r) = G(r) + V(r) (3.17)
Знак Не однозначно показывает, что кинетическая или потенциальная энергия доминирует в той или иной точке пространства. Если в межъядерной области доминирует V(r), то это свидетельствует, что аккумуляция электронов здесь является стабилизирующей. В противном случае распределение ЭП в межъядерной области дестабилизирует систему. Таким образом, локальная энергия электронов Не служит важной характеристикой связывания в многоэлектронных системах.
Эмпирический материал, собранный в табл. 3.3 и 3.4, позволил сформулировать признаки наличия ковалентной химической связи между парой атомов. Связь образуется, если:
1) между атомами существует критическая точка (3, -1) (необходимое условие);
2) плотность локальной электронной энергии Не в этой точке отрицательна (достаточное условие).
Дать аналогичные определения ионной, водородной и ван-дер-ваальсовой связям, отделяя их друг от друга, не удается. Для этих связей характерны положительные значения плотности локальной электронной энергии в критической точке связи, поэтому в рамках топологического анализа их приходится объединять под общим названием взаимодействий ионного типа.
Дата: 2019-02-19, просмотров: 623.