Простейший способ описания химической связи в координационных соединениях дает теория кристаллического поля (ТКП). В ее рамках электронное строение комплекса объясняется в терминах возмущения АО центрального атома электростатическим полем лигандов. Это возмущение полагается малым и приводит лишь к расщеплению энергетических уровней d- или f-элемента. Распределение валентных электронов по расщепленным энергетическим уровням центрального атома определяется его сортом, величиной отталкивания этих электронов от лигандов, считающихся отрицательными точечными зарядами, взаимодействием электронов между собой. Таким образом, электронная конфигурация центрального атома a рассматривается явно, тогда как лиганды – феноменологически. Возмущение описывается оператором возмущения
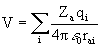 (3.41)
(3.41)
где rai – расстояние от ядра центрального атома а до лиганда i.
Для координационных соединений ионов, имеющих в d-оболочке один электрон (Ti3+, V4+) характер расщепления уровней можно установить, не проводя точных расчетов. Все АО свободного иона энергетически равноценны, они сохраняют свою эквивалентность и в гипотетическом сферически-симметричном поле лигандов (в этом поле их общий уровень лишь поднят в силу взаимодействия с отрицательно заряженными лигандами над уровнем в свободном ионе на некоторую величину e ). В октаэдрическом поле лигандов радиальные части полной волновой функции всех d-AO одинаковы, однако по угловым характеристикам они делятся на две неравноценные группы. К одной из них, трижды вырожденной и обозначаемой t2g, принадлежат dxy-, dxz- и dyz-AO. Если единственный d-электрон рассматриваемого центрального иона остается в комплексе на одной из этих орбиталей, он оказывается более удаленным от расположенных по координатным осям одноименно заряженных лигандов, чем в том случае, если бы d1-электрон занимал дважды вырожденные еg-орбитали (dx2-y2 и dz2).
Расщепление t2g и еg -уровней рассматривается как некоторый эмпирический параметр и обозначается D или 10Dq:
E(eg) – E(t2g)=10Dq. (3.42)
Принимая за нуль отсчета энергию пятикратно вырожденного энергетического уровня d-электронов в сферически-симметричном поле лигандов e, можно оценить относительную стабилизацию электронов на t2g и дестабилизацию на еg -уровнях в единицах Dq.
Если все три t2g и два еg-уровня d-электронов центрального иона заселены электронами, сохраняется сферическое распределение электронной плотности центрального иона и выполняется соотношение, известное как теорема центра тяжести:
4E(eg)+6E(t2g)=10ε0. (3.43)
Коэффициенты в левой части этого уравнения соответствуют количеству электронов, которые можно разместить на t2g - и еg -уровнях.
Вводя для энергии стабилизации и дестабилизации обозначения
x= ε 0 – E(t2g) и y=E(eg) – ε 0 , (3.44)
получаем:
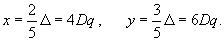 (3.45)
(3.45)
При тетраэдрической координации центрального иона также происходит расщепление уровней d-орбиталей, однако при этом положение электрона на e-орбиталях оказывается более выгодным, чем на t-орбиталях. Это можно наглядно объяснить тем, что в тетраэдре лиганды находятся на диагоналях вписанного в сферу куба, а в октаэдре - на его гранях:
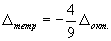 (3.46)
(3.46)
Представленный качественный подход, основанный на рассмотрении взаимодействий электрона на отдельных d-орбиталях с зарядами лигандов, позволяет получить картину расщепления уровней в полях другой симметрии (рис. 11.4). Относительные значения расщеплений отдельных уровней можно получить лишь при количественном расчете.
В табл. 3.10 даны представления симметрии d-орбиталей для точечных групп симметрии, отвечающих наиболее важным конфигурациям координационного узла комплексов.
Таблица 3.10 Представления симметрии для d-орбиталей при различных случаях симметрии
| координационное число | конфигурация | точечная симметрия | АО и их симметрийные обозначения | ||||
| dz2 | dx2-y2 | dxy | dxz | dyz | |||
| 4 | Тетраэдр | Td | е | е | t2 | t2 | t2 |
| 4 | Квадрат | D4h | a1g | b1g | b2g | e | e |
| 5 | Квадратная пирамида | С4V | a1 | b1 | b2 | е | е |
| 5 | Тригональная бипирамида | D3h | a1 | е' | е' | е" | е" |
| 6 | Октаэдр | Oh | eg | eg | t2g | t2g | t2g |
Спектрохимический ряд
Важно получить представление о порядке величин А= 10Dq. Эти значения могут быть взяты из экспериментальных данных о спектрах поглощения октаэдрически координированных ионов, обладающих одним электроном в d-оболочке (терм основного состояния 2D). Большой экспериментальный материал по электронным спектрам поглощения комплексов и оценочные расчеты позволили сформулировать ряд правил о зависимости величины 10Dq от типа центрального иона и лиганда. Наиболее важное из них правило спектрохимического ряда:
Величина 10Dq возрастает слева направо в следующем ряду наиболее характерных лигандов, причем указанный порядок не меняется для различных центральных ионов:
I- < Br - < SCN - < Cl - < NO3- < F - < OH - < H2O < NCS -<
< CH3CN < NH3 < Py < En < NO2- < CN - < CO , (3.47)
где Ру - пиридин; En - этилендиамин.
Отметим еще два достаточно общих положения.
1) При одинаковом лигандном окружении наибольшая величина 10Dq соответствует комплексам центральных ионов с наибольшими зарядами. Например, 10Dq для [Со(Н2О)6]3+ равна ~20 000 см -1, а для [Со(Н2О)6]2+ ~9700 см -1.
2) Величина 10Dq для комплексов ионов переходных металлов, принадлежащих к разным периодам периодической системы, но имеющих одинаковую электронную оболочку, примерно постоянна при однотипном лигандном окружении.
Дата: 2019-02-19, просмотров: 371.