Существует возможность количественно оценить клады различных АО в МО. Как уже отмечалось, используя разложение МО по линейным комбинациям АО j i= å сim c m (2.12), удобно ввести матрицу плотности (матрицу зарядов-порядков связей) P c элементами Рmn = å j сjm сjn (суммирование ведется по занятым МО). Энергия молекулы с закрытыми оболочками записывается с помощью этой матрицы весьма компактно:
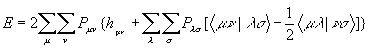 (3.5)
(3.5)
Матрица плотности описывает распределение электронной плотности по молекуле следующим образом (закрытые оболочки):
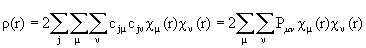 (3.6)
(3.6)
Перепишем последнее выражение таким образом, чтобы выделить вклады АО атомов I и J,
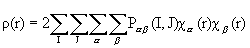 ,
,  a Î I , b Î J (3.7)
a Î I , b Î J (3.7)
и проинтегрирум левую и правую части (3.7). Учитывая, что АО нормированы, имеем:
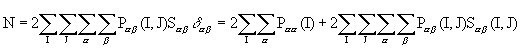 (3.8)
(3.8)
(интеграл перекрывания Sab(I,J)=1, если a=b , I=J). Таким образом, полное число электронов молекулы N в приближении МО ЛКАО оказывается формально распределенным по атомам и связям между ними. Величина Рaa(I) есть электронная заселенность орбитали a , центрированной на атоме I, а 2Рab(I,J)Sab(I,J) –электронная заселенность перекрывания орбиталей a и b , центрированных на атомах I и J.
Малликен предложил оценивать электронные заселенности атомов, деля заселенности перекрывания орбиталей между рассматриваемой парой атомов поровну.
Тогда полное число электронов, приписывемое атому I, равно
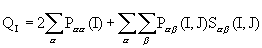 , I<J, a < b (3.9)
, I<J, a < b (3.9)
Полный заряд на атоме qI (эффективный заряд) вычисляется как разность
qI= ZI - QI , (3.10)
где ZI – заряд ядра атома I.
Ясно, что описанный метод анализа электронных заселенностей орбиталей дает лишь приближенную оценку распределения заряда по молекуле: получаемые величины зависят от используемых при расчете метода и базиса, а деление электронов между атомами без учета их природы неправомочно. Кроме того, в ортогональном базисе все электроны оказываются формально распределенными только между атомами. Тем не менее, анализ заселенностей орбиталей по Малликену проводится при выдаче результатов расчета по всем современным квантовохимическим программам.
Величины 2Рab , следуя Коулсону, называют орбитальными зарядами, а 2Рab -
порядками связей: отсюда и происходит название матрицы Р. Знак 2Рab определяет конструктивная или деструктивная интерференция имеет место при взаимодействии данной пары АО. Полный порядок связи между атомами находят как сумму вкладов от перекрывания соответствующих АО.
Используя матрицу зарядов-порядков связей, легко вычислить дипольный момент молекулы:
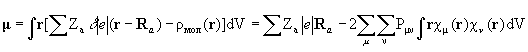 (3.11)
(3.11)
Дипольный момент нейтральной молекулы не зависит от выбора начала отсчета.
Дипольные моменты молекул определяются измерением комплексной диэлектрической проницаемости как функции частоты и температуры, из ИК спектров и с помощью других методов. Сравнивая результаты расчета и измерений, можно оценить надежность проведенного исследования.
Дата: 2019-02-19, просмотров: 415.