Критерием самопроизвольного протекания химических процессов является изменение свободной энергии Гиббса (ΔG < О). Изменение энергии Гиббса ОВР связано с разностью окислительно-восстановительных (электродных) потенциалов участников окислительно-восстановительного процесса Е:
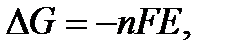
где F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе;Е – разность окислительно-восстано-вительных потенциалов или электродвижущая сила ОВР (ЭДС гальванического элемента, образованного двумя окислительно-восстановительными системами):
Е = j0 – jВ,
где j0 – потенциал окислителя, jВ – потенциал восстановителя.
Учитывая вышеизложенное: ОВР протекает в прямом направлении, если ее ЭДС положительна, т.е. Е>О; в противном случае (Е<О) ОВР будет протекать в обратном направлении.
ЭДС, вычисленная для стандартных условий, называется стандартной и обозначается Е 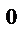 .
.
Пример 1: Определите, возможно ли протекание реакции в прямом направлении при стандартных условиях: 
2Fe3+ + 2 I 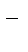 D 2Fe2+ + I2.
D 2Fe2+ + I2.
При протекании реакции в прямом направлении окислителем будут являться ионы Fe3+, восстановителем – иодид-ионы (I̶). Рассчитаем стандартную ЭДС:
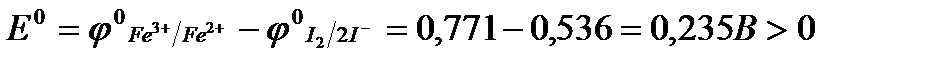 .
.
Ответ: протекание данной реакции возможно только в прямом направлении.
Пример 2. Определите направление протекания реакции при стандартных условиях:
2KCI + 2MnCI2 + 5CI2 + 8H2O D 2KMnO4 + 16HCI.
Предположим, что реакция протекает в прямом направлении, тогда
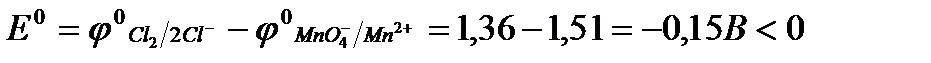 .
.
Протекание реакции в прямом направлении невозможно. Она будет протекать справа налево, в этом случае:
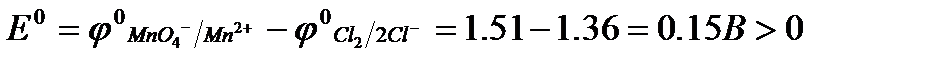 .
.
Ответ: данная реакция протекает справа налево.
Таким образом, реакция будет протекать в направлении, в котором ЭДС положительна. Всегда системы с более высоким окислительно-восстановительным потенциалом будут окислять системы с более низким его значением.
Электрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами.
Электрохимические процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Электрохимическая система состоит из двух электродов и ионного проводника между ними (расплав, раствор электролита или твёрдые электролиты – проводники 2-го рода). Электродами называют проводники первого рода, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Для обеспечения работы электрохимической системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы.
10.1. Гальванические элементы (химические источникиэлектрического тока)
Гальванический элемент (ГЭ) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока.
| Рис. 10.1. Схема гальванического элемента Даниэля-Якоби |
| Zn2++ SO42- |
| Cu2+ + SO42- |
| Cu |
| Zn |
| && |
| еˉ |
| еˉ |

|
| SO42- |
В нём проводником соединяются пластинки из цинка и меди, при этом каждый из металлов опущен в раствор соответствующей соли: сульфатацинка и сульфата меди (II). Полуэлементы соединены электролитическим ключом1, если находятся в разных сосудах или разделены пористой перегородкой, если находятся в одном сосуде.
Рассмотрим сначала состояние этого элемента при разомкнутой внешней цепи– режим «холостого хода». На электродах в результате процесса обмена устанавливаются следующие равновесия, которым в стандартных условиях соответствуют стандартные электродные потенциалы:
Zn2+ + 2ēDZn 
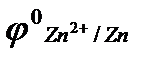 = -0,76В
= -0,76В
Cu2+ + 2ēDCu 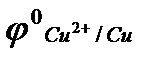 = +0,34В.
= +0,34В.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится влево, поэтому в раствор перейдёт дополнительное количество ионов цинка (растворение цинка на цинковом электроде).
В то же время равновесие на медном электроде сместится вправо и произойдёт разряд ионов меди (выделение меди на медном электроде). Данные самопроизвольные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или вся медь не осадится на медном электроде).
Итак, при работе элемента Даниэля–Якоби (при замыкании внутренней и внешней цепей ГЭ) протекают следующие процессы:
1) движение электронов во внешней цепи от цинкового электрода к медному, т.к. 
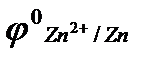 <
< 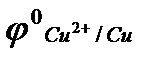 ;
;
2) реакция окисления цинка: Zn – 2ē= Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; следовательно, цинковый электрод – анод;
3) реакция восстановления ионов меди: Сu2+ + 2е = Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; следовательно, медный электрод – катод;
4) движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+,Zn2+) к катоду, замыкает электрическую цепь гальванического элемента.
Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода – катионы;
5) cуммируя электродные реакции, получаем:
Zn + Cu2+ = Cu + Zn2+
или в молекулярном виде: Zn + CuSO4 = Cu + ZnSO4.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Анод – источник электронов, поступающих во внешнюю цепь – принято считать отрицательным, катод – положительным. Анод помещается в схеме слева. Схема ГЭ Даниэля – Якоби, например, записывается в виде:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
или в ионно-молекулярном виде:
(-) Zn |Zn2+ ||Cu2+| Cu (+).
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность окислительно-восстановитель-ных потенциалов (электродных потенциалов1) частных реакций, определяющих электродвижущую силу Еэ гальванического элемента, и в рассматриваемом случае:
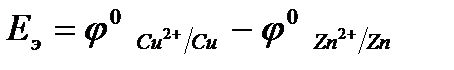 .
.
В общем случае: Еэ = jк - jа,
где jк – потенциал катода, jа – потенциал анода.
Еэ всегда больше нуля (Еэ> О). Если реакция осуществляется в стандартных условиях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой 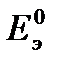 данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС
данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС 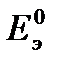 = 0,34 – (-0,76) = 1,1(В).
= 0,34 – (-0,76) = 1,1(В).
Пример.
Составьте схему, напишите уравнения электродных процессов и токообразующей реакции для гальванического элемента, образованного висмутом и железом, опущенных в растворы собственных солей с концентрацией ионов металлов в растворе CBi3+ = 0,1 моль/л, CFe2+ = 0,01 моль/л. Рассчитайте ЭДС этого элемента при 298К.
Решение.
Концентрации ионов металлов в растворе отличны от концентрации 1 моль/л, поэтому нужно рассчитать потенциалы металлов по уравнению Нернста, сравнить их и определить анод и катод.
jмеn+/ме = jомеn+/ме + 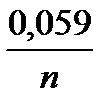 lgСмеn+;
lgСмеn+;
jBi3+/Bi = 0,21 + 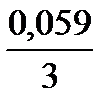 lg10-1 = 0,19В; jFе2+/Fе = -0,44 +
lg10-1 = 0,19В; jFе2+/Fе = -0,44 + 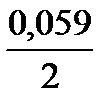 lg10-2 = - 0,499В.
lg10-2 = - 0,499В.
Принимая во внимание, что jBi3+/Bi>jFе2+/Fе, в данном ГЭ железный электрод играет роль анода, а висмутовый – катода. СхемаГЭ:
(-)Fe |Fe(NO3)2||Bi(NO3)3|Bi(+)или
(-) Fe|Fe2+||Bi3+ |Bi (+).
Уравнения электродных процессов и токообразующей реакции:
А: Fe - 2 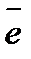 = Fe2+ 3
= Fe2+ 3
К: Bi3+ + 3 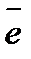 = Bi 2
= Bi 2
3 Fe + 2Bi3+ = 3Fe2+ + 2 Bi
ЭДС данного элемента Еэ = 0,19 – (-0,499) = 0,689 В.
В ряде случаев металл электрода не претерпевает изменений в ходе электродного процесса, а участвует лишь в передаче электронов от восстановленной формы вещества к его окисленной форме. Так, в гальваническом элементе
Pt |Fe2+, Fe3+|| MnO 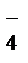 , Mn2+, H+| Pt
, Mn2+, H+| Pt
роль инертных электродов играет платина.
На платиновом аноде окисляется железо (II):
Fe2+ - е-= Fe3+, 
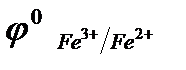
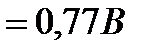 ,
,
а на платиновом катоде восстанавливается MnO 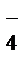 :
:
MnO4- + 8H+ + 5ē= Mn2+ + 4H2O, 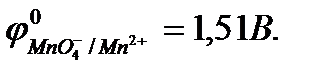
Уравнение токообразующей реакции:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
Стандартная ЭДС Е 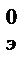 =1,51-0,77=0,74 В.
=1,51-0,77=0,74 В.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Например:
(-) Ag |Ag+||Ag+|Ag (+)
CAg 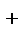 <CAg
<CAg 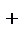
Электродные реакции:
A: Ag – eˉ = Ag+;
K: Ag+ + eˉ = Ag.
Уравнение токообразующей реакции:
Ag + Ag+ = Ag+ + Ag.
Свинцовый аккумулятор
Готовый к употреблению свинцовый аккумулятор состоит из решётчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие – металлическим губчатым свинцом. Пластины погружены в 35 – 40 % раствор H2SO4; при этой концентрации удельная электропроводность раствора серной кислоты максимальна.
При работе аккумулятора (при его разряде) в нём протекает ОВР, в ходе которой свинец (Pb) окисляется, а диоксид свинца восстанавливается:
(-) Рb|H2SO4| РbО2 (+)
А: Рb + SO 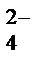 –2еˉ = РbSO4
–2еˉ = РbSO4 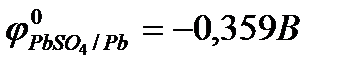
К: РbО2 + SO 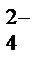 + 4Н+ + 2еˉ = PbSO4 + 2H2O
+ 4Н+ + 2еˉ = PbSO4 + 2H2O 
Pb + PbO2 + 4H+ + 2SO42- = 2PbSO4+ 2H2O – токообразующаяреакция
ЕЭ = 2,1 В.
Во внутренней цепи (в растворе Н2SO4) при работе аккумулятора происходит перенос ионов: ионы SO42-движутся к аноду, а катионы Н+– к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода – катионы. В итоге раствор остаётся электронейтральным.
Для зарядки аккумулятор подключают к внешнему источнику постоянного тока (“+” к “+”, “–“ к “–“). При этом ток протекает через аккумулятор направлении, обратном тому, в котором он проходил при разряде аккумулятора; в электрохимической системе осуществляется электролиз (см. р. 10.2).
В результате этого электрохимические процессы на электродах «обращаются». На свинцовом электроде теперь происходит процесс восстановления (электрод становится катодом):
PbSO4 + 2eˉ = Pb + SO42-.
На электроде из PbO2 при заряде идёт процесс окисления (электрод становится анодом):
PbSO4 + 2H2O - 2eˉ = PbO2 + 4H+ + SO42-.
Суммарноеуравнение:
2PbSO4 + 2H2O = Pb + PbO2 + 4H+ + 2SO42-.
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора: при заряде аккумулятора в нём вновь получаются вещества, необходимые для его работы.
Электролиз
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах в растворе или расплаве электролита под действием постоянного электрического тока, подаваемого от внешнего источника.
При электролизе происходит превращение электрической энергии в химическую.
Прибор, в котором проводят электролиз, называют электролизером. На отрицательном электроде электролизера (катоде) происходит процесс восстановления – присоединения окислителем электронов, поступающих из электрической цепи, а на положительном электроде (аноде) – процесс окисления – переход электронов от восстановителя в электрическую цепь.
Таким образом, распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе процессы осуществляются за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию.
Для процеcсов электролиза DG > 0, т.е. при стандартных условиях они самопроизвольно не протекают.
| Рис. 10.2. Схема электролиза расплава хлорида натрия |
| Электроны |
| Na+ Cl- |
| + |
| – |
| + - +Анод -Катод |
Рассмотрим электролиз расплава хлорида натрия (рис. 10.2). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и одного вида анионов(Cl  ) и никаких других частиц, которые могут приниматьучастие впроцессе электролизе, нет.
) и никаких других частиц, которые могут приниматьучастие впроцессе электролизе, нет.
Процесс электролиза расплава NaCl протекает следующим образом. От внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Катионы Na+ под действием электрического поля движутся котрицательному электроду, взаимодействуя с приходящими по внешней цепи электронами. Этот электрод является катодом, и на нём идёт процесс восстановления катионов Na+. Анионы Cl  движутся к положительному электроду и, отдав электроны аноду, окисляются.
движутся к положительному электроду и, отдав электроны аноду, окисляются.
Процесс электролиза принято изображать схемой, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества.
Схема электролиза расплава хлорида натрия представляется следующим образом:
NaCl = Na+ +Cl 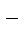
(-) Катод: Na+ Анод (+):Cl 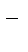
Na+ + ē= Na 2Cl 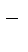 - 2eˉ = Cl2
- 2eˉ = Cl2
Суммарное уравнение:
2Na+ + 2Cl 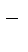 ЭЛЕКТРОЛИЗ2Na + Cl2
ЭЛЕКТРОЛИЗ2Na + Cl2
или в молекулярном виде
2NaClЭЛЕКТРОЛИЗ2Na + Cl2
Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, на катоде – процесс восстановления.
В процессах электролиза растворов электролитов могут участвовать молекулы воды и имеет место поляризация электродов.
Дата: 2019-02-19, просмотров: 402.