В процессах электролиза растворов электролитов могут участвовать молекулы воды, ионы Н+ и ОН 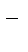 в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Катодные процессы.
1.1. На катоде в первую очередь идут процессы, характеризуемые наибольшим электродным потенциалом, т.е. в первую очередь восстанавливаются наиболее сильные окислители.
1.2. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (Cu2+, Ag+ , Hg2+, Au3+ и др. катионы малоактивных металлов – см. р.11.2), при электролизе практически полностью восстанавливаются на катоде:
Men+ + neˉ "Me.
1.3. Катионы металлов, потенциал которых значительно меньше, чем у водорода (стоящих в «Ряду напряжений» от Li+ до Al3+ включительно, т.е. катионы активных металлов), не восстанавливаются на катоде, так как на катоде восстанавливаются молекулы воды:
2Н2О + 2еˉ ® Н2 + 2ОН 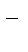 .
.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода:
2Н+ + 2еˉ " Н2.
1.4. Катионы металлов, имеющих стандартный электродный потенциал, меньше, чем у водорода, но больше чем у алюминия (стоящих в «Ряду напряжений» от Al3+ до 2Н+ - катионы металлов средней активности), при электролизе на катоде восстанавливаются одновременно с молекулами воды:
Меn+ + neˉ ®Me
2Н2О + 2еˉ ® Н2 + 2ОН 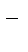 .
.
К данной группе относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и т.д.. При сравнении стандартных потенциалов этих ионов металлов и водорода можно было бы сделать вывод о невозможности выделения металлов на катоде. Однако следует учесть:
- стандартный потенциал водородного электрода относится к рН=0, т.е. ан+ 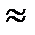 [Н+]
[Н+] 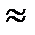 1 моль/л., с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее (
1 моль/л., с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее ( 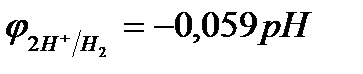 см. раздел 10.3);в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
см. раздел 10.3);в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
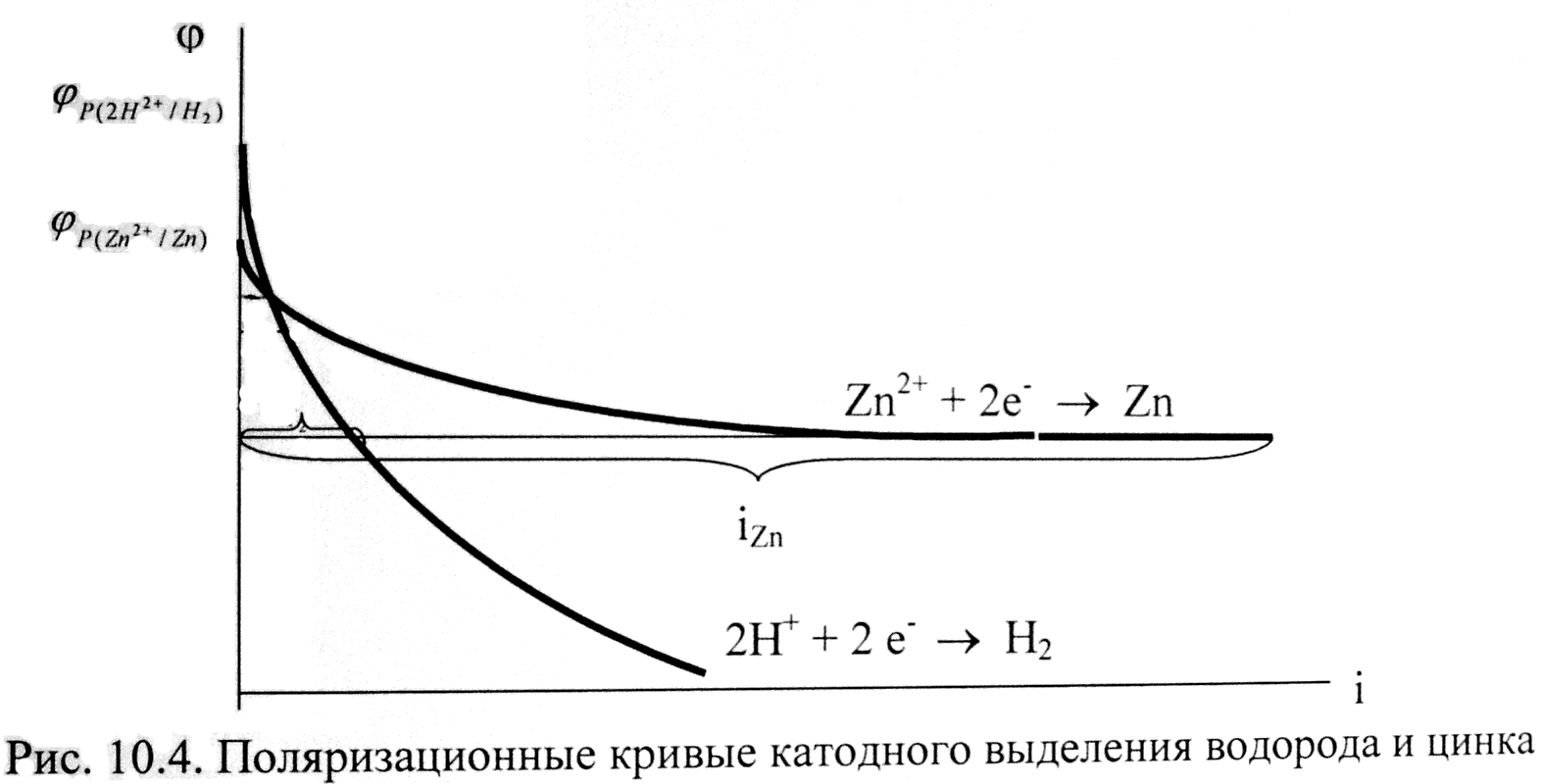
- поляризация процесса восстановления водорода больше поляризации разряда ионов металлов этой группы (или по-другому, выделение водорода на катоде происходит с более высоким перенапряжением по сравнению с перенапряжением разряда многих ионов металлов этой группы);пример: поляризационные кривые катодного выделения водорода и цинка (рис. 10.4).
| iH2 |
| φ1 |
| φ2 |
Как видно из данного рисунка, равновесный потенциал цинкового электрода меньше потенциала водородного электрода, при малых плотностях тока на катоде выделяется лишь водород. Но водородное перенапряжение электрода больше, чем перенапряжение цинкового электрода, поэтому при повышении плотности тока начинает выделяться на электроде и цинк. При потенциале φ1 плотности токов выделения водорода и цинка одинаковы, а при потенциале φ2
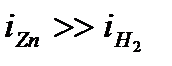 , т.е. на электроде выделяется в основном цинк.
, т.е. на электроде выделяется в основном цинк.
2. Анодные процессы.
2.1. На аноде в первую очередь идут процессы, характеризуемые наименьшим электродным потенциалом, т.е. в первую очередь окисляются сильные восстановители.
2.2. Обычно аноды подразделяют на инертные (нерастворимые) и активные (растворимые). Первые изготовляют из угля, графита, титана, платиновых металлов, имеющих значительный положительный электродный потенциал или покрытых устойчивой защитной плёнкой, служащих только проводниками электронов. Вторые – из металлов, ионы которых присутствуют в растворе электролита – из меди, цинка, серебра, никеля и др.
2.3. На инертном аноде при электролизе водных растворов щелочей, кислородосодержащих кислот и их солей, а также НF и ее солей (фторидов) происходит электрохимическое окисление гидроксид-ионов с выделением кислорода.
В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями:
а) в кислой и нейтральной среде
2 Н2О – 4еˉ = О2 + 4 Н+;
б) в щелочной среде
4ОН 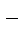 – 4еˉ = О2 + 2Н2О.
– 4еˉ = О2 + 2Н2О.
Потенциал окисления гидроксид-ионов (потенциал кислородного электрода) можно рассчитать по формуле (см. раздел 10.3):
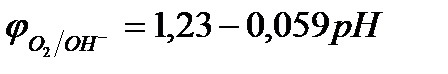 .
.
Кислородосодержащие анионы SO 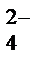 , SO
, SO 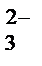 , NO
, NO 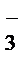 ,CO
,CO 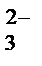 , PO
, PO 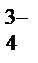 и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO
и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO 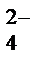 - 2eˉ = S2O
- 2eˉ = S2O 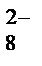
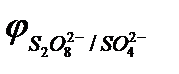 = 2,01 В.
= 2,01 В.
2.4. При электролизе водных растворов бескислородных кислот и их солей (кроме НF и ее солей) у инертного анода разряжаются их анионы.
Отметим, что выделение хлора (Cl2) при электролизе раствора НCl и её солей, выделение брома (Br2) при электролизе раствора HBr и её солей противоречит взаимному положению систем.
2Cl 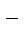 - 2eˉ = Cl2
- 2eˉ = Cl2 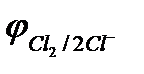 = 1,356 В
= 1,356 В
2Br 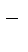 - 2eˉ = Br2
- 2eˉ = Br2 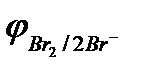 = 1,087 В
= 1,087 В
2H2O- 4eˉ = O2 + 4 Н+ 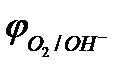 = 0,82 В (рН = 7)
= 0,82 В (рН = 7)
| φ1 |
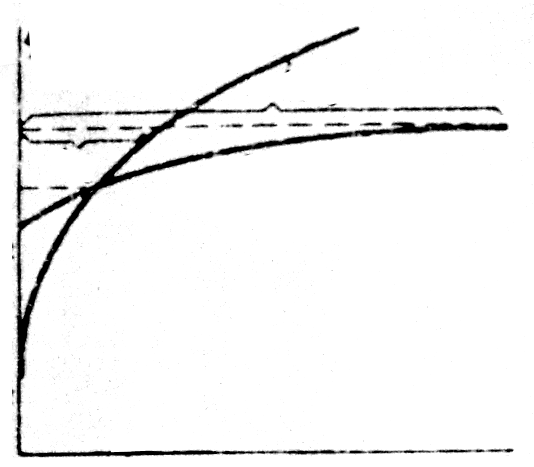
| Рис. 10.5. Поляризационные кривые анодного выделения кислорода и хлора |
| io2 |
| 4ОН--4еàО2+2Н2О |
| icl2 |
| φ |
| φ2 |
| φрСl2 |
| φрO2 |
| 2Cl--2eàCl2 |
Однако выделение кислорода протекает с более высокой поляризацией, чем выделение хлора, поэтому при потенциале 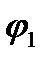 токи на выделение хлора и кислорода сравниваются, а при потенциале
токи на выделение хлора и кислорода сравниваются, а при потенциале 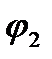 (высокая плотность тока) выделяется в основном хлор.
(высокая плотность тока) выделяется в основном хлор.
2.5. Если потенциал металлического анода меньше, чем потенциал ионов ОН  или других веществ, присутствующих в растворе или на электроде, то протекаетэлектролиз с активным анодом. Активный анод окисляется, растворяясь:
или других веществ, присутствующих в растворе или на электроде, то протекаетэлектролиз с активным анодом. Активный анод окисляется, растворяясь:
Ме – neˉ ®Men+.
Выход по току
Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (Bj), называется выходом по току этого вещества:
(Bj) % = (Qj/Q) . 100,
где: Qj – количество электричества, израсходованное на превращение j-го вещества; Q – общее количество электричества, прошедшее через электрод.
Например, из рис. 10.4 следует, что выход по току цинка растет с увеличением катодной поляризации. Для данного примера высокое водородное перенапряжение – явление положительное. Вследствие этого из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кобальт, никель и другие металлы.
Закон Фарадея
Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея:
масса электролита,подвергшаяся химическому превращению,а также масса веществ, выделившихся на электродах, прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
m = MэIt/F,
где:m – масса электролита, подвергшаяся химическому превращению,или масса веществ – продуктов электролиза, выделившихся на электродах, г; Mэ – молярная масса эквивалента вещества, г/моль; I – сила тока, А; t – продолжительность электролиза, с; F – число Фарадея – 96480 Кл/моль.
Пример 1.Как будет протекать электролиз водного раствора сульфата натрия с угольным (инертным) анодом? Составьте схему электролиза, записав уравнения электродных процессов и суммарное уравнение электролиза.
Решение.
Na2SO4 = 2Na+ + SO 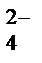
H2O D H+ + OH 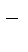
| (-) K | A (+) | |
| Na+, H2O (H+) | SO42-, H2O (OH 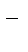 ) )
| |
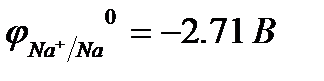
| 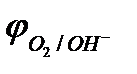 = 0,82B = 0,82B
| |
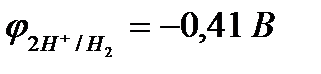
| 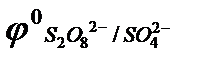 = 2,01B = 2,01B
| |
2| 2H2O + 2eˉ= H2 + 2OH 
| 2H2O – 4eˉ = O2 + 4H+ |
Суммарное уравнение:
6Н2О = 2Н2 + О2 + 4ОН  + 4Н+
+ 4Н+
или в молекулярной форме
6Н2О + 2Na2SO4 = 2Н2 + О2 + 4NaОН + 2Н2SO4.
В прикатодном пространстве накапливаются ионы Na+ и ионы ОН-, т.е. образуется щелочь, а около анода среда становится кислой за счёт образования серной кислоты. Если катодное и анодное пространство не разделены перегородкой, то ионы Н+ и ОН  образуют воду, и уравнение примет вид
образуют воду, и уравнение примет вид
2Н2О = 2Н2 + О2.
Итак, электролиз водного раствора сульфата натрия сводится к электролизу воды, а растворённая соль остаётся неизменной.
Пример 2. Как будет протекать электролиз водного раствора хлорида меди (II) CuCl2 с угольным анодом? Составьте схему электролиза, записав уравнения электродных процессов и суммарное уравнение электролиза.
Решение.
CuCl2 = Cu2+ + 2Cl 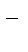
H2ODH+ + OH 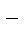 .
.
| (-) K | А (+) | |
| Cu2+, H2O (H+) | Cl 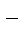 , H2O (ОH , H2O (ОH 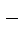 ) )
| |
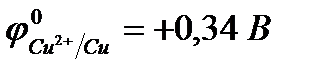
| 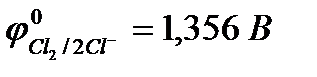
| |
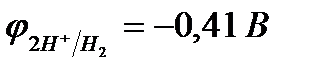
| 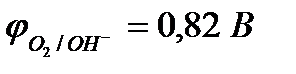
| |
| из-за анодной поляризации при высоких i протекает процесс: | ||
| Cu2+ + 2e– = Сu | 2Cl 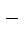 - 2e– = Сl2 - 2e– = Сl2
|
Суммарное уравнение:
Cu2+ + 2Cl 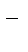 = Cu+ Cl2
= Cu+ Cl2
или в молекулярной форме:CuCl2=Cu+ Cl2.
Пример 3.Составьте схему электролизаводного раствора сульфата цинка с инертным анодом, записав уравнения электродных процессов и суммарное уравнение электролиза.
Решение.
ZnSO4 = Zn2+ + SO 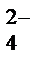
H2O D H+ + OH 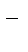
| (-) K | (+) A | |
| Zn2+, H2O (H+) | SO42-, H2O (OH-) | |
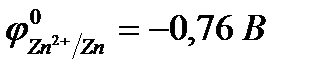
| 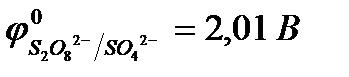
| |
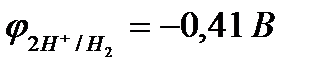
| 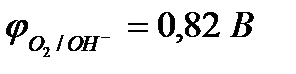
| |
| Из-за катодной поляризации протекают два процесса: | ||
| Zn2+ + 2e– = Zn | 2Н2О - 4е– = О2 + 4Н+ | |
2Н2О +2е– = Н2 + 2ОН 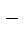
|
Суммарное уравнение реакции в данном примере написать нельзя, т.к. неизвестно, какая часть общего количества электричества идет на восстановление воды, а какая – на восстановление ионов цинка.
Пример 4.Составьте схему электролизаводного раствора сульфата меди (II) с активным анодом, записав уравнения электродных процессов и суммарное уравнение электролиза.
Решение.
CuSO4 = Cu2+ + SO 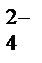
H2O D H+ + OH 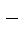
| (-) K | А (Cu) (+) | |
| Cu2+, H2O (H+) | SO 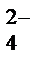 , H2O (ОH , H2O (ОH  ) )
| |
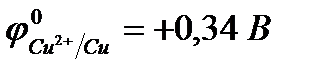
| 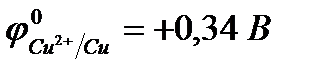
| |
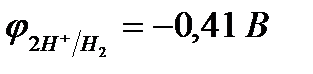
| 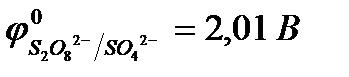
| |
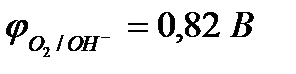
| ||
| Сu2+ + 2e– = Сu | Cu - 2e– = Сu2+ |
Ионы меди перемещаются от анода к катоду и восстанавливаются до чистой меди. Суммарное уравнение электролиза с растворимым анодом написать нельзя.
Концентрация CuSO4 в растворе при этом останется постоянной. Этот процесс применяется для электролитической очистки меди (электролитическое рафинирование).
Пример 5.Составьте схему электролизаводного раствора хлорида цинка с активным анодом, записав уравнения электродных процессов и суммарное уравнение электролиза.
Решение.
ZnCl2 = Zn2+ + 2Cl 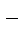
H2ODH+ +OH-
| (-) K | A (Zn) (+) | |
| Zn2+, H2O(H+) | Cl 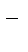 , H2O (OH , H2O (OH 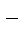 ) )
| |
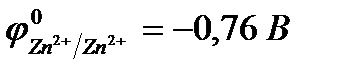
| 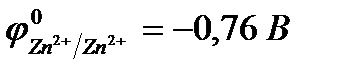
| |
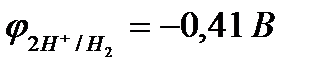
| 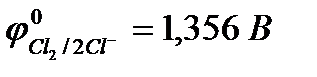
| |
| Из-за катодной поляризации | 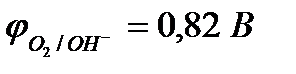
| |
| будут протекать два процесса: | ||
| Zn2+ + 2e– = Zn | Zn – 2e– =Zn2+ | 2 | |
2Н2О +2е–=Н2+ 2ОН 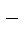
|
Пример 6. Определите массу цинка, которая выделится на катоде при электролизе раствора сульфата цинка в течение 1 часа при токе 26,8А, если выход цинка по току равен 50%.
Решение. В соответствии с законом Фарадея определим массу цинка, который выделился бы, если бы на катоде протекал один процесс:
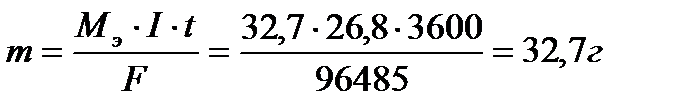
Выход цинка по току равен
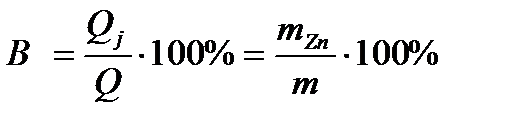
Отсюда масса выделившегося цинка составляет:
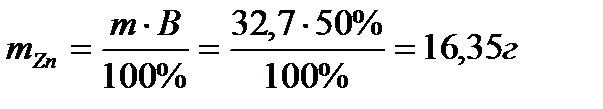
Применение электролиза
Практически нет ни одной отрасли техники, где бы он не применялся. В энергетике водород, полученный электролизом, используют для охлаждения генераторов на тепловых и атомных ЭС. Электролизом солей получают различные металлы: Cu, Zn, Cd, Ni, Mn и др. металлы. Электролиз используется для нанесения металлических покрытий на металлы и пластмассы (гальванические покрытия). Электролизом воды получают O2, H2, Cl2 и щёлочи из раствора хлорида натрия. Электролиз используют для зарядки аккумуляторов (см. раздел 10.2).
Коррозия металлов
Коррозия металлов – это процесс их самопроизвольного разрушения при взаимодействии с окружающей средой.
Ежегодно из-за коррозии теряются огромные количества металла. По ориентировочным данным от 5 до 30% получаемых чёрных металлов разрушается в результате коррозии. Однако во многих случаях косвенные убытки от коррозии могут значительно превышать прямые потери за счёт растворения металла. Это и выход из строя металлических конструкций, сложных приборов и аппаратуры, простой оборудования, утечки нефти и газа из прокорродировавших трубопроводов, сопровождаемые при этом нанесением природе невосполнимого экологического ущерба. Поэтому изучение причин, вызывающих коррозию, установление влияния различных факторов на скорость коррозии имеют своей практической целью защиту металлов и сплавов от коррозионного разрушения при их обработке и эксплуатации.
Механизм коррозии
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. В процессе химической коррозии происходит прямое гетерогенное взаимодействие металлов с окислителем окружающей среды, в результате которого между ними совершается обмен электронами, т.е. протекает обычная ОВР. Примером может служить окисление металлов кислородом воздуха при высоких температурах: Me + O2®MeO.
Электрохимическая коррозия возникает при контакте металлов с электролитами (во влажном воздухе, в почве, в растворах электролитов и т.п.) и является результатом протекания сопряжённых электродных процессов в образующихся короткозамкнутых гальванических элементах.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии двигаются внутри металла от анодных участков к катодным, т.е. образуются короткозамкнутые гальванические элементы, в которых анодные и катодные участки замкнуты накоротко через сам металл.
Отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходит анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими элементами (имеющими размеры, хорошо различимые невооружённым глазом) и микрогальваническими
| Рис. 10.6. Поверхность металла, на которой схематично изображено расположение коррозионных элементов. |
В первом приближении эту поверхность можно считать как двухэлектродную систему, т.е. состоящую из участков двух видов: анодных и катодных. Коррозионный элемент (короткозамкнутый гальванический элемент) схематично можно изобразить:
(–) А | коррозионная среда | К (+)
| Катодный участок (+) |
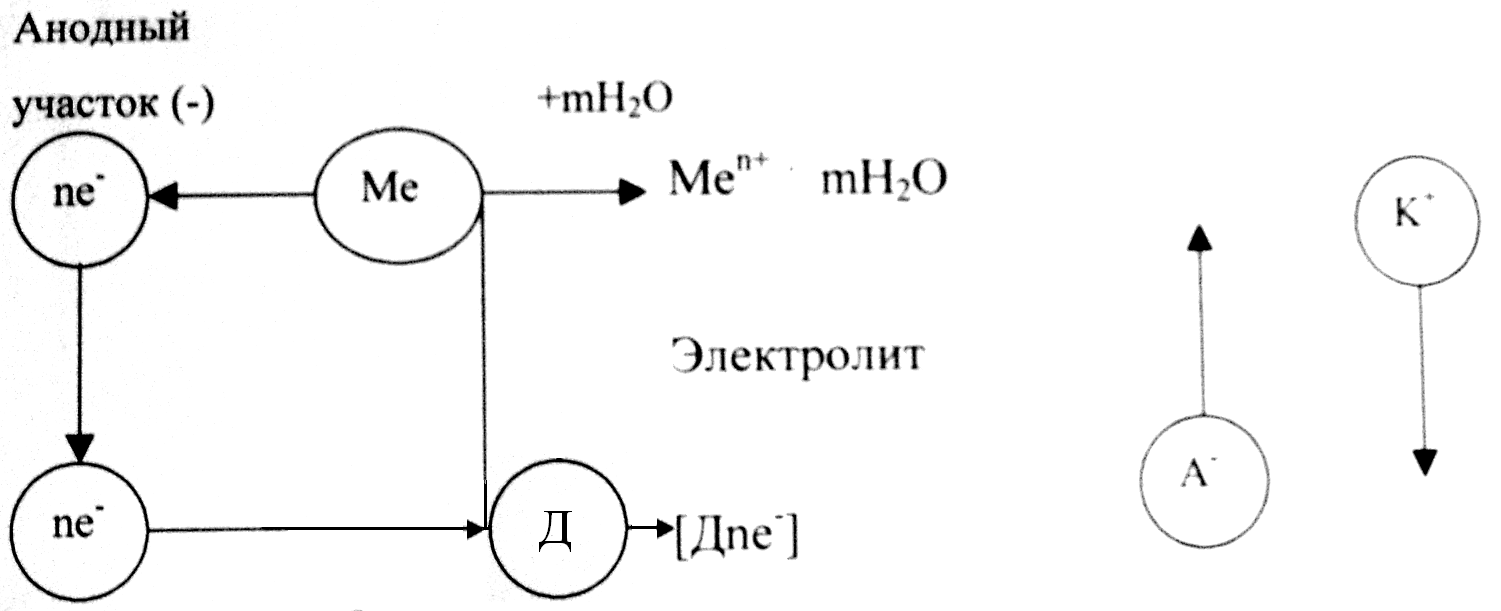
| Рис. 10.7. Схема электрохимического коррозионного процесса на поверхности металле |
1.Анодный процесс – окисление металла, образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
Me(кр) – neˉ ®Men+(p)
2. Процесс перетекания электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов и анионов в растворе.
3. Катодный процесс – приём электронов каким–либо окислителем окружающей коррозионной среды (какими – либо ионами или молекулами – деполяризаторами) на границе раздела фаз металл -коррозионная среда:
Ох + neˉ®Red или Д + neˉ ® [Дneˉ].
В коррозионных процессах окислитель часто называют деполяризатором1 (Д); [Дneˉ] – восстановленная форма окислителя.
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) поверхности металла аналогична работе короткозамкнутого гальванического элемента.
Наиболее распространёнными окислителями, деполяризаторами в коррозионном процессе являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
В наиболее простом виде электродные процессы для этого случая могут быть представлены уравнениями:
а) в кислых растворах (pH< 7)
А: Ме - neˉ ®Men+
K: 2Н+ + 2еˉ 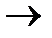 Н2
Н2  ;
;
б) в деаэрированных2 (удален растворенный кислород) нейтральных и щелочных растворах (рН 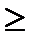 7)
7)
А: Ме - neˉ ®Men+
К: 2H2O + 2ē®H2 + 2OH 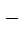 .
.
Потенциал восстановления ионов водорода (потенциал водородного электрода) зависит от парциального давления водорода и рН. При 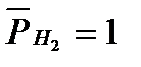 (101кПа) данный потенциал рассчитывается по уравнению:
(101кПа) данный потенциал рассчитывается по уравнению:
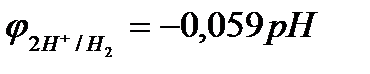 .
.
Например, при рН = 0 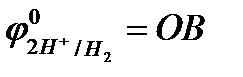 ;
;
рН = 7 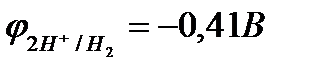 ;
;
рН = 14 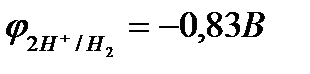 .
.
Коррозия с водородной деполяризацией возможна, если потенциал восстановления ионов водорода больше потенциала окисляемого металла, т.е. когда ЭДС образующегося короткозамкнутого гальванического элемента больше нуля: Еэ = jк - jа = jок-ль - jв-ль> О.
Скорость коррозии с водородной деполяризацией зависит от рН и температуры среды, природы металла.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией.
Электродные процессы в этом случае могут быть представлены уравнениями:
А: Ме - neˉ ®Men+
K: О2 + 2H2O + 4eˉ ® 4OH 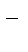 .
.
Необходимо отметить, что в обычных условиях во всех растворах есть растворённый кислород – О2. Потенциал восстановления кислорода (потенциал кислородного электрода) зависит от парциального давления кислорода и рН среды. При 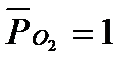 (101 кПа) данный потенциал рассчитывается по уравнению
(101 кПа) данный потенциал рассчитывается по уравнению
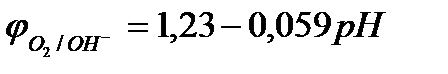 .
.
Например, при рН = 0 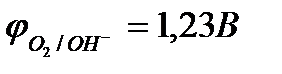 ;
;
рН = 7 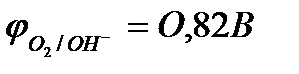 ;
;
рН = 14 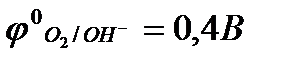 .
.
| Cu |
Данный вид коррозии имеет место в нейтральных, щелочных растворах, во влажном воздухе (О2+Н2О). Скорость коррозии в этом случае определяется скоростью диффузии кислорода и возрастает при перемешивании раствора и увеличении концентрации растворённого кислорода. В кислых растворах в обычных условиях также есть растворённый кислород, но скорость его восстановления в кислых средах мала по сравнению со скоростью восстановления ионов водорода. Поэтому коррозией с кислородной деполяризацией в кислых средах пренебрегают.
| Zn |
| Ag |
| Pt |
| 10.8 |
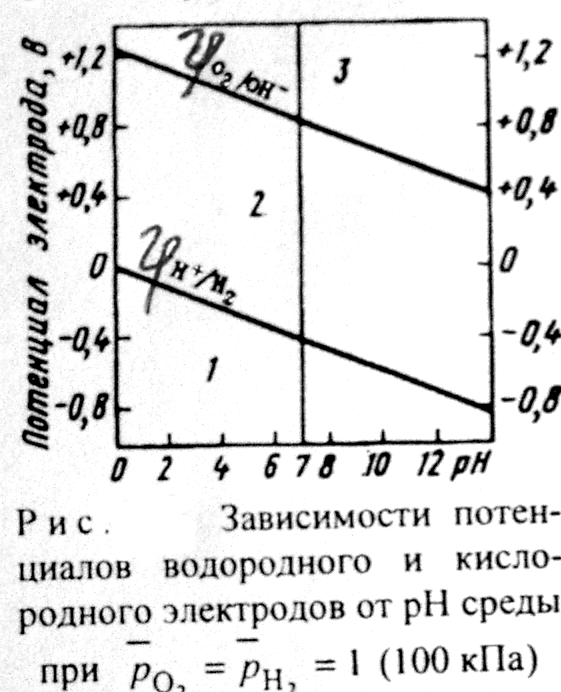
Если ЭДС коррозионного элемента Еэ> О, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ = jок-ль -jв-ль, то коррозия возможна при условии, что потенциал окислителя больше потенциала металла: 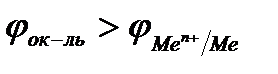 .
.
На данной диаграмме выделяются три области.
Область 1:если 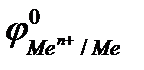 <
< 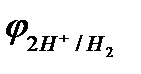 и
и 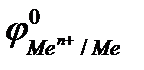 <
< 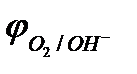 , то возможна коррозия металла с кислородной и водородной деполяризацией. К таким металлам относятся щелочные и щелочноземельные металлы, алюминий, цинк и др.
, то возможна коррозия металла с кислородной и водородной деполяризацией. К таким металлам относятся щелочные и щелочноземельные металлы, алюминий, цинк и др.
Область 2: если 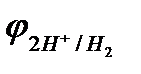 <
< 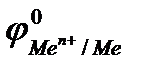 <
< 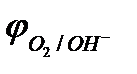 , то возможна коррозия металла с кислородной деполяризацией и невозможна с водородной деполяризацией. Потенциалы многих металлов лежат в области 2.
, то возможна коррозия металла с кислородной деполяризацией и невозможна с водородной деполяризацией. Потенциалы многих металлов лежат в области 2.
Область 3: если 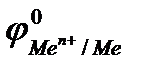 >
> 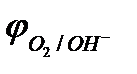 , то коррозия металла невозможна, исключая случаи наличия других деполяризаторов. Например, потенциалы золота, платины, в отсутствие условий для образования комплексов во всей области рН больше потенциала кислородного электрода, поэтому золото и платина не корродируют с поглощением О2 и выделением Н2.
, то коррозия металла невозможна, исключая случаи наличия других деполяризаторов. Например, потенциалы золота, платины, в отсутствие условий для образования комплексов во всей области рН больше потенциала кислородного электрода, поэтому золото и платина не корродируют с поглощением О2 и выделением Н2.
Катодами в коррозионных элементах, как правило, являются:
1. Включения металлов, имеющих больший электродный потенциал.
2. Токопроводящие неметаллические примеси (углерод, нитриды карбиды, оксиды). Например, чугун легко ржавеет во влажном воздухе из-за примеси углерода.
3. Хорошо окисленные участки металла при неодинаковой аэрации.Коррозия возможна при неодинаковом доступе воздуха (аэрации) к различным частям металла. Наиболее окисленный участок металла является электрохимически более пассивным (электродный потенциал такого участка больше электродного потенциала неокисленного металла). Возникновением короткозамкнутых гальванических элементов вследствие неодинакового доступа кислорода воздуха можно объяснить ржавление железа, сложенного в пачки, внутри пачек; по этой же причине наблюдается ржавление проволочных тросов изнутри, а не снаружи.
4. Недеформированные, необработанные механически участки металла.
При обточке, сверлении, штамповке и других видах механической обработки затраченная энергия частично превращается в тепловую, а частично идёт на увеличение поверхностной энергии обработанного участка (явление наклёпа). В результате обработанная часть детали по сравнению с необработанной обладает повышенным запасом энергии и большей химической активностью и поэтому служит анодом. В присутствии электролита деформированный участок разрушается, катодный процесс восстановления окислителя происходит на поверхности необработанной части детали.
Практическими примерами разрушения металла в результате неодинаковой механической обработки являются ржавление кровельного железа на крыше в местах стыка, где листы подвергались ударам и изгибу, коррозия металлических деталей в местах сверлений.
В реальных условиях в химической устойчивости механических конструкций большую роль играют свойства поверхностных оксидных слоёв, приводящих к пассивации металла.
Пассивность металлов
Пассивностью металла называют состояние повышенной коррозионной устойчивости, вызываемое торможением анодного процесса в результате образования на поверхности металла защитных плёнок. Продукт окисления (коррозии) создает на поверхности металла плёнку, которая в дальнейшем влияет на процесс коррозии.
Например, на поверхности алюминия образуется сплошная, хорошо сцепленная с металлом оксидная плёнка Al2O3, которая защищает его от дальнейшего окисления. Подобные защитные пленки имеются у хрома, цинка, титана и других металлов, что позволяет использовать их в качестве распространённых конструкционных материалов.
У других металлов, например у железа, в условиях контакта с воздухом и влагой образуется пористая, рыхлая, плохо сцепленная с металлом поверхностная плёнка ржавчины, не способная защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Ржавчина образуется в ходе превращений:
Fe(OH)2®Fe(OH)3®nFe2O3 + mFeO +qH2O.
Таким образом, ржавчина – сложные гидратированные оксиды железа. Однако железо можно запассивировать с помощью обработки его концентрированной азотной кислотой:
2Fe + 6HNO3 = Fe2O3 + 6NO2 + 3H2O.
хол. конц.
При этом образуется плотный, предотвращающий дальнейшее разрушение поверхностный оксидный слой. Защиту железа обеспечивает также тонкий плотный слой ортофосфата железа, нерастворимый в воде. Фосфатирование сталей и чугуна осуществляется в специальных растворах.
Рассмотрим примеры возникновения и работы короткозамкнутых гальванических элементов в результате контакта двух металлов.
Пример 1. Железо с медью находятся в контакте. Какой металл будет корродировать в растворе хлорида натрия?
Решение. На любом металле, находящемся в электролите, за счёт процессов обмена возникает электродный потенциал, величина которого отражает физико- химическую природу этого элемента и электролита. Чем активнее металл, тем отрицательнее его электродный потенциал. В большинстве случаев состав электролита и внешние условия отличаются от стандартных, поэтому возникающие потенциалы не будут стандартными. В данном случае нас интересуют лишь их относительные величины: какой из двух контактирующих металлов электроотрицательнее, какой – положительнее. Для получения ответа на этот вопрос можно пользоваться таблицей стандартных электродных потенциалов, помня, что потенциалы в этих случаях отличаются от стандартных:
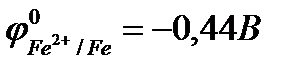 ;
; 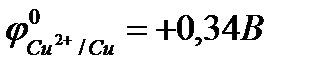 .
.
При контакте двух металлов, имеющих различные потенциалы, пойдёт локальный электрический ток – перемещение электронов от железа к меди (рис. 10.9).
Несмотря на ушедшие к медному электроду электроны, потенциал железного электрода восстановит свою первоначальную величину за счёт процесса окисления, т.е. железо будет разрушаться с переходом ионовFe2+ из металлической решетки в электролит. Электроны, поступившие к меди, казалось бы должны изменить имеющийся у меди потенциал, но этот потенциал будет поддерживаться, т.к. электроны,поступившие к меди, израсходуются в ходе процессавосстановления.
| раствор NaCl |
| Fe2+ |
| OH- |
| O2+H2O |
| Cu |
| e |
| Fe |
| e |
| Рис. 10.9. Схема электрохимической коррозии железа в водном растворе хлорида натрия |
В нейтральном водном растворе NaCl, контактирующем с воздухом, энергетически выгодным будет процесс восстановления кислорода, растворённого в воде.
Рис. 10.8 подтверждает термодинамическую возможность коррозии железа с кислородной деполяризацией: 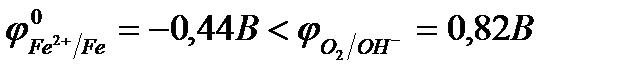 .
.
Решение:
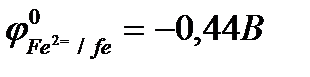 ;
; 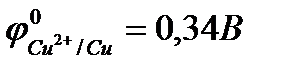
Схема коррозионного элемента для данного случая имеет вид:
(-) Fe | водный раствор NaCl | Cu (+)
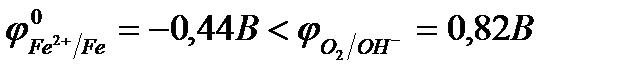 , термодинамически возможна коррозия железа с кислородной деполяризацией.
, термодинамически возможна коррозия железа с кислородной деполяризацией.
A: Fe – 2eˉ = Fe2+ 2
K: O2 + 2H2O + 4eˉ = 4OH- 1
2Fe + O2 + 2H2O = 2 Fe2+ + 4OH- = 2 Fe(OH)2$
Ответ: корродирует железо с кислородной деполяризацией; первичные продукты коррозии –Fe2+ и OH  ; вторичный продукт коррозии – Fe(OH)2.
; вторичный продукт коррозии – Fe(OH)2.
Образующийся гидроксид железа (II) подвергается дальнейшему окислению: 4Fe(OH)2  + O2 + 2H2O = 4 Fe(OH)3
+ O2 + 2H2O = 4 Fe(OH)3  .
.
Аналогичные электродные процессы будут протекать при коррозии железа во влажном воздухе.
Пример 2. Цинк с медью находятся в контакте. Какой металл будет корродировать в деаэрированном растворе хлорида натрия?
Решение.
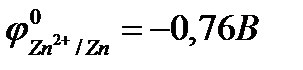 ;
; 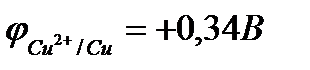
(-) Zn | деаэрированный раствор NaCl | Cu (+).
В растворе отсутствует окислитель О2, поэтому здесь можно ожидать коррозию цинка с водородной деполяризацией. Термодинамически этот процесс возможен (см. рис. 10.8), т.к. 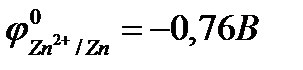 <
< 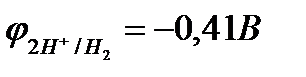 .
.
A: Zn – 2eˉ = Zn2+
K: 2H2O + 2eˉ = H2 + 2OH-
Zn + 2H2O = Zn2+ + H2 + 2OH- = H2 + Zn(OH)2¯.
Ответ: корродирует цинк с водородной деполяризацией. Первичные продукты коррозии – Н2, Zn2+ иOH 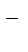 ; вторичный продукт коррозии – Zn(OH)2.
; вторичный продукт коррозии – Zn(OH)2.
Пример 3. Марганец содержит примесь меди. Какой металл будет корродировать в растворе хлороводородной кислоты (pH=2)?
Решение:
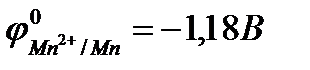 ;
; 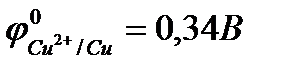
(-) Mn раствор HClCu(+)
pH=2
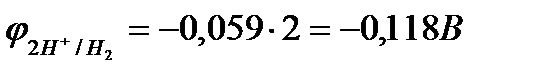 ; т.к.
; т.к. 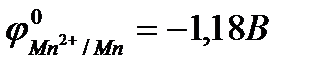 <
< 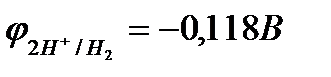 ,
,
то термодинамически возможна коррозия марганца с водородной деполяризацией (см. рис. 10.8).
A: Mn – 2eˉ = Mn2+
K: 2H+ + 2eˉ = H2
Mn + 2H+ = Mn2+ + H2или
Mn + 2HCl = MnCl2 + H2
Ответ: происходит коррозия марганца с водородной деполяризацией, продукты коррозии – Mn2+ и Н2.
Если в условии задачи концентрация кислоты (водородный показатель рН)неизвестна, то решение выполняется для рН=0.
Защита металлов от коррозии
Зная причину химической и электрохимической коррозии металлов, нетрудно выявить основные методы защиты. Так как причиной электрохимической коррозии является возникновение и работа гальванического элемента, то любое нарушение его функционирования будет предотвращать коррозию.
Все методы защиты условно делятся на следующие группы:
- легирование металлов;
- защитные покрытия (металлические, неметаллические);
- электрохимическая защита (протекторная, катодная);
- изменение свойств коррозионной среды;
- рациональное конструирование изделий.
Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
Легирование металлов
Легирование металлов – эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла, т.е. образование на его поверхности защитных плёнок из оксидов легирующих добавок. В качестве таких компонентов применяют хром, никель, вольфрам и т.д.
Защитные покрытия
Слои, искусственно создаваемые на поверхности металлов для предохранения их от коррозии, называются защитными покрытиями. Защитные слои подразделяются на металлические и неметаллические.
Наиболее распространены неметаллические защитные покрытия – эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность.
Ряд покрытий, получаемых химической обработкой металла, включают защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных плёнок в технике называют оксидированием. Некоторые процессы имеют специальное название. Так, процесс нанесения на сталь оксидных плёнок иногда называют воронением, а электрохимическое оксидирование алюминия – анодированием. Оксидные покрытия на стали можно получить при высокой температуре окислением на воздухе или погружением в горячие концентрационные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. В сухом воздухе оксидные плёнки достаточно стойки, а во влажном воздухе, воде защитные свойства их крайне невысоки.
Фосфатные покрытия, химически создаваемые на поверхности металлов, сами по себе не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Металлические покрытияполучают путем осаждения на защищаемой детали тонкого слоя другого металла, более стойкого в условиях эксплуатации, чем защищаемый металл. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
К катодным покрытиямотносятся покрытия из металлов, потенциалы которых в данной среде имеют большие значения, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag, Sn.
Рассмотрим пример катодного покрытия. Белая жесть – железо, покрытое слоем олова (Sn), находится во влажном воздухе (O2 + H2O). При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором защищаемый материал (Fe) служит анодом и растворятся, а материал покрытия (Sn) – катодом, т.к. 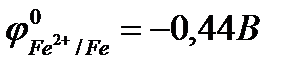 <
< 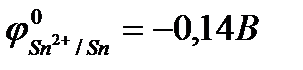 .
.
(-) Fe | O2, H2O | Sn (+)
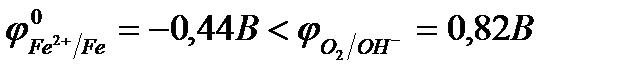 ,
,
следовательно, возможна коррозия железа с кислородной деполяризацией:
A: Fe – 2ē= Fe2+ 2
K: O2 + 2H2O + 4 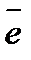 = 4OH- 1
= 4OH- 1
2Fe +O2 + 2H2O = 2Fe(OH)2  .
.
Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытияимеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали: 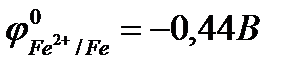 ;
; 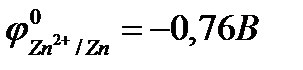 . В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
. В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
(-) Zn | H2O, O2 | Fe (+)
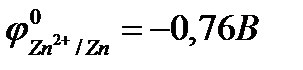 <jО2/ОН- = 0,82 В,
<jО2/ОН- = 0,82 В,
следовательно, возможна коррозия цинка с кислородной деполяризацией:
A: Zn – 2ē= Zn2+ окисление
K : O 2 + 2 H 2 O + 4 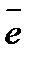 = 4 OH - восстановление
= 4 OH - восстановление
2Zn + O2 + 2H2O = 2Zn(OH)2.
Цинк будет защищать основной металл, пока весь не растворится. Таким образом,анодные покрытия более эффективны, т.к. защищают основные металлические конструкции и при нарушении целостности покрытия.
Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (электролиз – нанесение гальванических покрытий), погружение в расплавленный металл, металлизация (распыление расплавленного металла с помощью струи сжатого воздуха), термодиффузионный (путём диффузии металла в металл при повышенной температуре), химический (восстановление соединений металла с помощью водорода, гидразина и других восстановителей).
Электрохимическая защита
Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с меньшим значением электродного потенциала – протектора (протекторная защита) или катодной поляризацией за счёт извне приложенного тока (катодная защита).
Так, если к стальной конструкции присоединить кусок более активного металла, например магния ( 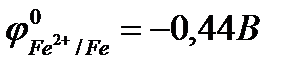 ;
; 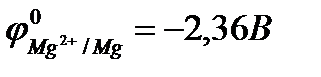 ), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
Сущность электрохимической катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. В этом случает в среде электролита будет протекать электролиз. Рассмотрим пример электрохимической катодной защиты подземного трубопровода во влажной почве (рис. 10.10).
| Рис. 10.10. Схема электрохимической катодной защиты подземного трубопровода |
| Fe |
| трубопровод |
| К(-) |
| влажная почва |
| (+) А – |
| + |
| - |
A: Fe – 2ē= Fe2+
K: 2H2O + 2e = Н 2+ 2OH 
Fe + 2H2O = Fe2+ + H2 + 2OH  = Fe(OH)2¯ + H2.
= Fe(OH)2¯ + H2.
Вспомогательный электрод (анод) растворяется, на защищаемом трубопроводе (катоде) выделяется водород.
Катодную защиту используют для защиты от коррозии подземных и морских трубопроводов, кабелей, водных резервуаров, подводных лодок, оборудования химических заводов.
Дата: 2019-02-19, просмотров: 525.