Электродные потенциалы, измеренные по отношению к стандартному водородному электроду при стандартных условиях (Т=298К; для растворённых веществ концентрация (активность) СRed= Сох= 1 моль/л или для металлов СМеn+ = 1 моль/л, а для газообразных веществ Р=101,3 кПа), называютстандартными электродными потенциалами и обозначают j0Оx/ Red. Это справочные величины.
Окислительная способность веществ тем выше, чем больше алгебраическая величина их стандартного электродного (окислительно-восстановительного) потенциала. Напротив, чем меньше величина стандартного электродного потенциала реагирующего вещества, тем сильнее выражены его восстановительные свойства.
Например, сравнение стандартных потенциалов систем:
F2(г.) + 2ēD2F̶(p.)j0 = 2,87 В
H2(r.)+ 2ēD2H̶(р.)j0 =̶2,25 В
показывает, что у молекул F2 сильно выражена окислительная тенденция, а у ионов H̶̶ – восстановительная.
Ряд напряжений металлов
Располагая металлы в ряд по мере возрастания алгебраической величины их стандартных электродных потенциалов, получают так называемый «Ряд стандартных электродных потенциалов» или «Ряд напряжений», или «Ряд активности металлов».
Положение металла в «Ряду стандартных электродных потенциалов» характеризует восстановительную способность атомов металла, а также окислительные свойства ионов металла в водных растворах при стандартных условиях. Чем меньше значение алгебраической величины стандартного электродного потенциала, тем большими восстановительными свойствами обладает данный металл в виде простого вещества, и тем слабее проявляют окислительные свойства его ионы и наоборот.
Например, литий (Li), имеющий самый низкий стандартный потенциал, относится к наиболее сильным восстановителям, а золото (Au), имеющее самое высокое значение стандартного потенциала, является очень слабым восстановителем и окисляется лишь при взаимодействии с очень сильными окислителями. Из данных «Ряда напряжений» видно, что ионы лития (Li+), калия (К+), кальция (Са2+) и т.д. – самые слабые окислители, а к наиболее сильным окислителям принадлежат ионы ртути (Нg2+), серебра (Аg+), палладия (Pd2+), платины (Pt2+), золота (Аu3+, Аu+).
Уравнение Нернста
Электродные потенциалы не являются неизменными. Они зависят от соотношения концентраций (активностей) окисленной и восстановленной форм вещества, от температуры, природы растворенного вещества и растворителя, рН среды и др.
Эта зависимость описывается уравнением Нернста:
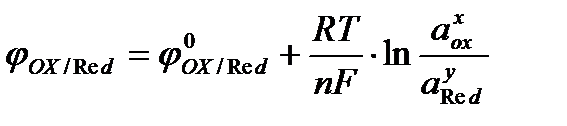 ,
,
где:j0Оx / Red – стандартный электродный потенциал процесса; R – универсальная газовая постоянная; T – абсолютная температура; n– число электронов, участвующих в электродном процессе; аох, аRed – активности (концентрации) окисленной и восстановленной форм вещества в электродной реакции; x и у – стехиометрические коэффициенты в уравнении электродной реакции; F – постоянная Фарадея.
Для случая, когда электроды металлические и устанавливающиеся на них равновесия описываются в общем виде:
Меn+ + nе-D Ме,
уравнение Нернста можно упростить, приняв во внимание, что для твердых веществ активность постоянна и равна единице. Для 298 К, после подстановки аМе=1 моль/л, x=y=1 и значений постоянных величин R=8,314 Дж/К∙моль; F = 96485 Кл /моль, заменяя активность аМеn+ на молярную концентрацию ионов металла в растворе СМеn+ и введя множитель 2,303 (переход к десятичным логарифмам), получим уравнение Нернста в виде
j Меn+ / Ме = j0 Меn+ / Ме + 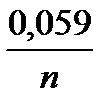 lgС Меn+.
lgС Меn+.
Дата: 2019-02-19, просмотров: 381.