Посемейными исследованиями установлено, что ген Di a передается по на-следству как доминантный признак (Cann и соавт. [23], Graninger [51], Lewis и соавт. [104], Race, Sanger [137], Levine, Robinson [98], Layrisse и соавт. [96]).
Протеин полосы 3, полученный из эритроцитов, подвергнутых обработке
660
проназой или химотрипсином, при электрофорезе в полиакриламидном геле (SDS-PAGE) оказался неоднородным (Mueller, Morrison [123]). В большинстве образцов присутствовали фракции с мол. массой 60 кДа, представляющие N-терминальный регион, и небольшое количество компонентов с мол. массой 63 кДа.
Один из вариантов протеина полосы 3, названный Мемфис, обуслов-лен точковой мутацией в паре нуклеотидов внутри экзона 4, которая приво-дит к замещению лизина на глютаминовую кислоту в цитоплазматическом N-терминальном домене белка полосы 3 (Yannoukakos и соавт. [176], Jarolim и соавт. [76]). У некоторых индивидов, гомозиготных по указанному мутантно-му гену, присутствовал только протеин с мол. массой 63 кДа (Ranney и соавт. [138], Ideguchi и соавт. [62]). Вариант Мемфис протеина полосы 3 был обна-ружен у 6–7 % произвольно взятых доноров. Его частота оказалась выше сре-ди американских негров (16 %), индейцев (17–25 %), китайцев (13 %), жителей Филиппин (17 %) и японцев (29 %) (Yannoukakos и соавт. [176], Jarolim и со-авт. [76]). Ингибиторы эритроцитарного транспортера анионов диизотиоцианат-стилбен (DIDS) и его дигидрат (H160mIDS) ковалентно связывались с лизином в позиции 539 белка полосы 3 (Tanner и соавт. [160]). У некоторых индивидов с Мемфис-вариантом белка полосы 3 отмечено повышенное связывание H160mIDS (Hsu, Morrison [60]). Такой тип белка полосы 3 был обозначен как Мемфис-вариант II для дифференцировки с Мемфис-вариантом I, которому свойствен нормальный уровень связывания H160mIDS.
Spring et al [157] указали на ассоциацию между фенотипами системы Diegо
и вариантами протеина полосы 3 при исследовании в SDS-PAGE. Они устано-вили, что наличие Мемфис-варианта II всегда было ассоциировано с наличием на эритроцитах антигена Di a. Белок полосы 3 таких эритроцитов связывал в 3 раза больше H160mIDS с радиоактивной меткой, а клетки Di(a −) проявляли нор-мальный уровень связывания H160mIDS. Таким образом, эпитопы Di a ассоцииро-ваны с протеином полосы 3 Мемфис-варианта II, а другие варианты этого белка (Мемфис-вариант I и обычный) – с антигенными эпитопами Di b.
Bruce и соавт. [16], проведя амплификацию кодирующего региона белка по-лосы 3 для выделения кДНК, сумели доказать, что экспрессия антигена Di a и Мемфис-варианта II ассоциированы с заменой С 2561 Т в экзоне 19: ген Di a коди-рует лейцин в позиции 854, а в присутствии Di b это положение занимает пролин. Кроме того, внутри гена Di a отсутствуют сайты рестрикции MspI и NaeI. В соот-ветствии с моделью, в которой трансмембранная часть протеина полосы 3 пред-ставлена 14 доменами, аминокислотные замены имеются в 7 экстрацеллюлярных петлях белка (рис. 12.2). Повышенное связывание H160mIDS происходит в связи
и локальными пространственными изменениями, влияющими на перекрестные связи между лизином в положении 851 на седьмой петле и той же аминокислотой в положении 539 в трансмембранном домене (Salhany и соавт. [150]).
При исследовании генотипа с помощью ПЦР у 72 бразильских индейцев племени Паракана из Амазонии выявлено 26 индивидов Di a / Di a, 26 – Di a / Di b
661
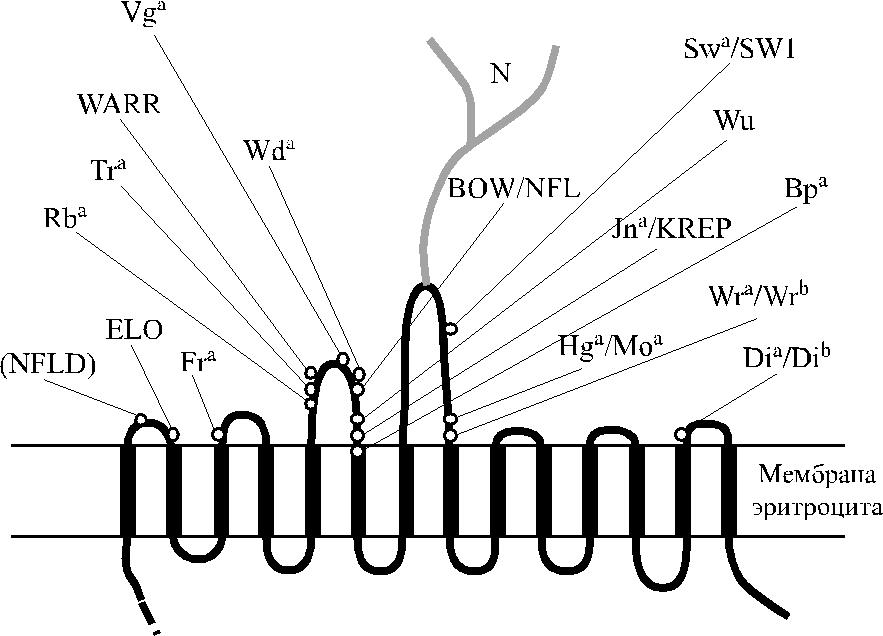
Рис. 12.2. Локализация антигенных эпитопов Diegо на эритроците и топология протеина полосы 3.
BBBB 19 – Di b / Di b. Таким образом, в этой этнической группе гены Di a и Di b име-ли частоту 0,56 и 0,44 соответственно (Castilho и соавт. [24]). Анализ вариан-тов Мемфис белка полосы 3 с рестрикцией MspI подтвердил корреляцию алле-лей Di a и Di b с кодонами Glu 56 и Lys 56 соответственно. Исключение состави-ли индивиды Di a / Di a, гетерозиготные по Glu 56 и Lys 56 кодонам.
Jarolim и соавт. [74] описали 2 европеоидов Di(a +b −), гетерозиготность кото-рых (Di a / Di b) подтверждалась молекулярно-генетическими тестами. У одного из них выявлена мутация, изменявшая рамку считывания, у другого – нонсенс-кодон внутри Di b.
Антигены Di a и Di b устойчивы к действию папаина, трипсина, α-химотрипсина, проназы, сиалидазы и сульфгидрильным редуцентам (Daniels [36]).
Иногда антиген Di b может быть слабо выражен. Описана мексиканская женщина, фенотип которой при первичном исследовании был определен как Di(a −b −). Однако последующие исследования выявили у нее слабый антиген Di b (Biro и соавт. [14]). Низкий уровень экспрессии антигена Di b у нескольких мексиканцев с фенотипом Di(a + ) описали Edwards-Moulds, Alperin [42]). При обследовании 784 жителей Америки испанского происхождения Issitt и соавт. [70] установили, что все они имеют антиген Di b, в 11 случаях последний был слабо выражен. Исследование этих образцов с сыворотками анти-Di a лишь в одном случае выявило этот антиген. Таким образом, феномен слабой экспрес-сии антигена Di b не был связан с эффектом дозы. Сниженная экспрессия анти-гена Di b имелась у лиц с овалоцитозом, встречающимся в Юго-Восточной Азии
(Kusnierz-Alejska, Bochenek [89]).
662
Протеин полосы 3
Белок полосы 3, отвечающий за транспорт анионов (АЕ1, или CD233), вхо-дит в структуру гликопротеинов эритроцитарной мембраны. Каждый эритро-цит содержит примерно 1,2 млн молекул этого белка, который легко выявля-ют электрофорезом в полиакриламидном геле после обработки субстрата до-децилсульфатом натрия (SDS-PAGE). Он мигрирует в область структур, име-ющих мол. массу 100 кДа (Bruce, Tanner [18], Tanner [158, 159]).
Ген SLC4A1, контролирующий синтез белка полосы 3, имеет величину 18 кб и включает 20 экзонов (Schofield и соавт. [151]). Клонирование и сек-венирование геномной ДНК белка полосы 3 подтвердило, что эта структу-ра состоит из 3 доменов. Цитоплазматический N-терминальный домен со-стоит из 403 аминокислот, гидрофобный трансмембранный домен представ-лен 479 аминокислотами, С-терминальный – 29 (см. рис. 12.2, 12.3) (Tanner
с соавт. [160], Lux и соавт. [112]). Терминальный N-домен взаимодействует с анкирином цитоскелетона. Трансмембранная часть белка полосы 3 в эритро-ците включает 14 доменов, экстрацеллюлярная часть представлена 7 петлями (см. рис. 12.2). Участок, связанный с олигосахаридами в области Asn 642 на четвертой экстрацеллюлярной петле, обладает серологической активностью в отношении антител анти-H, анти-A, анти-B, анти-I и анти-i. Количественные вариации протеина полосы 3 подсчитаны по числу повторяющихся N-ацетил-лактозаминовых группировок. Белок полосы 3 в мембране эритроцитов пред-ставлен олигомерами (ди-, три-, тетра- и т. д.) (Popov и соавт. [136], Fujinaga
с соавт. [46]). Тетрамеры преимущественно связаны с анкирином (Van Dort и
соавт. [167], Zafar, Reid [180]).
| MEELQDDYED MMEENLEQEE YEDPDIPESQ MEEPAAHDTE ATATDYHTTS | 50 | ||||
| HPGTHKVYVE LQELVMDEKN QELRWMEAAR WVQLEENLGE NGAWGRPHLS | 100 | ||||
| HLTFWSLLEL RRVFTKGTVL LDLQETSLAG VANQLLDRFI FEDQIRPQDR | 150 | ||||
| EELLRALLLK HSHAGELEAL GGVKPAVLTR SGDPSQPLLP QHSSLETQLF | 200 | ||||
| CEQGDGGTEG HSPSGILEKI PPDSEATLVL VGRADFLEQP VLGFVRLQEA | 250 | ||||
| AELEAVELPV PIRFLFVLLG PEAPHIDYTQ LGRAAATLMS ERVFRIDAYM | 300 | ||||
| AQSRGELLHS LEGFLDCSLV LPPTDAPSEQ ALLSLVPVQR ELLRRRYQSS | 350 | ||||
| PAKPDSSFYK GLDLNGGPDD PLQQYGQLFG GLVRDIRRRY PYYLSDITDA | 400 | ||||
| FSPQVLAAVI FIYFAALSPA ITFGGLLGEK TRNQMGVSEL LISTAVQGIL | 450 | ||||
| FALLGAQPLL VVGFSGPLLV FEEAFFSFCE TNGLEYIVGR VWIGFWLILL | 500 | ||||
| VVLVVAFEGS FLVRFISRYT QEIFSFLISL IFIYETFSKL IKIFQDHPLQ | 550 | ||||
| KTYNYNVLMV PKPQGPLPNT ALLSLVLMAG TFFFAMMLRK FKNSSYFPGK | 600 | ||||
| LRRVIGDFGV PISILIMVLV DFFIQDTYTQ KLSVPDGFKV SNSSARGWVI | 650 | ||||
| HPLGLRSEFP | IWMMFASALP | ALLVFILIFL | ESQITTLIVS | KPERKMVKGS | 700 |
| GFHLDLLLVV | MGGVAALFG | MPWLSATTVR | SVTHANALTV | MGKASTPGAA | 750 |
| AQIQEVKEQR ISGLLVAVLV GLSILMEPIL SRIPLAVLFG IFLYMGVTSL | 800 | ||||
| SGIQLFDRIL LLFKPPKYHP DVPYVKRVKT WRMHLFTGIQ IICLAVLWVV | 850 | ||||
| KSTPASLALP FVLILTVPLR RVLLPLIFRN VELQCLDADD AKATFDEEEG | 900 | ||||
| RDEYDEVAMP | V | 911 | |||
Рис. 12.3. Аминокислотная последовательность протеина полосы 3 эритроцитов человека.
663
Дата: 2019-02-24, просмотров: 346.