Антитела Lewis чаще выявляют методом солевой агглютинации на плоско-сти или в пробирках при комнатной температуре. В методиках, предусматрива-ющих инкубацию ингредиентов реакции при 37 оС, антитела Lewis обнаружи-вают с меньшей частотой, за исключением проб, в которые для усиления реак-ции добавляют полиэтиленгликоль, полибрен или 10 % желатин. В этой среде Lewis-антитела IgM и IgG проявляют одинаково высокую активность.
Сильные сыворотки анти-Le a находят редко, а обычно встречающиеся имеют достаточно высокую частоту.
По данным Salmon и соавт. (цит. по [115]), среди 72 000 парижан обнаружено 249 лиц, содержащих антитела анти-Le a, 31 – анти-Le b, 49 – анти-Le x. Из 31 сыво-ротки анти-Le b 29 были анти-Le bH, 2 – анти-Le bL. Частота антител составила 0,45 %. Среди 40 000 обследованных пациентов клиник Дюк Университета Issitt
221. Anstee [115] выявили 167 человек с антителами анти-Le a и 39 – с анти-Le b. Частота антител составила 0,49 %. Как отмечают авторы, антитела Lewis встре-чаются в 3–4 раза чаще у негров, чем у белых, поскольку среди негроидов лица с фенотипом Le(a −b −), являющиеся основными продуцентами антител, состав-ляют 20–30 %, а среди европеоидов – только 6 %.
Методы исследования антител Lewis также влияют на частоту их обнару-жения. С использованием эритроцитов, обработанных ферментами, антитела Lewis выявляют существенно чаще.
Анти-Le c
Антитела анти-Le c находят в сыворотках Le(a −b + ) секреторов. Эти анти-тела нейтрализуются слюной Le(a −b −) несекреторов, менее сильно – слюной Le(a −b −) секреторов и Le(a +b −) несекреторов и очень слабо нейтрализуется слюной Le(a −b + ) секреторов. Реакции ингибируются также гликопротеинами, выделенными из содержимого овариальных кист Le(a −b −) несекреторов и три-сахаридом фукозиллактозы. Другие сахара не обладают способностью нейтра-лизовать антитела анти-Le c.
Антитела анти-Le c найдены Gunson и Latham [95] у людей, однако более сильные реактивы получают иммунизацией животных [7, 86, 109, 114].
580
Iseki, Masakia и Shibasaki [114] описали антитела, названные ими анти-Le c, которые были получены путем иммунизации кроликов слюной Le(a −b −) се-креторов и адсорбцией иммунных сывороток энзимированными эритроцита-ми Le(a +b −) и Le(a −b + ). Результат исследования 485 японцев сыворотками анти-Le a, анти-Le b и полученными сыворотками анти-Le c был следующим (по Race, Sanger [197]): 107 (22,06 %) – Le(a +b −c + ), 396 (76,08 %) – Le(a −b +c −), 9 (1,86 %) – Le(a −b −c + ).
М.И. Потапов [9] получил антитела анти-Le c иммунизацией коз слю-ной лиц Le(a −b −) несекреторов. Полученные иммунные сыворотки были ад-сорбированы трипсинизированными эритроцитами Le(a + ), Le(d + ) и Le(b + ). Оставшиеся антитела реагировали с эритроцитами О(I)Le(a −b −c + ), но не О(I) Le(a −b −c −d + ).
Race и Sanger [197] сравнили специфичность козьей сыворотки, получен-ной М.И. Потаповым, и человеческой сыворотки анти-Le c, найденной Gunson
23 Latham [95]. Результаты исследования полностью совпали: эритроциты Le(a −b + ) несекреторов агглютинировались обеими сыворотками, эритроциты Le(a −b −) секреторов не агглютинировались.
Анти-Le d
Эти антитела реагируют с эритроцитами Le(a −b −с −) лиц leSe / leSe и lese / leSe. Они направлены против олигосахаридов типа 1 Н, которые, так же как и другие олигосахариды Lewis, адсорбируются на эритроцитах из плазмы [109].
Антитела анти-Le d получают иммунизацией животных [7, 10, 109] слюной выделителей АВН. Аллогенные антитела анти-Le d в литературе не описаны.
Анти-Le x (анти-Le ab )
233. лиц Le(a −b −) находят антитела, которые по своей направленности ведут себя как анти-Le a + анти-Le b. Они могут быть простой смесью анти-Le a и анти-Le b. В этом случае фракция анти-Le a легко нейтрализуется добавлением слю-ны донора Le(a +b −), в которой имеется субстанция Le а, но нет субстанции Le b. Адсорбированная таким образом сыворотка содержит только антитела анти-Le b. Слюну лиц Le(a −b + ) для дифференциальной нейтрализации не применяют, по-скольку она содержит субстанции Le a и Le b и полностью истощает оба анти-тела. Антитела анти-Le a можно удалить также дифференциальной адсорбцией эритроцитами Le(a +b −).
Если антитела анти-Le a и анти-Le b представляют собой не смесь, а одно свя-занное антитело анти-Le ab, обозначенное анти-Le x [15, 122, 123], сепарацию ан-тител дифференциальной нейтрализацией или адсорбцией провести не удается.
Sturgeon и Arcilla [218] отметили, что антитела анти-Le x реагируют с эритро-цитами Le(a +b −), Le(a −b + ) и эритроцитами новорожденных, имеющих, как из-вестно, фенотип Le(a −b −).
Тот факт, что эритроциты детей Le(a −b −) не реагируют с моновалентными
581
сыворотками анти-Le a и анти-Le b, но реагируют с анти-Le x, свидетельствует о существовании на эритроцитах детей антигена Le x.
Антиген Le x присутствует также у некоторых взрослых.
Таким образом, антитела анти-Le ab (анти-Le x) не являются простой смесью антител и выявляют, помимо антигенов Le a и Le b, третий специфический анти-ген системы Lewis – Le x (Le ab).
Andresen [16] первоначально полагал, что продукция Le x зависит от допол-нительного гена Le x в системе Lewis, однако более поздние исследования, про-веденные Sturgeon и Arcilla [218], позволили заключить, что продукция антиге-нов Le a, Le b и Le x является результатом действия одного гена Le.
250. работах некоторых авторов высказываются сомнения относительно того, что Le x такой же самостоятельный антиген, как Le a и Le b, поскольку по серо-логической характеристике антитела анти-Le x представляют собой комбинацию специфичности анти-Le a + анти-Le b, подобно перекрестно реагирующим анти-телам αβ (анти-С) системы АВО.
Реакции антител анти-Le x с эритроцитами Le(a −b −) новорожденных были объяснены тем, что многие образцы пуповинной крови реагируют с сильными сыворотками анти-Le a в непрямой пробе Кумбса [62]. Иными словами, эритро-циты новорожденных содержат некоторое количество вещества Le a, с которым реагируют антитела анти-Le x.
Антитела анти-Le a обычно вырабатываются секреторами субстанций АВН, антитела анти-Le b – несекреторами. Антитела анти-Le x часто, но не всег-да вырабатываются Le(a −b −) секреторами. В этом их сходство с антителами анти-Le a.
Одни лица продуцируют антитела анти-Le a или анти-Le b, другие могут про-дуцировать оба антитела в виде раздельных фракций (анти-Le a + анти-Le b) или одной фракции анти-Le ab (анти-Le x).
Arcilla и Sturgeon [21–23] показали, что амниотическая жидкость содержит вы-сокий уровень субстанции Le a, которая проявляет себя серологически как Le x.
Антитела анти-Le x нейтрализуются слюной, содержащей Le a, слабее – слю-ной Le b и, что удивительно, слюной лиц Le(a −b −), являющихся несекретора-ми [16, 19]. Ингибиция слюной Le b (т. е. слюной секреторов) более сильная, чем слюной лиц Le(a −b −) несекреторов. Уместно напомнить, что лица Le(a −b −) могут быть секреторами и несекреторами.
То обстоятельство, что антитела анти-Le x ингибируются слюной Le(a −b −) несекреторов, подтверждает существование антигена Le x как самостоятельной единицы.
Химическая структура антигена Le x, как полагают Schenkel-Brunner и соавт. [203, 205] и другие авторы [48, 106, 185, 240], близка детерминантам, определя-емым с помощью антител анти-Le a и анти-Le b.
Для сравнения: перекрестно реагирующий антиген С в системе АВО (по Винеру) присутствует на эритроцитах А и В. Антитела анти-С представляют
582
собой несепарируемый агглютинин αβ (анти-А,В), присутствующий в сыворот-ках лиц О(I) наряду с сепарируемыми α и β.
X. системе резус описаны антитела анти-DC, реагирующие с антигенами D, C
2 антигеном G, который, как правило, сопровождает D и C, но иногда встреча-ется на DC-отрицательных эритроцитах (фенотип cdeG).
Таким же перекрестно реагирующим антигеном, по-видимому, является ан-тиген Le x в системе Lewis.
Антитела анти-Le x (как анти-Le a и анти-Le b) обычно имеют не аллоиммун-ное происхождение, обладают способностью связывать комплемент и могут проявлять гемолитические свойства in vitro.
Анти-А 1 Le b и анти-ВLe b
В 1968 г. Seaman и соавт. [206] при выполнении пробы на индивидуальную совместимость эритроцитов донора с сывороткой больного Siedler нашли ан-титела анти-A1Le b. Сыворотка реагировала с эритроцитами, содержащими оба антигена – A1 и Le b, но не реагировала с эритроцитами ОLe(b + ) и А1Le(b −), содержащими эти антигены порознь. Вскоре 2 такие же сыворотки были най-дены Grookston и соавт. [61] и Gundolf [94].
Антитела анти-A1Le b нейтрализуются слюной всех секреторов А независи-мо от Lewis-групповой принадлежности (Grookston и соавт. [61]).
У лиц с фенотипом A1Le b антиген A1Le b присутствует в слюне.
Наряду с антителами анти -A1Le b встречаются антитела анти- ВLe b, реагиру-ющие с антигеном Le b, когда тот присутствует на эритроцитах вместе с груп-повым антигеном В.
Антитела анти-А1Le b и анти-ВLe b направлены против олигосахаридов Le b типа 1, к которым добавлены имммунодоминантные сахара А или В, что и приводит к формированию антигенных детерминант, определяемых указанны-ми антителами.
Для сравнения: антитела анти-Le bL реагируют только с эритроцитами О(I), А2Le(b + ); а анти -А1Le b и анти-ВLe b – с эритроцитами, несущими Le b и соот-ветствующую А- или В-детерминанту.
Tilley и соавт. [228], Crookston и соавт. [90] установили, что у людей А1Le b и ВLe b в плазме присутствуют гликосфинголипиды, несущие соответственно антигены А1Le b и ВLe b. Такие лица по набору генов относятся к A 1 , Le, Se и B, Le, Se соответственно. Насколько известно, ни анти-А1Le b, ни анти-В Le b не дают реакций при переливании компонентов крови (Issitt, Anstee [115]).
Анти-A 1 Le d и анти-BLe d
235. 1958 г. Andresen [14], обследуя больного раком желудка с фенотипом А2Le(a −b + ), нашел антитела, которые реагировали с эритроцитами A1Le(a −b −) секреторов, менее сильно – с эритроцитами A2Le(a −b −) секреторов. Автор пред-положил, что ген Se в отсутствие гена Le специфически видоизменяет экспрессию
583
антигена А и что обнаруженные им антитела (известные в литературе как Magard-антитела) выявляли антиген А1Le d. Последующие исследования (Hirsch и соавт., 1975) подтвердили предположение Andresen. Magard-сыворотка была первой из обнаруженных сывороток со специфичностью анти-А1Le d. Эти антитела, как те-перь известно, реагируют с олигосахаридами типа 1А (производными цепей типа 1Н). Анти-A1Le d, так же как анти-BLe d, не дают трансфузионных реакций.
Клиническое значение
Большинство антител Lewis не способно разрушать эритроциты, содержа-щие соответствующие антигены, in vivo [111]. Холодовые антитела анти-Le IgM, температурный оптимум которых ниже комнатной температуры 20–22 оС, не активны при температуре тела человека. Неполные антитела анти-Le IgG, хотя и являются тепловыми, однако не вызывают посттрансфузионных ослож-нений как истинные антиэритроцитарные антитела.
Выделяют четыре причины, по которым Lewis-несовместимость не проявля-ет себя клинически [115].
Во-первых, большинство антител, особенно анти-Le b, имеет низкую актив-ность. Многие из них не реагируют с нативными эритроцитами и определяются только с помощью стандартных эритроцитов, обработанных протеолитически-ми ферментами (фицин, папаин, бромелин). Такие ферментзависимые антитела в реакциях несовместимости in vivo не участвуют.
Во-вторых, антигены Lewis, присутствующие в донорской плазме (если пе-реливают цельную кровь) и в том небольшом количестве плазмы, которое име-ется в эритроцитарном концентрате, нейтрализуют антитела Lewis реципиента. Взаимодействие антител с растворенными в плазме субстанциями происходит быстрее, чем с субстанциями, фиксированными на мембране эритроцитов, и де-струкция эритроцитов не успевает развиться.
В-третьих, перелитые эритроциты утрачивают свои антигены Lewis в плазме реципиента. Например: эритроциты Le(a −b + ), перелитые реципиенту Le(a −b −), имеющему антитела анти-Le b, становятся Le(a −b −), а олигосахариды Le b, смы-тые с эритроцитов, нейтрализуются присутствующими антителами анти-Le b.
В-четвертых, если антитела имеют специфичность анти-Le bH, они спо-собны реагировать только с эритроцитами ОLe(a −b + ), но не эритроцитами АLe(a −b + ). Таким образом, для реципиентов группы А(II), содержащих антите-ла анти-Le bH, любые эритроциты А(II) будут совместимыми.
Совместимость донора и реципиента по групповым антигенам, растворен-ным в плазме крови, в трансфузиологии не учитывают.
Иммуносерологам и трансфузиологам известно, что универсальную плазму группы AB(IV), содержащую группоспецифические субстанции АВО, перели-вают в большом количестве (2–2,5 л и более) реципиентам A(II) и B(III), име-ющим естественные антитела против этих антигенов. Однако при этом каких-либо осложнений не наблюдают.
584
Антигены системы Gm при переливании плазмы также не учитывают, хотя некоторые реципиенты (по нашим подсчетам, около 5 %) содержат антите-ла против иммуноглобулинов переливаемой плазмы. Однако и в этих случаях трансфузии не сопровождаются реакциями.
По-видимому, взаимодействие растворимых антигенов с антителами не приводит к посттрансфузионным реакциям, но когда мишенью становятся нерастворимые антигены, фиксированные на эритроцитах, последние разру-шаются, что проявляется клинически в виде тяжелого посттрансфузионного осложнения.
Антигены Lewis, являясь по своей природе водорастворимыми, в основной своей массе находятся в плазме и реагируют с соответствующими антителами
258. жидкофазной системе. Эритроциты, содержащие антигены Lewis в значитель-но меньшем количестве, чем плазма, остаются интактными. Это, на наш взгляд, пятая причина того, почему несовместимость донора и реципиента по системе Lewis не вызывает посттрансфузионных реакций.
V. экспериментах по приживлению эритроцитов, меченных Cr51, in vivo уста-новлено, что время циркуляции эритроцитов Le(a −b + ) у реципиентов, имею-щих анти-Le b-антитела, такое же, как у реципиентов без антител. Немедленных или отсроченных трансфузионных реакций не наблюдали. Уровень гемоглобина после переливания Le b-несовместимых эритроцитов повышался как при совме-стимой трансфузии и оставался одинаковым в течение нескольких недель.
При огромном объеме трансфузиологической помощи в современной ме-дицинской практике трансфузионные реакции, вызванные антителами анти-Le a, все-таки регистрируют (М.А. Умнова и др. [12], Krieger, Simmons [136], Brendemoen, Aas [43] и др. [160, 164, 191]).
Jesse, Sheek [119] описали острую гемолитическую реакцию средней тя-жести у 21-летней африканки, которой в связи с осложненным спонтанным выкидышем 4 раза перелили кровь. Перекрестные пробы на индивидуальную совместимость (тест с центрифугированием и непрямая реакция Кумбса) пе-ред каждой трансфузией были отрицательными. После 4-го переливания у женщины появились боли в пояснице, озноб, температура, гематурия. Кроме анти-Le b-антител, в сыворотке женщины других антиэритроцитарных антител не обнаружено. Гемолитическая реакция была кратковременной, осложнение через 2 дня было купировано. Авторы полагали, что картина посттрансфузи-онного осложнения была вызвана анти-Le b-антителами. Другие случаи гемо-литических посттрансфузионных реакций, обусловленных антителами анти-Le b, не описаны.
Aubuchon и соавт. [26], van Loghem и соавт. (цит. по [6]) привели случаи посттрансфузионных реакций, обусловленных антителами анти-Le x. Для та-ких реципиентов практически все доноры несовместимы. Однако даже в этих случаях, как отмечают Waheed и соавт. [233], посттрансфузионные реакции крайне редки.
585
2 акушерской практике зарегистрированы единичные случаи гемолитиче-ской болезни новорожденных, связанные с Lewis, которые, однако, вызывали сомнение относительно их обусловленности именно этим фактором. Mollison и соавт. [173], анализируя эти работы, не нашли достаточного клинического и ге-матологического подтверждения.
Как показали Spitalnik и соавт. [213], в 12 случаях из отобранных ими 13 пар мать – плод в крови матери присутствовали одновременно IgM и IgG анти-Le a-антитела, в пуповинной крови новорожденных имелись антитела анти-Le a IgG, регистрируемые только высокочувствительным ферментсвя-зывающим имммуносорбентным методом. Гемолитических реакций у ново-рожденных не бвло. Полученные данные позволили авторам заключить, что антитела анти-Le a IgM через плаценту не проходят, а антитела анти-Le a IgG легко проникают через плаценту, однако не вызывают разрушения эритро-цитов плода, поскольку антигены Lewis у плодов и новорожденных отсут-ствуют.
Ингибиция Lewis-антител
Lewis-антитела нейтрализуют с целью идентификации антител другой специфичности, присутствующих в сыворотке. Для этого используют об-разцы слюны, тестированные на наличие субстанций Le a, Le b и АВН, а так-же вытяжки из гуммиарабика или синтетические антигены Lewis (Spitalnik
260. соавт., цит. по [115]). Цельная слюна нередко вызывает гемолиз эритроци-тов, поэтому ее предварительно разводят раствором натрия хлорида и кипя-тят, чтобы устранить присутствующую в ней слизь. Методика подробно опи-сана П.Н. Косяковым [6] и Judd [125].
Mollison и соавт. [173] описали случай, когда пациенту Le(a −b −), имеюще-му антитела анти-Le a + Le b, гемолизирующие эритроциты в тестах in vitro, с це-лью нейтрализации антител ввели парентерально очищенный концентрат Le a и Le b. Антитела пациента были нейтрализованы in vivo, после чего ему было пе-релито несколько доз крови Le(a −b + ) без каких-либо реакций. Через несколько дней антитела анти-Le a и анти-Le b снова появлялись в плазме пациента, теперь уже в более сильной форме, чем до нейтрализации. Прямая проба Кумбса стала положительной, поскольку перелитые ранее эритроциты были Le(a −b + ) и сен-сибилизировались антителами in vivo, однако гемолиза не наблюдалось. Вскоре циркулирующие эритроциты приобрели фенотип реципиента Le(a −b −) и пря-мая проба Кумбса стала отрицательной.
Нейтрализация антител in vivo была применена также Andorka и соавт., Pelosi и соавт. (цит. по Issitt, Anstee [115]), но широкого распространения не по-лучила: в значительной степени в связи с тем, что в этих модельных экспери-ментах даже сильные антитела, деструктирующие эритроциты in vitro, не про-являли реактогенных свойств in vivo.
586
Хромосомная локализация
По данным Mollicone и соавт. [172], Nishihara и соавт. [179], Kukowska-Latallo и соавт. [137], Ball и соавт. [28], Koda и соавт. [134], Lamm и соавт. [138], генный локус Lele (FUT3) расположен на коротком плече хромосомы 19 в позиции 19р13.3.
На этой хромосоме располагаются гены, кодирующие другие фукозилтранс-феразы: FUT1, FUT2, FUT5 и FUT6. Некоторые из них могут влиять на продук-цию антигенов Lewis, придавая им специфические особенности. FUT6 и FUT2 участвуют в синтезе тканевого антигена Le y.
Ген le является молчащим аллелем гена Le. При генотипе lele Le-генспецифическая фукозилтрансфераза не вырабатывается.
На длинном плече хромосомы 19 располагаются также гены LW, Lutheran, Hh и Sese, ген пептидазы D (Pep D) и ген третьего компонента комплемента – C 3.
Kukowska-Latallo и соавт. [137] клонировали ген Le в COS-клетках и полу-чили рекомбинантные фукозилтрансферазы α(1→3) и α(1→4), способные син-тезировать антигены Le a, Le b и X (SSEA-1). Клонированные трансферазы явля-лись продуктом именно Le-гена и были однотипны с Lewis-трансферазой, полу-ченной из человеческого молока [151, 195].
Suh и соавт. [220] описали несколько мутаций в генах FUT2 и FUT3, при ко-торых антигены Lewis не вырабатывались.
Слабый (Le w )-фенотип
Слабая выраженность антигенов Lewis обусловлена аминокислотными замена-ми в генах, контролирующих продукцию фукозилтрансфераз [71, 134, 172, 180].
Koda и соавт. [134] нашли у японцев Le(a −b −) 2 мутации в гене FUT3 (Leu
20 → Arg, Gly 170 → Ser). Опыты с клонированием гена Le в COS-клетках пока-зали, что замена Gly 170 → Ser приводит к продукции неактивного фермента, тог-да как при замене Leu 20 → Arg вырабатывалась активная фукозилтрансфераза, о чем свидетельствовало появление антигена Le b на поверхности COS-клеток.
Mollicone и соавт. [172] также выявили мутацию Leu 20 → Arg у индоне-зийцев Le(a −b −), которые содержали антигены Lewis в слюне. Такие же замены описаны у японцев [180] и шведов [71]. Замена аргинина на лицин приводила к экспрессии слабовыраженного антигена Lewis.
Nishihara и соавт. [179] и Mollicone и соавт. [172] описали мутацию Ile 356 → Lys. Гетерозиготы по этой мутации, 18 из 19 индонезийцев Le(a −b −), не содер-жали антигенов Lewis ни на эритроцитах, ни в слюне.
Cooling и Gu [59] исследовали с помощью ПЦР 15 афроамериканцев, имев-ших фенотип Lenull, Отмечены варианты мутаций в FUT3, которые приводили к продукции неактивного фермента и в результате формировали нулевой фено-тип. Одну из мутаций (G → A) в нуклеотиде 13 обнаружили у 50 % обследован-ных (рис. 9.3), она приводила к замене Gly 5 → Ser. У других обследованных обнаружили мутации G → Т в нуклеотиде 1022, G → A в нуклеотиде 484, G →
587
A в нуклеотиде 667. Они приводили к замене Cys 341 → Phe, Ile 356 → Lys, ко-торые также сочетались с низкой активностью фукозилтрансферазы.
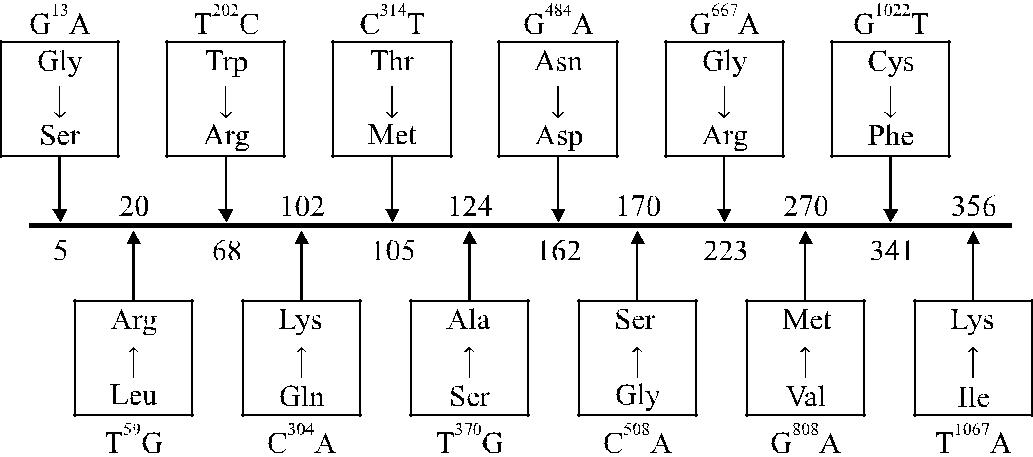
Рис. 9.3. Мутации в гене FUT3 у лиц с фенотипом Lewisnull. Двенадцать нуклеотидных замен, приводящих к продукции неактивной фукозилтрансферазы, по Cooling, Gu [59].
Две мутации, Trp 68 → Arg и Thr 105 → Met, найдены Elmgren и соавт.
20 Для того чтобы определить их влияние на активность фукозилтрансфера-зы, Elmgren и соавт. [70] сконструировали 2 химеричных протеина: FUT3 с Trp 68 → Arg и FUT3 с Thr 105 → Met. При первой замене продуцировался фермент с низкой активностью, тогда как при второй замене активность фермента соот-ветствовала норме. Авторы пришли к выводу, что гомозиготность по Trp 68 → Arg дает фенотип Le(a −b −).
Orntoft и соавт. [187] описали мутацию (С 445 А) у человека Le(a −b −), боль-ного раком. Эта мутация приводила к продукции метионина в позиции 146, од-нако такая же мутация обнаруживалась и у здоровых лиц.
Mollicone и соавт. [171] установили, что примерно 9 % жителей острова Ява не имеют α(1,3)-фукозилтрансферазы (FUT6), обычно присутствующей в плаз-ме человека, однако содержат антигены Lewis.
При клонировании гена FUT5 от лиц с дефицитом α(1,3)-фукозилтрансферазы найдены 3 точки мутаций: Arg 173 → Cys, Pro 187 → Leu, Thr 388 → Met, кото-
рые, однако, не сказывались на активности фермента.
При клонировании гена FUT6 выявлены замены Pro 124 → Ser, Glu 247 → Lys, Tyr 315 → стоп-кодон. Две последние замены приводили к продукции не-активного фермента. Замены Glu 247 → Lys и Tur 315 → стоп-кодон в FUT6, ко-торые сочетались с дефицитом α(1,3)-фукозилтрансферазы, обнаружены среди полинезийцев и шведов (Larson и соавт. цит. по [115]). Таким образом, ген FUT6 отвечает за активность α(1,3)-фукозилтрансферазы в плазме у людей и как дру-гие гены FUT полиморфен.
588
Физиологическая роль
Считается, что адсорбция олигосахаридов Lewis на клетках пассивная [115], однако механизм, по-видимому, не столь прост. Транспортная функция эритро-цитов изучена мало, хотя очевидно, что перенос многих биологически актив-ных веществ – гормонов, ферментов, вирусов – это сложный микрофизиологи-ческий процесс, в котором немаловажная роль принадлежит серологически вы-являемым структурам эритроцитов, в том числе Lewis.
Антигены Le а и Le x принимают участие в клеточной дифференцировке и опухолевой трансформации [75, 98] и рассматриваются как фактор , способ-ствующий гематогенному метастазированию опухолевых клеток [97, 153, 222, 241]. Наряду с другими онкоэмбриональными антигенами антиген Le x, по мнению некоторых исследователей, может служить маркером прогрессирую-щей малигнизации [75, 83, 96, 99].
Le x хорошо выражен в эмбриональных тканях [83, 212] – отсюда его обо-значение SSE-1 (Stage Specific Embryotic Antigen-1). Он максимально экспрес-сирован на стадии морулы у мышей и, как полагают [212], играет определен-ную роль в преимплантации эмбриона.
Fukushi и соавт. [78], исследуя человеческие эмбрионы в разные сроки разви-тия, установили, что Le x появляется через 40 дней с момента оплодотворения, достигает максимума к 50–70 дням, далее его экспрессия уменьшается.
257. взрослых Le x присутствует на нейтрофилах, эпителии проксимальных ка-нальцев почек [49, 76, 78] и желудочно-кишечного тракта [200].
Le а, Le x и их производные (Le b и Le y), обработанные сиалидазой, накаплива-ются в опухолевых клетках, которые в процессе малигнизации утрачивают нор-мальную дифференцировку [46, 79, 112, 200] и возвращаются к экспрессии ан-тигена Le x, свойственного эмбриональным тканям.
Как показали серии исследований [34, 38, 131, 231], антигены Le x и Le а, об-работанные сиалидазой и сульфатазой, являются лигандами адгезивных моле-кул, обеспечивающих хоминг лимфоцитов при остром воспалении.
Адгезия, так же как и трансэндотелиальная миграция лимфоцитов, обуслов-лена адгезивными молекулами, экспрессированными на поверхности эндотели-
альных клеток [30, 147, 152].
Антигены Le x, Le y (в меньшей степени Le а, Le b и Le d) обнаружены в грамо-трицательныех бактериях Helicobacter pylori [24, 25, 159, 174], вызывающих хронический гастрит [237], язву желудка и двенадцатиперстной кишки [85], лимфому [190] и аденокарциному желудка [181, 182, 189].
По мнению Appelmelk и соавт. [20], патогенез Helicobacter-индуцированного га-стрита включает аутоиммунный компонент и сводится к следующему. Антигенная мимикрия по Le x позволяет Helicobacter pylori, оставаясь незамеченными, нарабаты-вать большое количество антигена Le x, к которому в итоге вырабатываются нейтрали-зующие его антитела анти-Le x. Последние, будучи перекрестно реагирующими, взаи-модействуют не только с Helicobacter, но и с эпителием желудка, провоцируя гастрит.
589
Teneberg и соавт. [226] и другие авторы [167, 168] полагают, что Helicobacter pylori содержат нейтрофилактивные протеины, способствующие накоплению нейтрофилов в слизистой оболочке желудка.
Другие исследователи [37, 73, 113] связывают роль Helicobacter в этиологии гастрита с непосредственным их прилипанием к слизистой оболочке желудка с помощью адгезивных Le b-молекул, что приводит к локальному воспалению.
Молекулярная мимикрия, по мнению ряда авторов [64, 133, 215], лежит в основе заражения человека кровяным гельминтом Schistosoma mansoni, который синтезирует гликоконъюгаты, несущие антиген Le x. Анти-Le x-антитела, выраба-тывающиеся у инвазированных людей, предотвращают повторное заражение [50, 65]. Однако эти антитела способны вызывать комплементзависимый цитолиз гра-нулоцитов, что приводит к нейтропении, наблюдаемой при шистозоматозе [209].
Список литературы
264. Абдина А.С. Группы крови у хакасов (гемотрансфузионные и этногенетические вопросы): автореф. дис. … канд. мед. наук. – М., 2000. – 19 с.
265. Аржелас Л.К. Цит. по: Косяков П.Н. Изоантигены и изоантитела человека в норме и
патологии. – М.: Медицина, 1974. – С. 230.
266. Бронникова М.А. Особенности возрастной трансформации системы Левис // ХII
Междунар. конгр. по перелив. крови. – М.: Медицина, 1972. – С. 362–364.
4. Бронникова М.А., Гаркави А.С. Развитие изосерологических систем у человека
в процессе эмбриогенеза // VII Междунар. конгр. антропол. и этнограф. наук. – М.: Наука, 1964. – 10 с.
3 Донсков С.И., Пискунова Т.М. Два случая Lewis-антител у молодых мужчин // Проблемы гематологии. – 2004. – № 2. – С. 41.
4 Косяков П.Н. Изоантигены системы Льюис (Lewis): Изоантигены и изоантитела
человека в норме и патологии. – М.: Медицина, 1974. – С. 230.
5 Потапов M.И. Production of immuno-anti-Lewis sera in goats // Vox Sang. – 1976. – V. 30. – Р. 211–213.
6 Потапов М.И. (Potapov M.I.) Discovery of two new Lewis blood groups // 8-th Congr. Intern. Acad. Legal Med. Social Med. Opatija, Reijeka, 1970. – Р. 136.
7 Потапов М.И. Генетический аспект синтеза антигенов системы Lewis в слюнных железах // Генетика. – 1973. – Т. IX. – № 5. – С. 138–143.
8 Потапов М.И. Обнаружение антигена системы Lewis, свойственного эритроцитам выделителей группы Le(a −b −) // Пробл. гематол. – 1970. – № 11. – С. 45–49.
9 Туманов А.К., Томилин В.В. Наследственный полиморфизм изоантигенов и ферментов крови в норме и патологии человека. – М., 1969. – 436 с.
10 Умнова М.А., Скачилова Н.Н., Ичаловская Т.А. и др. К вопросу о роли групповой системы Lewis в гемотрансфузионных осложнениях // Пробл. гематол. – 1975. – № 4. – С. 33–38.
11 Abe K., McKibbin J.M., Hfkomori S.I. The monoclonal antibody directed to difucosylated type 2 chain (Fucα1→2Galβ1→[Fucα1→3]GlcNAc; Y determinant) // J. Biol. Chem. –1983. – V. 258. – Р. 11793–11797.
12 Andersen J. Modifying influence of the secretor gene on the development of the ABH substance. A contribution to the conception of the Lewis group system // Vox Sang. – 1958. – V. 3. – P. 251–261.
13 Andresen P.H. Blood group with characteristic phenotypical aspects // Acta Path. Microbiol. Scand. – 1948. – V. 24. – P. 616–618.
590
268. Andresen P.H. Demonstration of Le x substance in saliva of ABH non-secretors // Vox Sang. – 1972. – V. 23. – P. 262–269.
269. Andresen P.H. The blood group system L. A new blood L2. A case of epistasy within the blood groups // Acta Path. Microdiol. Scand. – 1948. – V. 25. – P. 728–731.
270. Andresen P.H., Andresen A., Jordal K., Henningsen K. Correlation entre le systeme Lewis et le systeme secreteur-non-secreteur (Recherches sur 71 families.) // Rev. Hemat. – 1950. –
V. 5. – P. 305–314.
271. Andresen P.H., Jordal K. An incomplete agglutinin related to the L-(Lewis) system // Acta Path. Microbiol. Scand. – 1949. – V. 26. – P. 636–638.
272. Appelmelk B.J., Simoons-Smit I., Negrini R. et al. Potential role of molecular mimicry between Helicobacter pylori lipopolysaccharide and host Lewis blood group antigens in autoimmunity // Infect. Immun. – 1996. – V. 64. – P. 2031–2040.
273. Arcilla M.B., Sturgeon P. Lewis and ABH substances in amniotic fluid obtained by amniocentesis // Pediatr. Res. – 1972. – V. 6. – P. 853–858.
274. Arcilla M.B., Sturgeon P. Le x, the spurned antigen of the Lewis blood group system // Vox Sang. – 1974. – V. 26. – P. 425–438.
275. Arcilla M.B., Sturgeon P. Studies on secretion of blood group substances. II. Observations on the red cell phenotype Le(a −b −x −) // Vox. Sang. – 1973. – V. 25. – P. 72–87
276. Aspinall G.O., Monteiro M.A. Lipopolysaccharides of Helicobacter pylori strains P466 and MO19: structures of the O antigen and core oligosaccharide regions // Biochemistry. – 1996. – V. 35. – P. 2498–2504.
277. Aspinall G.O., Monteiro M.A., Pang H. et al. Lipopolysaccharide of Helicobacter pylori type strain NCTC 11637 (ATCC 43504): structure of the O antigen chain and core oligosaccharide regions // Biochemistry. – 1996. – V. 35. – P. 2489–2497.
278. Aubuchon J.P., Davey R.J., Anderson H.J. et al. Specificity and clinical significance of anti-Le x // Transfusion. – 1986. – V. 26. – 302–303.
279. Baer H., Naylor I., Gibbel N., Rosenfield R. E. The production of precipitating antibody in chickens to a substance present in the fluids of non-secretors of blood groups A, B and O // J. Immunol. – 1959. – V. 82. – P. 183–189.
280. Ball S.P., Tongue N., Gibaud A. et al. The human chromosome 19 linkage group Fut1 (H), FUT2 (SE), LE, LU, PTPD, C3, APOC2, D19S7, and D19S9 // Ann. Hum. Genet. – 1991. – V. 55. –
Q. 225–233.
281. Barnicot N.A., Lawler S. A study of the Lewis, Kell, Lutheran and P blood group systems and the ABH secretion in West African Negroes // Amer. J. Phys. Anthrop. – 1953. – V. 11. –
J. 83–90.
282. Berlin C., Bargatze R.F., Campbell J.J. et al. α4-integrins mediate lymphocyte attachment and rolling under physiologic flow // Cell. –1995. – V. 80. – P. 413–422.
283. Bianco I., Silvestroni E., Lawler S. D. et al. Further contributions to the of Lewis and secretor characters // Vox Sang. – 1960. – V. 5. – P. 337–348.
284. Bird G.W.G. Erythrocyte Agglutinins from Plants. Ph. D. Thesis. – London, 1958.
285. Bird G.W.G. Haemagglutinins in seeds // Brit. Med. Bull. – 1959. – V. 15. – P. 165–168.
286. Bird M.I., Foster M.R., Malhotra R. Selectins: physiological and pathophysiological roles // Biochem Soc. Trans. – 1997. – V. 25. – P. 1199–1206.
287. Blaszczyk-Thurin M., Thurin J., Hindsgaul O. et al. Y and blood group B type 2 glycolipid antigens accumulate in a human gastric carcinoma cell line as detected by monoclonal antibody. Isolation and characterization by mass spectrometry and NMR spectroscopy //
P. Biol. Chem. – 1971. – V. 262. – P. 372–379.
2 Boettcher B., Kenny R. A quantitative study of Le a, A, and H antigens in salivas of Australian Caucasians and Aborigines // Hum. Hered. – 1971. – V. 21. – P. 334–345.
3 Boren T., Falk P., Roth K.A. et al. Attachment of Helicobacter pylori to human gastric epithelium mediated by blood group antigens // Science. – 1993. – V. 262. – P. 1892–1895.
591
304. Brandley B.K., Swiedler S.J., Robbins P.W. Carbohydrate ligands of de LEC cell adhesion molecules // Cell. – 1990. – V. 63. – P. 861–863.
305. Brendemoen O.J. Development of the Lewis blood group in the newborn. //Acta Path. Microbiol. Scand. – 1961. – V. 52. – P. 55–58.
306. Brendemoen O.J. Fruther studies of agglutination and inhibition in the Le a-Le b system //
P. Lab. Clin. Med. – 1950. – V. 36. – P. 335–341.
307. Brendemoen O.J. Some factors influencing Rh immunization during pregnancy // Acta. Path. Microbiol. Scand. – 1952. – V. 31. – P. 579–583.
308. Brendemoen O.J. Studies of agglutination and inhibition in two Lewis antibodies // J. Lab. Clin. Med. – 1949. – V. 34 – P. 538–542.
309. Brendemoen O.J., Aas K. Hemolytic Transfusion reaction probably caused by anti-Le a // Acta. Med. Scand. – 1952. – V. 141. – P. 458–460.
310. Broadberry E.R., Lin-Chu M. The Lewis blood group system among Chinese in Taiwan // Hum. Hered. – 1991 – V. 41. – P. 290–294.
311. Brockhaus M., Magnani J.L., Herlyn M. et al. Monoclonal antibodies directed against the sugar sequence of lacto-N-fucopentaose III are obtained from mice immunized with human tumors // Arch. Biochem. Biophys. – 1982. – V. 217. – P. 647–651.
312. Brown A., Ellis I. O., Embleton M.J. et al. Immunohistochemical localization of Y hapten and the structurally related H type-2 blood group antigen on large-bowel tumours and normal adult tissues // Int. J. Cancer. – 1984. – V. 33. – P. 727–736.
313. Brown P.C., Glynn L.E., Holborow E.J. Lewis a substance in saliva. A qualitative difference between secretors and non-secretors // Vox Sang. – 1959. – V. 4. – P. 1–12.
314. Cagas P., Bysh C. A. Determination of the conformation of Lewis blood group oligosaccharides by simuloation of to dimensional nuclear Overhauser data // Biopolimers. –1990. – V. 30. – P. 1123– 1138.
315. Candelier J.J., Mollicone R., Mennessom B. et al. α-3-Fucosyltransferases and their glycoconjugate antigen products in the developing human kidney // Lab. Invest. – 1993. –
// 69, – P. 449–459.
2 Capron A., Dessaint J.P., Capron M. et al. E. Immunity to schistosomes: progress toward vaccine// Science. – 1987. – V. 238. – P. 1065–1072.
3 Cartron J.P., Mulet C., Bauvois B. et al. ABH and Lewis glycosyltransferases in human red cells, lymphocytes, and platelets // Blood Transfus. Immunohaemat. – 1980. – V. 23. – P. 271– 282.
4 Ceppellini R. Immunogenetica I0–Analisi fenotypica al livello submolecolare: le specificita’ serologiche multiple dei mucoidi gruppospecifici salivary // Folia Hered. Path. – 1959. – V. 8. – P. 201–226.
5 Ceppellini R. On the genetics of secretor and Lewis characters: a family study // Proc. 5 th Congr. Soc. Blood Transf., Paris, 1955. – P. 207–211.
6 Ceppellini R., Dunn L.C., Innella F. Immunogenetica II. Annalisi genetica formale de caratteri Lewis con patricolare riguardo alla natura epistatica della specificita’ serologica Le b // Fol. Hered. Path. – 1959. – V. 8. – P. 261–296.
7 Ceppellini R., Siniscalco M. Una nuova ipotesi genetica per il sistema Lewis secretore e suoi riflessi nei riguardi di alcune evidence di linkage con altri loci // Revista dell’Istitutio Sieroterapico Italiano. – 1955. – V. 30. – P. 431–445.
8 Chandanayingyong D., Sasaki T.T., Gdreenwalt T.J. Blood groups of the Thais // Transfusion, Philad. – 1967. – V. 7 – P. 269–276.
9 Chester M.A., Watkins W.M. α-L-Fucosyltransferases in human submaxillary gland and stomach tissues associated with the H, Le a and Le b blood group characters and ABH secretor status // Biochem. Biophys. Res. Commun. –1969. – V. 34. – P. 835–842.
10 Comoens H., Sathe M., Joshi V.B. et al. Variations in the Le a in Oh (Bombay) phenotype during pregnancy // Indian J. Med. – 1971. – V. 25. – P. 313–314.
592
326. Cooling L., Gu Y. Identification of two new single-nucleotide polymorphism in FUT3 associated with the Lewis-null phenotype // Transfusion. – 2003. – V. 43. – N 12. –
// 1760–1761.
327. Cowles J.W., Spitalnik S.L., Blumberg N. Detection of anti-Le a in Le(a −b + ) individuals by kinetic ELISA // Vox Sang. – 1986. – V. 50. – P. 164–168.
328. Crookston M.C., Tilley C.A., Crookston J.H. Human blood chimaera with seeming breakdown of immune tolerance // Lancet. – 1970. – V. ii. – P. 1110–1112.
329. Cutbush M., Giblett E.R., Mollison P.L. Demonstration of the phenotype Le(a +b + ) in infants and in adults // Brit. J. Haemat. – 1956. – V. 2 – P. 210–220.
330. Daniels G.L., Anstee D.J., Cartron J.P. et al. ISBT Working party on terminology for red cell surface antigens // Vox Sang. – 2001. – V. 80. – P. 193–196.
331. De Bose-Boyd R., Nyame A.K., Cummings R.D. Schistosoma mansoni: characterization of an α-1-3-fucjsyltransferase in adult parasites // Exp. Parasit. –1996 – V. 82. – P. 1–10
332. Dissous C., Grzych J.M., Capron A. Schistosoma mansoni shares a protective oligosaccharide epitope with freshwater and marine snails // Nature. – 1986. – V. 323. – P. 443–445.
333. Dorf M.E., Eguro S.Y., Cabrera G. et al. Detection of cytotoxic non-HL-A antisera. I. Relationship to anti-Le a // Vox Sang. – 1972. – V. 22. – P. 447–456.
334. Dunstan R.A., Simpson M.B., Knowles R.W., Rosse W.F. The origin of ABH antigens on human platelets// Blood. – 1985. – V. 65. – P. 615–619.
335. Egge H., Hanfland P. Immunochemistry of the Lewis blood group system. Mass spectrometric analysis of permethylated Le a-, Le b-, and H-type 1 (Le dH) blood-group active and related glycosphingolipids from human plasma // Arch. Biochem. Biophys. – 1981. – V. 210. – P. 396–404.
336. Eggens I., Fenderson B., Toyokuni T. et al. Specific interaction between Le x and Le x determinants. A possible basis for cell recognition in preimplanataion embryos and in embryonal carcinoma cells // J. Biol. Chem. – 1989. – V. 264. – P. 9476–9484.
337. Elmgren A., Mollicone R., Costache M. et al. Significance of individual point mutations, T202C and C314T, in the human Lewis (FUT3) gene for expression of Lewis antigens by the human α(1,3 / 1,4)-fucosyltransferase, Fuc-TIII // J. Biol. Chem. – 1997. – V. 272. –
// 21994–21998.
338. Elmgren A., Rydberg L., Larson G. Genotypic heterogeneity among Lewis-negative individuals // Biochem. Biophys. Res. Commun. – 1993. – V. 196. – P. 515–520.
339. Eppenberger-Castori S., Lotscher H., Finn J. Purification of the N-acetylglucosaminide α(1,3 / 4)fucosyltransferase of human milk // Glycoconj. J. – 1989. – V. 6. – P. 101–114.
340. FalkP.G., Bry L., Holgerson J., Gordon J. Expression of the human α-1,3 / 4)-fucosyltransferase in the pit cell lineage of FVB / N mouse stomach result in production of Le b-containing glycoconjugates: a potential transgenic mouse model for studying Helicobacter pylori infection // Proc. Nat. Acad. Sci. USA, 1995. – V. 92. – P. 1515–1519.
341. Feizi P.G. Demonstration by monoclonal antibodies that carbohydrate structures of glycoproteins and glycolipids are onco-developmental antigens // Nature. – 1985. – V. 314. – P. 53–57.
342. Feizi P.G., Childs R.A. Carbohydrate structures of glycoproteins and glycolipids as differentiation antigens, tumor-associated antigens and components of receptor system // Trends Biochem. – 1985. – V. 10. – P. 24–29.
343. Fox N., Damjanov I., Knowles B.B., Solter D. Immunohistochemical localization of the mouse stage-specific embryonic antigen 1 in human tissues and tumor // Cancer Res. – 1983. – V. 43. – P. 669–678.
344. Fukushi Y., Hakomori S.I., Nudelman E., Cochran N. Novel fucolipids accumulating in human adenocarcinoma. II. Selective isolation of hybridoma antibodies that differentially recognize mono-, di-, and trifucosylated type 2 chain // J. Biol. Chem. – 1984. – V. 259. –
// 4681–4685.
593
336. Fukushi Y., Hakomori S.I., Shepard T. Localization and alteration mono-, di-, and trifucosyl α1→3 type 2 chain structures during human embryogenesis and in human cancer // J. Exp. Med. – 1984. – V. 160. – P. 506–520.
337. Fukushima K., Hirota M., Terasaki P.A. et al. Characterization of sialosylated Lewis x as a new tumor-associated antigen // Cancer Res. – 1984. – V. 44. – P. 52–79.
338. Furuhata T., Ueyama R. On the new antigen-antibody ‘T and anti-T precipitin’ // Tokyo Izisinsi. – 1939. – V. 3120. – P. 271–273 (Japan).
339. Galatius-Jensen F. On the genetics of the haptoglobins // Acta Genet. – 1958. – V. 8. –
// 232–247.
340. Garratty G., Kleinschmidt G. Two examples of anti-Le b detected in the sera of patients with the Lewis phenotype le (a +b −) // Vox Sang. – 1965. – V. 10. – P. 567–571.
341. Gooi H.C., Feizi T., Kapadia A. et al. Stage-specific embryonic antigen involves α1→3 fucosylated type 2 blood group chains // Nature. – 1981. – V. 292. – P. 156–158.
342. Gooi H.C., Picard J.K., Younsell E.F. et al. Monoclonal antibody (EGR / G49) reactive with the epidermal growth factor receptor of A431 cells recognizes the blood group ALe b and ALe y structures // Mol. Immunol. – 1985. – V. 22. – P. 689–694.
343. Gracham D.Y. Helicobacter pylori: its epidemiology and its role in duodenal ulcer disease // J. Gastroenterol. – 1991. – V. 6. – P. 105–113.
344. Graham H.A., Hirsch H.F., Davies D.M. Genetics and immunochemical relationships between soluble and cell-bound antigens of the Lewis system // Human Blood Groups /
// Karger. – Basel, 1977. – P. 257–267.
351. Greenwalt T.J. Confirmation of linkage between the Lutheran and secretor genes // Amer.
// Hum. Genet. – 1961. – V. 13. – P. 69–88.
352. Greenwell P., Ball M.G., Watkins W.M. Fucosyltransferase activity in human lymphocytes and granulocytes. Blood group H-gene-specified α-2-L-fucosyltransferase is a discriminatory marker of peripheral blood lymphocytes // FEBS Lett. – 1983. – V. 164. – P. 314–317.
353. Grollman E.F., Kobata A., Ginsburg V. An enzymatic basis for Lewis blood types in man //
// Clin Invest. – 1969. – V. 48. – P. 1489–1494.
354. Grookston M.C., Tilley C A., Grookston J H. Human blood chimera with seeming breakdown of immune tolerance // Lancet. – 1970. – V. ii. – P. 1110–1112.
355. Grubb R. Correlation between Lewis blood group and secretor character in man // Nature. – 1948. – V. 162. – P. 933.
356. Grubb R. Observations on the human group system Lewis. Acta Pat // Microbiol. Scand. – 1951. – V. 28. – P. 61–81.
357. Grubb R. Quelques aspects de la complexite des groupes ABO // Rev. Hemat. – 1950. –
P. 5. – P. 268–275.
2 Gundolf F. Anti-A1Le b in serum of a person of a blood group A1h // Vox Sang. – 1973. –
V. 25. – P. 411–419.
3 Gunson H.H., Latham V. An agglutinin in human serum reacting with cells from Le(a −b −) non-secretor individuals // Vox Sang. – 1972. – V. 22. – P. 344–353.
4 Hakomori S.I. Aberrant glucosylation and tumor-associated carbohydrate antigens // Adv. Cancer. Res. – 1989. – V. 52. – P. 257–331.
5 Hakomori S.I. Le x and related structures as adhesion molecules // Histochem. – 1992. –
V. 24. – P. 771–776.
6 Hakomori S.I. Tumor-associated glycolipid antigens, their metabolism and organization // Chem. Phys. Lipids. – 1986. – V. 42. – P. 209–233.
7 Hakomori S.I., Kannagi R. Glycosphingolipids as tumor-associated and differentiation markers // J. Natl. Cancer Inst. – 1983. – V. 71. – P. 231–251.
8 Hakomori S.I., Kobata A. Blood group antigens // The Antigens / M.S. Sela, ed. – New York: Academic Press, 1974. – V. 2. – P. 79–140.
594
359. Hakomori S.I., Nudelman E., Kannagi R., Levery S.B. The common structure in fucosyllactosaminolipids accumulating in human adenocarcinomas, and its possible absence in normal tissues // Biochem. Biophys. Res. Commun. – 1982. – V. 109. – P. 36–44.
360. Hakomori S.I., Nudelman E., Levery S. et al. The hapten structure of developmentally regulated glycolipid antigen (SSEA-1) isolated from human erythrocytes and adenocarcinoma: a preliminary note // Biochem. Biophys. Res. Commun. – 1981. – V. 100. – P. 1578–1586.
361. Hakomori S.I., Nudelman E., Levery S.B., Kannagi R. Novel fucolipids accumulating in human adenocarcinoma. 1. Glycolipids with di- or trifucosylated type 2 chain // J. Biol. Chem. – 1984. – V. 259. – P. 4672–4680.
362. Hammar L., Mansson S., Rohr T. et al. Lewis phenotype of erythrocytes and Le b-active glycolipid in serum of pregnant women // Vox Sang. – 1981. – V. 40. – P. 27–33.
363. Hanfland P., Graham H.A. Immunochemistry of the Lewis-blood-group system: partial characterization of Le a-, Le b-, and H-type 1 (Le dH)-blood-group active glycosphingolipids from human plasma // Arch. Biochem. Biophys. – 1981. – V. 210. – P. 383–395.
364. Hanfland P., Kordowicz M., Peter-Katalinic J. et al. Immunochemistry of the Lewis blood-group system: isolation and structures of Lewis-c active and related glycosphingolipids from the plasma of blood-group O Le(a −b −) nonsecretors // Arch. Biochem. Biophys. – 1986. – V. 246. – P. 655–672.
365. Henry S.M., Benny A.G., Woodfiled D.G. Investigation of Lewis phenotypes on Polynesians: evidence of a weak secretor phenotype // Vox Sang. – 1990. – V. 58. –
P. 61–66.
366. Henry S.M., Simpson L.A., Woodfiled D.G. The Le(a +b + ) phenotype in Polynesians // Hum. Hered. 1988. – V. 38. – P. 111–116.
367. Hirsch H.F., Graham H.A. Adsorption of Le c and Le d from plasma onto red blood cells // Transfusion. – 1980. – V. 20. – P. 474–475.
368. Holburn A.M. IgG anti-Le a // Brit. J. Haematol. – 1974. – V. 27. – P. 489–500.
369. Holburn A.M. Quantitative studies with [125I] IgM anti-Le a // Immunology. – 1973. –
W. 24. – P. 1019.
372. Holmes E.H., Ostrander G.K., Clausen H., Graem N. Oncofetal expression of Le x carbohydrate antigens in human colonic adenocarcinomas. Regulation through type 2 core chain synthesis rather than fucosylation // J. Biol. Chem. – 1987. – V. 262. – P. 11331– 11338.
373. Ilver D., Arnqvist A., Ögren J. et al. Helicobacter pylori adhesin binding fucosylated histo-blood group antigens revealed by retagging // Science. – 1998. – V. 279. – P. 373–377.
374. Iseki S., Masaki S., Shibasaki K. Studies on Lewis blood group factor // Proc. Imp. Acad. Japan. – 1957. – V. 33. – P. 492–497.
375. Issitt P.D., Anstee D.J. Applied Blood Group Serology. – 4-th ed. – Durham, NC, USA: Montgomery Sc. Publ., 1998. – P. 248–275.
376. Iwaki Y., Kasai M., Terasaki P. I. et al. Monoclonal antibody against A1Lewis d antigen produced by the hybridoma immunized with a pulmonary carcinoma // Cancer Res. – 1982. – V. 42. – P. 409–411.
377. Jeannet M., Bodmer J. G., Bodmer W. F., Schapira M. Lymphocytotoxic sera associated with the ABO and Lewis red cell blood groups // Histocompatability Testing, Munksgaard. – Copenhagen, 1972. – P. 493–499.
378. Jeannet M., Schapira M., Magnin C. Mise en évidence d’anticorps lymphocytotoxiques dirigés contre les antigènes A et B contre des antigènes d’histocompatibilite non HL-A // Schweiz. Med. Wochenschr. – 1974. – V. 104. – P. 152.
379. Jesse J.K., Sheek K.J. Anti-Le b implicated in hemolytic transfusion reaction – a rare occurrence // Transfusion. – 2000. – V. 40. – Suppl. – SP298.
595
395. Johnson P.H., Yates A.D., Watkins W.M. Human salivary fucosyltransferases: evidence for two distinct α-3-L-fucosyltransferase activities one of which is associated with the Lewis blood group Le gene // Biochem. Biophys. Res. Commun. – 1981 – V. 100. – P. 1611–1618.
396. Jordal K. The Lewis blood group Le a in adults // Danish Med. Bull. – 1957. – V. 4. –
210–217.
397. Jordal K. The Lewis blood groups in children // Acta Path. Microbiol. Scand. –1956. –
39. – P. 399–406.
2 Jordal K. The Lewis factors Le b and Le x and a family series tested by anti-Le a, anti-Le b, and anti-Le x // Acta Path. Microbiol. Scand. – 1958. – V. 42. – P. 269–284.
3 Jordal K., Lyndrup S. The distribution of C-D and Le a in 1,000 mother-child combinations
V.Acta. Path. Microbiol. Scand. – 1952. – V. 31. – P. 476–480.
4 Judd W.J. Methods in Immunohematology. – 2-nd ed. – Montgomery Scientific Publications, 1994. – 476 p.
5 Judd W.J., Steiner E.A., Friedman B.A., Oberman H.A. Anti-Le a as an autoantibody in the serum of a Le(a −b + ) individual // Transfusion. – 1978. – V. 18. – P. 436–440.
6 Kaizu T., Levery S.B., Nudelman E. et al. Novel fucolipids of human adenocarcinoma: monoclonal antibody specific for trifucosyl Le y(III3FucV3FucVI2FucnLc6) and a possible three-dimensional epitope structure // J. Biol. Chem. – 1986. – V. 261. – P. 1254–11258.
7 Kaladas P.M., Kabat E.A., Shibata S., Goldstein I.J. Immunochemical studies on the binding specificity of the blood group Le b specific lectin Griffonia simplicifolia IV // Arch. Biochem. Biophys. – 1983. – V. 223. – P. 309–318.
8 Kannagi R., Nudelman E., Levery S.B., Hakomori S.I. A series of human erythrocyte glycosphingolipids reacting to the monoclonal antibody directed to a developmentally regulated antigen, SSEA-1 // J. Biol. Chem. – 1982. – V. 257. – P. 14865–14878.
9 Kerde C., Brunk R., Fünfhausen G., Prokop O. Ǜber die Herstellung von Anti-Lewis-seren an capra hircus L // Z. Immun. Forsch. – 1960. – V. 119. – S.462–468.
10 Kerr M.A., Stocks S.C. The role of CD15-(Le x)-related carbohydrates in neutrophil adhesion
V.Histochem. J. – 1992. – V. 24. – P. 811–826.
11 Kissmeyer-Nielsen F. Irregular blood group antibodies in 200,000 individuals // Scand. J. Haemat. – 1965. – V. 2. – P. 331–342.
12 Ko A.I., Dräger U.C., Harn D.A. A Schistosoma mansoni epitope recognized by a protective monoclonal antibody is identical to the stage-specific embryonic antigen 1 // Proc. Nat. Acad. Sci. USA. – 1990. – V. 87. – P. 4159–4163.
13 Koda Y., Kimura H., Mekada E. Analysis of Lewis fucosyltransferase genes from the human gastric mucosa of Lewis-positive and Lewis-negative individuals // Blood. – 1993. – V. 82. –
2915–2919.
14 Kornstad I. Anti-Le b in the serum of Le(a +b −) and Le(a −b −) persons: absorption studies with erythrocytes of different ABO and Lewis phenotypes // Vox Sang. – 1969. – V. 16. –
124–129.
15 Krieger V.I., Simmons R.T. The second example of anti-Lewis serum found in Australia // Med. J. Aust. – 1949. – V. 1. – P. 85–86.
16 Kukowska-Latallo J.F., Larsen R.D., Nair R.P., Lowe J.B. A cloned human cDNA determines expression of a mouse stage-specific embryonic antigen and the Lewis blood group α(1,3 / 1,4) fucosyltransferase // Genes Dev. – 1990. – V. 4. – P. 1288–1303.
17 Lamm L.U., Kissmeyer-Nielsen F., Henningsen K. Linkage and association studies of two phosphoglucomutase loci (PGM1 and PGM3) to eighteen other markers. Analysis of the segregation at the marker loci // Human Heredity. – 1970. – V. 20. – P. 305–318.
18 Lawler S.D. Blood group substances in human milk // Proc. 7-th Congr., Europ. Soc. Haemat. – London 1959, part II, 1960. – P. 1219–1222.
19 Lawler S.D., Marshall R. Lewis and secretor characters in infancy // Vox Sang. – 1961. –
6. – P. 541–554.
596
433. Lawler S.D., Marshall R. Significance of the presence of Lewis substances in serum during infancy // Nature, London. – 1961. – V. 190. – P. 1020.
434. Lawler S.D., Marshall R., Roberts D.F. The Lewis and secretor characters in the Fulani and Habe // Ann. Hum. Genet. – 1960. – V. 24. – P. 271–282.
435. Le Pendu J., Fredman P., Richter N.D. et al. Monoclonal antibody 101 that precipitates the glycoprotein receptor for epidermal growth factor is directed against the Y antigen, not the H type 1 antigen // Carbohydr. Res. – 1985. – V. 141. – P. 347–349.
436. Levery S.B., Nudelman E.D., Andersen N.H., Hacomori S.I. 1H-n.m.r. analysis of glycolipids possessing mono- and multi-meric X and Y haptens: characterization of two novel extended Y structures from human adenocarcinoma // Carbohydr. Res. – 1986. – V. 151. – P. 311–328.
437. Levine P., Celano M. The antigenicity of Lewis (Le a) substance in saliva coated on to tanned red cells // Vox Sang. – 1960. – V. 5. – P. 53–61.
438. Lewis M., Kaita H., Chown B. The blood groups of a Japanese population // Amer. J. Hum. Genet. – 1957. – V. 9. – P. 274–283.
439. Ley K., Bullard D.C., Arbones M.L. et al. Sequential contribution of L- and P-selectin to leukocyte rolling in vivo // J. Exp. Med. – 1995. – V. 181. – P. 669–675.
440. Lin M., Shieh S.H. Postnatal development of red cell Le a and Le b antigens in Chinese infants // Vox Sang. – 1994. – V. 66. – P. 137–140.
441. Linnet-Jepsen P., Galatius-Jensen F., Hauge M. The inheritance of the Gm serum groups // Acta Genet. – 1958. – V. 8. – P. 164–196.
442. Lodge T.W., Usher A. Lewis blood group substances in seminal fluid // Vox Sang. – 1962. –
// 7. – P. 329–333.
443. Lowe J.B., Kukowska-Latallo J.F., Nair R.P., Larsen R.D. Molecular cloning of a human fucosyltransferase gene that determines expression of the Lewis x and VIM-2 epitopes but not ELAM-1 dependent cell adhesion // J. Biol. Chem. – 1991. – V. 266. – P. 17467–17477.
444. Luscinskas F.W., Ding H., Lichtman A.N. P-selectin and vascular cell adhesion molecule 1 mediate rolling and arrest, respectively, of CD4 + lymphocytes on tumor necrosis factor alpha-activated vascular endothelium under flow // J. Exp. Med. – 1995. – V. 181. –
// 1179–1186.
442. Majuri M., Niemelä R., Tiisala S. et al. Expression and function of α2,3-sialyl- and α1,3 / 1,4-fucosyltransferases in colon adenocarcinoma cell lines: role in synthesis of E-selectin counter-receptors // Int. J. Cancer. – 1995. – V. 63. – P. 551–559.
443. Mäkelä O., Mäkelä P. Le b antigen. Studies on its occurrence in red cells, plasma, and saliva // Ann. Med. Exp. Biol. Fenn. – 1956. – V. 34. – P. 157–162.
444. Mäkelä O., Mäkelä P.H., Kortekangas A. In vitro transformation of the Lewis blood groups of erythrocytes // Ann. Med. Exp. Fenn. – 1967. – V. 45. – P. 159–164.
445. Marcus D.M., Bastani A., Rosenfield R.E., Grollman A. P. Studies of blood group substances. II. Hemagglutinating properties of caprine antisera to human Le a and Le b blood group substances // Transfusion. – 1967. – V. 7. – P. 277–280.
446. Marcus D.M., Cass L.E. Glycosphingolipids with Lewis blood group activity: uptake by human erythrocytes // Science. – 1969. – V. 164. – P. 553–555.
447. Marcus D.M., Grollman A.P. Studies of blood group substances. I. Caprine precipitating antisera to human Le a and Le b blood group substances // J. Immunol. – 1966. – V. 97. –
// 867–875.
448. Martin S.L., Edbrooke M.R., Hodgman T.C. et al. Lewis X biosynthesis in Helicobacter pylori. Molecular cloning of an α(1,3)-fucosyltransferase gene // J. Biol. Chem. – 1997. –
P. 272. – P. 21349–21356.
482. Matson G.A., Coe J., Swanson J. Hemolytic transfusion reaction due to anti-Le a agglutinin // Blood. – 1955. – V. 10. – P. 1236–1240.
483. Matsuzawa S. Two incomplete agglutinins associated with anti-Le a in rabbit antisera against gum arabic // Vox Sang. – 1967. – V. 13. – P. 218–224.
597
2 Mayrn W.R., Mayr D. A lymphocytotoxic antibody associated with ABO blood group and ABH secretor status // J. Immunogenet. – 1974. – V. 1. – P. 43–48.
3 McConnell R.B. Lewis blood group substances in body fluids // Paper read at the 2-nd International Conference of Human Genetics, 1961.
4 Merrild-Hansen B., Munk-Andersen G. Haemolytic transfusion reaction caused by anti-Le a // Vox Sang. – 1957. – V. 2. – P. 109–113.
5 Miller E.B., Rosenfield R.E., Vogel P. et al. The Lewis blood factors in American Negroes // Amer. J. Phys. Anthrop. – 1954. – V. 12. – P. 427–444.
6 Miller E.B., Rosenfield R.E., Vogel P. On the incidence of some of the new blood agglutinogens in Chinese and Negroes // Amer. J. Phys. Anthrop. – 1951. – V. 9. – P. 115–126.
7 Miller-Podraza H., Abul Milh M., Teneberg S., Karlsson K. A. Binding of Helicobacter pylori to sialic acid-containing glycolipids of various origins separated on thin-layer chromatograms // Infect. Immun. – 1997. – V. 65. – P. 2480–2482.
8 Miller-Podraza H., Milh M.A., Bergström J., Karlsson K.A. Recognition of glycoconjugates by Helicobacter pylori: an apparently high-affinity binding of human polyglycosylceramides, a second sialic acid-based specificity // Glycoconj. J. – 1996. – V. 13. – P. 453–460.
9 Mohr J. Genetics of fourteen marker systems: associations and linkage relations // Acta Genet. – 1966. – V. 16. – P. 1–58.
10 Mohr J. A Study of Linkage in Man // Munksgaard, Copenhagen, 1954. – P. 119.
11 Mollicone R., Reguigne I., Fletcher A. et al. Molecular basis for plasma α(1,3)-fucosyltransferase gene deficiency (FUT6) // J. Biol. Chem. – 1994. – V. 269. – P. 12662– 12671.
12 Mollicone R., Reguigne I., Kelly R. et al. Molecular basis for Lewis α(1,3 / 1,4)-fucosyltransferase gene deficiency (FUT3) found in Lewis-negative Indonesian pedigrees // J. Biol. Chem. – 1994. – V. 269. – P. 20987–20994.
13 Mollison P.L., Engelfriet P., Contreras M. Blood Transfusion in Clinical Medicine. –10-th ed. – Oxford: BSP, 1997. – 1033 p.
14 Monteiro M.A., Chan K.H.N., Rasko D.A. et al. Simultaneous expression of type 1 and type 2 Lewis blood group antigens by Helicobacter pylori lipopolysaccharides // J. Biol. Chem. – 1998. – V. 373. – P. 11533–11543.
15 Morgan W.T.J. A contribution to human biochemical genetics; the chemical basis of blood group specificity // Proc. Roy. Soc., B. – 1960. – V. 151. – P. 308–347.
16 Mourant A.E. A ‘new’ human blood group antigen of frequent occurrence // Nature. – 1946. – V. 158. – P. 237–238.
17 Munro J.R., Schachter H. The presence of two GDP-L-fucose:glycoprotein fucosyltransferases in human serum // Arch. Biochem. Biophys. – 1973. – V. 156. – P. 534–542.
18 Nielsen L.S., Eiberg H., Mohr J. Another case of lymphoytotoxic antibody with blood group A1 Le b and A Le d associated specificity // Tissue Antigens. – 1983. – V. 21. – P. 177–183.
19 Nishihara S., Narimatsu H., Iwasaki H. et al. Molecular genetic analysis of the human Lewis histo-blood group system // J. Biol. Chem. – 1994. – V. 269. – P. 29271–29278.
20 Nishihara S., Yazawa S., Iwasaki H. et al. α(1,3 / 1,4)fucosyltransferase (FucT-III) gene is inactivated by a single amino acid substitution in Lewis histo-blood type negative individuals // Biochem. Biophys. Res. Commun. – 1993. – V. 196. – P. 624–631.
21 Nomura A., Stemmermann G.N., Chyou P.H. et al. Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii // N. Engl. J. Med. – 1991. – V. 325. – P. 1132– 1136.
22 Nudelman E., Fucushi Y., Levery S.B. et al. Novel fucolipids of human adenocarcinoma: disialosyl Le a antigen (III4FucIII6NeuAcIV3NeuAcLc4) of human colonic adenocarcinoma and the monoclonal antibody (FH7) defining this structure // J. Biol. Chem. – 1986. – V. 261. – P. 5487–5495.
598
488. Oriol R., Cartron J.P., Cartron J., Mulet C. Biosynthesis of ABH and Lewis antigens in normal and transplanted kidneys // Transplantation. – 1980. – V. 29. – P. 184–188.
489. Oriol R., Danilovs J., Lemieux R.U. et al. Lymphocytotoxic definition of combined ABH and Lewis antigens and their transfer from sera to lymphocytes // Hum. Immunol. – 1980. – V. 1. – P. 195–205.
490. Oriol R., Le Pendu J., Mollicone R. Genetics of ABH, H, Lewis, X, and related antigens // Vox Sang. – 1986. – V. 51. – P. 161–171.
491. Orntoft T.F., Holmes E.H., Johnson P. et al. Differential tissue expression of the Lewis blood group antigens: enzymatic, immunohistologic, and immunochemical evidence for Lewis a and antigen expression in Le(a −b −) individuals // Blood. – 1991. – V. 77. –
1389–1396.
492. Orntoft T.F., Vestergaard E.M., Holmes E. et al. Influence of Lewis α1-3 / 4-L-fucosyltransferase (FUT3) gene mutations on enzyme activity, erythrocyte phenotyping, and circulating tumor marker sialyl-Lewis a leveis // J. Biol. Chem. – 1996. – V. 271. – P. 32260–32268.
493. Park M.S., Oriol R., Nakata S. et al. ABH and Lewis antigens on lymphocytes: screening of pregnant women’s sera with the B-cell cytotoxicity test // Transplant. Proc. – 1979. –
W. 11. – P. 1947–1949.
528. Parsonnet J., Friedman G.D., Vandersteen D.P. et al. Helicobacter pylori infection and the risk of gastric carcinoma N // Engl. J. Med. – 1991. – V. 325. – P. 1127–1131.
529. Parsonnet J.H., Hansen S., Rodriguez L. et al. Helicobacter pylori infection and gastric lymphoma // N. Engl. J. Med. – 1994. – V. 330. – P. 1267–1271.
530. Peterson E.T., Chisholm R. A hemolytic transfusion reaction due to anti-Le a // Proc. 6-th Congr. Int. Soc. Blood Transf., 1958. – P. 59–62.
531. Placuska T., Koscielak J. α 1→2 Fucosyltransferase of human bone marrow // FEBS Lett. – 1974. – V. 41. – P. 348–351.
532. Polley M.J., Mollison P.L. The role of complement in the detection of blood group antibodies: special reference to the antiglobulin test // Transfusion, Philad., 1961. – V. 1. – P. 9–22.
533. Price Evans D.A., Donohoe W.T.A., Bannerman R.M. et al. Blood group gene localization through a study of mongolism // Ann. Hum. Genet. – 1966. – V. 30. – P. 49–67.
534. Prieels J.P., Monnom D., Dolmans M. et al. Co-purification of the Lewis blood group N-acetylglucosaminide α1→4 fucosyltransferase and an N-acetylglucosaminide α1→3 fucosyltransferase from human milk // J. Biol. Chem. – 1981. – V. 256. – P. 10456–10463.
535. Prohaska R., Schenkel-Brunner H., Tuppy H. Enzymatic synthesis of blood-group Lewis-specific glycolipids // Eur. J. Biochem. – 1978. – V. 84. – P. 161–166.
536. Race R.R., Sanger R. Blood Groups in Man. – 6-th ed. – Oxford: BSP, 1975. – P. 323–349.
537. Ramsey G., Fryer J.P. et al. Lewis(a −b −) red blood cells phenotype in patients undergoing evaluation for small intestinal transplantation // Transfusion. – 2000. – V. 40. – Suppl. – SP 293.
538. Rosenfield R.E., Haber G.V., Kissmeyer-Nielsen F. et al. Ge, a very common red-cell antigen
//Brit. J. Haemat. – 1960. – V. 6. – P. 344–349.
539. Sakamoto J., Watanabe T., Tokumaru T. et al. Expression of Lewis a, Lewis b, Lewis x, Lewis y, sialyl-Lewis a, and sialyl-Lewis x blood group antigens in human gastric carcinoma and in normal gastric tissue // Cancer res. – 1989. – V. 49. – P. 745–752.
540. Salmon C., Malassenet R. Considerations sur les anticorps anti-Lewis et pourcentage des differents phenotypes Lewis chez les donneurs de sang de Paris // Rev. Hemat. – 1953. – V.8. – P. 183–188.
541. Sanger R., Race R.R. The Lutheran-secretor linkage in Man: support for Mohr’s findings // Heredity. – 1958. – V. 12. – P. 513–520.
542. Schenkel-Brunner H. Human Blood Groups. Chemical and Biochemical Basis of Antigen Specificity. – 2-nd. ed. – Wien, NY: Springer-Verlag, 2000. – P. 184–247.
599
2 Schenkel-Brunner H., Chester M.A., Watkins W.M. α-L-Fucosyltransferases in human serum from donors of different ABO, secretor, and Lewis blood group phenotypes // Eur. J. Biochem. – 1972. – V. 30. – P. 269–277.
3 Schenkel-Brunner H., Hanfland P. Immunochemistry of the Lewis blood-group system.
// Studies on the molecular basis of the Le x property // Vox Sang. – 1981. – V. 40. –
// 358–366.
541. Seman M.J., Chalmers D.G., Franks D. Siedler: an antibody which reacts with A1Le(a −b + ) red cell // Vox Sang. – 1968. – V. 15. – P. 25–30.
542. Shen L., Grollman E. F., Ginsburg V. An enzymatic basis for secretor status and blood group substance specificity in humans // Proc. Nat. Acad. Sci. USA. – 1968. – V. 59. – P. 224–230.
543. Shibata S., Goldstein I.J., Baker D. A. Isolation and characterization of a Lewis b-active lectin from Griffonia simplicifolia seeds // J. Biol. Chem. – 1982. – V. 257. – P. 9324–9329.
544. Smith E.L., McKibbin J.M., Karlsson K.A. et al. Characterization of human intestinal fucolipid with blood group Le a activity // J. Biol. Chem. – 1975. – V. 250. – P. 6059–6064.
545. Sneath J.S., Sneath P.H.A. Adsorption of blood-group substances from serum on to red cells. Brit // Med. Bull. – 1959. – V. 15. – P. 154–157.
546. Sneath J.S., Sneath P.H.A. Transformation of the Lewis groups of human red cells // Nature, London. – 1955. – V. 176. – P. 172.
547. Solter D., Knowles B.B. Monoclonal antibody defining a stage-specific mouse embryonic antigen (SSEA-1) // Proc. Nat. Acad. Sci. USA. – 1978. – V. 75. – P. 5565–5569.
548. Spitalnik S., Cowles J., Cox. M.T., Blumberg N. Detection of IgG anti-Lewis a antibodies in cord sera by kintic ELISA // Vox Sang. – 1985. – V. 48. – P. 235–238.
549. Spohr U., Hindsgaul O., Lemieux R.U. Molecular recognition. II. The binding of the Lewis b and Y human blood group determinants by the lectin IV of Griffonia simplicifolia // Can.
P. Chem. – 1985. – V. 63. – P. 2644–2652.
550. Srivatsan J., Smith D.F., Cummings R.D. The human blood fluke Schistosoma mansoni synthesizes glycoproteins containing the Lewis X antigen // J. Biol. Chem. – 1992. – V. 267. –
K. 20196–20203.
548. Steplewski Z., Blaszczyk-Thurin M., Lubeck M. et al. Oligosaccharide Y specific monoclonal antibody and its isotype switch variants // Hybridoma. – 1990. – V. 9. – P. 201–210.
549. Stratton F. Complement-fixing blood group antibodies with special reference to the nature of anti-Le a // Nature, London. – 1961. – V. 190. – P. 240–241.
550. Sturgeon P., Arcilla M.B. Studies on the secretion of blood group substances. I. Observations on the red cell phenotype Le(a +b +x + ) // Vox Sang. 1970. – V. 18. – P. 301–322.
551. Sturgeon P., Arcilla M. Секреция групповой субстанции: исследование эритроцитов фенотипа Le(a +b + ) (предварительное сообщение) // ХII Междунар. конгр. по перелив. крови, 1969. –
М.: Медицина, 1972. – C. 290–291.
552. Suh I.B., Ma K.R., Whang M.W. et al. Penotype of the Lewis blood group and genotype of the fucosyltransferase II and III gene // Transfusion. – 2003. – V. 43. – Suppl. – SP179.
553. Swanson J., Crookston M.C., Yunis E. et al. Lewis substances in a human marrow-transplantation chimaera // Lancet. – 1971. – V. i. – P. 396.
554. Takada A., Ohmori K., Yoneda T. et al. Contribution of carbohydrate antigens sialyl Lewis-A and sialyl Lewis-X to human cancer cells to vascular endothelium // Cancer Res. – 1993. –
P. 53. – P. 354–361.
555. Taki T., Takamatsu M., Myoga A. et al. Glycolipids of metastatic tissue in liver from colon cancer: appearance of sialylated Le x and Le x lipids // J. Biochem. – 1988. – V. 103. – P. 998– 1003.
556. Taylor R.A., Rachkewich R.A., Gare D.J. et al. Effect of pregnancy of the reactivity of lymphocytes with cytotoxic antisera // Transplantation. – 1974. – V. 17. – P. 142–146.
600
В Tegoli J., Cortez M., Jensen L., Marsh W.L. A new antibody, anti-ILe bH, specific for a determinant formed by the combined action of the I, Le, Se, and H gene products // Vox Sang. – 1971. – V. 21. – P. 397–404.
В Teneberg S., Miller-Podraza H., Lampert H. C. J. et al. Carbohydrate binding specificity of the neutrophil-activating protein of Helicobacter pylori // J. Biol. Chem. – 1997. – V. 272. –
О 19067–19071.
В Tetteroo P.A.T., de Heij H.T., van den Eijnden D.H. et al. A GDP-fucose:[Galβ1→4]GlcNAc α1→3-fucosyltransferase activity is correlated with the presence of human chromosome 11 and the expression of the Le x, Le y, and sialyl-Le x antigens in human-mouse cell hybrids // J. Biol. Chem. – 1987. – V. 262. – P. 15984–15989.
В Tilley C.A., Crookston M.C., Brown B.L., Wherrett J.R. A and B and A1Le b substances in glycosphingolipid fractions of human serum // Vox Sang. – 1975. – V. 28. – P. 25–33.
В Ueyama R. Studien über die neuen Typensubstanzen in Sekreten // Jap. J. Med. Sci., VII Social. Med. Hyg. – 1940. – V. 3. – P. 23–25.
В Ueyama R. Üeber das neue Antigen ‘T’ entdeckt im menschlichen Speichel des Nichtausscheiders // Hanzaigaku-Zasshi. – 1939. – V.13. – S. 51–64 (japan).
В Varki A. Selectin ligands // Proc. Nat. Acad. Sci. USA. – 1994. – V. 91. – P. 7390–7397.
В Vos G.H., Comley P. Red cell saliva studies for the evaluation of ABH and Lewis factors among the Caucasians and Aboriginal populations of Westem Australia // Acta Genet. – 1967. – V. 17. – P. 495–510.
В Waheed A., Kennedy M.S., Gerhan S. Transfusion significance of Lewis system antibodies: Report a nationwide survey // Transfusion. – 1981. – V. 21. – P. 542–545.
В Watkins W.M. Biochemistry and genetics of the ABO, Lewis and P blood group systems: Advances in Human Genetics. – 1980. – V. 10. – P. 1–136.
В Wiener A.S., Gordon E.B., Moor-Jankowski J. The Lewis blood groups in man. A review with supporting data on non-human primates // J. Forens. Med. – 1964. – V. 11. – P. 67–83.
В Wu J.T., Olson J., Walker K. Tumor markers CA 19-9 and CA 195 are also useful markers for cystic fibrosis // J. Clin. Lab. Anal. – 1992. – V. 6. – P. 151–161.
В Wyatt J.I., Dixon M.F. Chronic gastritis – a pathogenetic approach // J. Path. – 1988. –
154. – P. 113–124.
у Yamamoto S. Inhibitory activities of substances present in plant seeds and fruits against anti-Lewis agglutinins // J. Immunogenet. – 1982. – V. 9. – P. 137–141.
у Yazawa S., Furukawa K. α-L-Fucosyltransferases related to biosynthesis of blood group substances in human saliva // J. Immunogenet. – 1980. – V. 7. – P. 137–148.
у Young W.W., Johnson H.S., Tamura Y. et al. Characterization of monoclonal antibodies specific for the Lewis a human blood group determinant // J. Biol. Chem. – 1983. – V. 258. –
В 4890–4894.
у Yuen C.T., Bezouska K., O’Brien J. et al. Sulfated blood group Lewis a. A superior oligosaccharide ligand for human E-selectin // J. Biol. Chem. – 1994. – V. 269. –
В 595–1598.
601
Глава 10.
Система Duffy
Основные антигены системы Duffy (Даффи) – Fy a и Fy b – являются продук-тами аллельных генов Fy a и Fy b, которые образуют 3 основных фенотипа у лиц белой расы: Fy(a +b −), Fy(a +b + ) и Fy(a −b + ). Еще 1 аллель (Fy x) кодирует син-тез слабовыраженного антигена Fy b. Большинство лиц черной расы имеют фе-нотип Fy(a −b −). Указанный нулевой фенотип встречается крайне редко среди людей других рас.
Антигены Fy3, Fy5 и Fy6 имеют высокую частоту среди европеоидов и мон-голоидов, однако сравнительно редко их выявляют среди негроидов. Антигены Fy3 и Fy6 присутствуют на всех эритроцитах, за исключением Fy(a −b −). Фактор Fy6 определяют с помощью мышиных моноклональных антител. Поликлональные аллогенные антитела к этому антигену не найдены. Антиген Fy5 присутствует одновременно с Fy3. Исключение составляют эритроциты Rhnull, на которых антиген Fy3 имеется, а антиген Fy5 отсутствует (табл. 10.1).
| Таблица 10.1 | |||||
Антигены системы Duffy
Обозначение
Частота (%) среди
Комментарий
IBST
европеоидов
негроидов
ное
Антигены системы Duffy располагаются на гликопротеинах с мол. массой от 35 до 50 кДа, которые выполняют функцию хемокиновых рецепторов, относящихся к G-ассоциированным белкам. Помимо эритроцитов эти гликопротеины присутству-ют на эндотелии венул и клетках некоторых органов. Антигенные различия Fy a / Fy b обусловлены аминокислотной заменой Gly 42 Asp в гликопротеине Fy.
Возникновение фенотипа Fy(a −b −) у негроидов связано с гомозиготностью по молчащему гену Fy – мутации, препятствующей синтезу Duffy-гликопротеина на эритроцитах, но не на других клетках организма.
602
Индивиды Fy(a −b −) устойчивы к инвазии Plasmodium vivax и реже болеют малярией.
Генный локус FY картирован на длинном плече хромосомы 1 в позиции 1q21–q25.
Дата: 2019-02-24, просмотров: 441.