Marsh и соавт. [264] наблюдали 20-дневного ребенка с энтероколитом, вы-званным необычным вариантом Bac. Escherichia coli. Ребенок имел груп-пу крови B(III), в сыворотке содержались антитела анти-А IgM и анти-K IgM. Контакта с эритроцитами K + у ребенка не было, его мать антител анти-K не имела. Когда ребенок выздоровел и указанные бактерии больше не высевались, антитела анти-А и анти-K исчезли. Авторы показали, что препараты из выде-ленных ими бактерий Escherichia coli, нейтрализовали антитела анти-K IgM, а на самих бактериальных клетках обнаруживали K-антиген.
Других патогенных форм кишечной палочки не было выделено из кала детей, содержащих антитела анти-K и имеющих клинические симптомы септицемии [217].
Pereira и соавт. [309] обнаружили антитела анти-k (Cellano) у пациента с ин-фекцией, вызванной Morganella morganii. Антитела относились исключительно
с классу IgA. Авторы высказали суждение, что ранее описанные в литературе естественные анти-K-антитела, диагностированные как IgM только с помощью редуцентов дисульфидных связей, на самом деле могли относиться к IgA.
382
Анти-K-антитела нетрансфузионного происхождения наблюдали у пациен-тов, зараженных:
Mycobacterium tuberculosis (Tegoli и соавт. [368], Kanel и соавт. [221]); Esсherichia coli (Marsh и соавт. [264]);
Enterococcus faecalis (Doelman и соавт. [156]);
Morganella morganii (Pereira и соавт. [309]);
неидентифицированными микроорганизмами, вызвавшими септицемию
(Judd и соавт. [217]);
вирусами, вызвавшими ОРВИ.
Savalonis и соавт. [340] не нашли Kell-антигенов у 23 типов исследованных ими бактерий из рода Сitrobacter, Edwardsiella, Escherichia, Klebsiella, Proteus, Salmonella, Serratia, Shigella. K-подобное вещество содержалось, по-видимому, только в Esсherichia coli штамма О125:В15, высеянного Marsh и соавт. [264] из кала упомянутого выше больного ребенка.
McGinniss и соавт. [278] показали, что эритроциты K −, инкубированные in vitro с разрушенными микроорганизмами Streptococcus faecium, приобретали K-подобный антиген. Трансформации K − в K + не происходило, когда использо-вали целые бактерии.
Следует упомянуть, что аутоантитела анти-Kp b, описанные Manny и соавт.
4. и Brendel и соавт. [112], также были обнаружены авторами у пациентов, перенесших инфекции.
Несмотря на очевидную связь анти-K-антител с бактериальным заражени-ем, описаны люди с анти-K-антителами, у которых не было никаких проявле-
ний инфекций (Morgan, Bossom [287], Clark и соавт. [130].
Генетика
Гены KEL передаются по наследству кодоминантно по тем же законам насле-дования, как другие групповые признаки крови человека – АВО, MNSs, Rh и т. д. Они не сцеплены с полом (хотя частично зависят от хромосомы X) и не меня-ются в течение жизни. При отсутствии какого-либо антигена у родителей у де-тей он также отсутствует.
Присутствие антигенов Kell на эритроцитах (Kell-фенотип) зависит от взаи-модействия двух генов. Один из них (аутосомный ген KEL) кодирует синтез по-липептида Kell, несущего антигены Kell. Он расположен на хромосоме 7 в по-зиции q33–35 рядом с локусом пузырного фиброза [244, 295, 315, 406]. Другой ген (XK) кодирует синтез протеина Kx, который в свою очередь регулирует сте-пень выраженности антигенов Kell на эритроцитах. Этот ген расположен в дру-гом месте – на коротком плече X-хромосомы, в локусе p21 [103, 200].
Имеются сведения, что ген XK находится между локусом мышечной дистро-фии Дюшена и локусом хронического гранулематоза [103, 200], что позволяет понять причинно-следственную связь указанных заболеваний (гранулематоза и фенотипа McLeod) и предрасположенности к ним мужчин.
383
Локус KEL, как указывалось выше, включает 5 групп аллельных генов, а так-же несколько генов пара-KEL, не имеющих аллелей. Пары образуют гены: K / k, Js a / Js b, Wk a / Wk b и K14 / K24. Группа Kр a / Kр b / Kр с содержит 3 аллеля.
Пара-Kell-антигены экспрессированы на эритроцитах независимо от других антигенов Kell: K, k, Kр, Js и т. д. На эритроцитах McLeod они также слабо вы-ражены, как и Kell-антигены. При фенотипе Ko антигены пара-Kell, так же как и Kell, отсутствуют, что указывает на принадлежность обеих групп к одной систе-ме. Как упоминалось выше, антигены пара-Kell и Kell расположены на одном и том же Kell-протеине мембраны эритроцитов.
Уместно еще раз отметить, что гены K и Kр а не могут наследоваться от одного родителя, поскольку никогда не располагаются вместе на одной хромосоме. При исследовании семей не найдено одновременной передачи этих антигенов только от одного из родителей, т. е. гаплотипа KKр а [318]. Ген k менее активен, когда пе-редается с геном Kр а [318], последний подавляет синтез антигена k (Kp a-эффект).
Локализация и организация локуса KEL
выводу о том, что локус KEL расположен на хромосоме 7, пришли Zelinski
10. соавт. [406], Parsons и соавт. [303]. Авторы обнаружили связь между генами KEL и геном пролактининдуцирующего протеина (PIP), который локализован на хромосоме 7 в позиции q32-q36.
Purohit и соавт. [315] нашли, что локус KEL связан с геном цистофиброза, ко-торый, так же как PIP, локализован на длинном плече хромосомы 7.
Последующие исследования, проведенные Murphy и соавт. [295], Lee и со-авт. [244] с помощью методов гибридизации in situ и метода клонирования Kell-специфической кДНК, подтвердили расположение генов KEL на участке 7q33–7q35.
Генный комплекс Kell включает 19 экзонов и занимает примерно 21,5 кб (Lee
11. соавт. [242]).
Экзон 1 содержит 5'-нетранслируемую область, кодон метионина 1, иници-ирующий трансляцию, SP1- и GATA-1-связывающие участки. Как полагают Camara-Clayette и соавт. [119], экзон 1 вовлечен в отрицательную регуляцию промотора в неэритроидных тканях.
Экзон 2 кодирует цитоплазматический домен и, возможно, второй иницииру-ющий трансляцию метионин 20.
Экзон 3 кодирует трансмембранную, наиболее короткую часть Kell-полипептида, которая состоит примерно из 20 аминокислотных остатков (см. рис. 5.2).
Экзоны 4–19 ответственны за экстрацеллюлярный, самый протяженный до-мен. Аминокислотная последовательность, придающая Kell-протеину свойства цинкзависимой металлопротеиназы, кодируется экзоном 16, который, по дан-ным Lee и соавт. [242], на 54,5 % идентичен эквивалентному участку гена NEP, кодирующего вазоконстриктор неприлизин.
Lee и соавт. [242] нашли, что 5′-латеральная область от −176 до −1 нуклеоти-да содержит три участка, связывающих GATA-1. По мнению Shivdasani и Orkin
384
[см. 204], GATA-1 является транскрипционным фактором, необходимым для формирования эритроидных тканей.
Мутации в участке связывания GATA-1 приводят к нарушению синтеза на эритроцитах гликопротеина Duffy; эти мутации наблюдают у большинства лю-дей с фенотипом Fy(a −b −). Неизвестно, определяют ли эти мутации отсутствие белка Kell на эритроцитах людей с фенотипом Kо.
Lee и соавт. [242] полагают, что локус KEL регулируется эритроидными фак-торами транскрипции.
| Таблица 5.4 | ||||||
| Организация гена KEL* | ||||||
| Экзон | Кодон | Размер, кб | Кодируемые домены и антигены | |||
| 1 | 5´нто Met1 | 0,34 | ||||
| 2 | 2–27 | 0,29 | Интрацеллюлярный домен | |||
| 3 | 28–74 | 0,26 | Трансмембранный домен | |||
| 4 | 75–133 | −2,6 | K18 | домен | ||
|
| ||||||
| 5 | 134–175 | 0,33 | ||||
| Экстрацеллюлярный | ||||||
|
| ||||||
| 10 | 359–401 | −6 | K23 | |||
| 6 | 176–224 | −3,2 | K14 / K24 / K / k | |||
| 7 | 225–245 | 0,093 | ||||
| 8 | 246–308 | 0,23 | Kp a / Kp b / Kp c; K11 / K17 | |||
| 9 | 309–358 | −1,3 | K22 | |||
| 11 | 402–438 | −1,6 | TOU | |||
| 12 | 439–471 | 0,24 | Экстрацеллюлярныйдомен | |||
|
| ||||||
| 13 | 472–497 | 0,44 | K19, Ul a | |||
| 14 | 498–531 | 0,19 | ||||
| 15 | 532–568 | 0,15 | K12 | |||
| 16 | 569–590 | 0,23 | HELLH | |||
| 17 | 591–647 | 0,35 | Js a / Js b | |||
| 18 | 648–679 | −1,3 | ||||
| 19 | 680–732 3´нто | |||||
α По сводке Dаniels [141], нто – нетранслируемая область.
Эффекты позиции в локусе KEL
Известны 2 позиционных эффекта в локусе KEL, отражающиеся на экспрес-сии Kell-антигенов и особенностях их наследственной передачи: Kp a-эффект и K13-эффект.
385
Kp a -эффект
Allen и Lewis [87], открывшие антиген Kp a и изучившие характер его насле-дования, обратили внимание на тот факт, что антиген k слабо выражен у некото-рых членов семьи, имевших фенотип Kp(a + ). На эритроцитах K −k + wKp(a +b −) антиген k был подавлен до такой степени, что его присутствие могло остаться незамеченным, если бы не были применены сильные анти-k-сыворотки. На эри-троцитах K −k + Kp(а −b + ) экспрессия k была в нормае.
Объяснение этому феномену нашли Race и Sanger [318], показав, что угнета-ющее действие гена Kp a распространяется не только на k, но и на другие антиге-ны системы Kell.
с более поздних исследованиях было подтверждено супрессирующее влияние гена Kp a на другие гены KEL, расположенные в позиции цис. Опубликованные данные свидетельствуют об уменьшенной экспрессии антигенов Ku (Ford [164]), Js b (Ford [164], Tippett [370]), K18 (Barrasso и соавт. [98]), K19 (Sabo и соавт. [337]), TOU (Marsh и соавт. [272]) и других часто встречающихся антигенов Kell и
пара-Kell (Walsh и соавт. [390]).
Manny и соавт. [256] сообщили, что экспрессия антигена K22 на эри-троцитах Kp(a +b −) снижена по сравнению с эритроцитами Kp(a −b + ). Bar Shany и соавт. [96], напротив, констатировали, что экспрессия антигена K22 на эритроцитах Kp(a +b −) и Kp(a −b + ) одинакова. Подавляющее действие гена Kp a на другие гены KEL не всегда выявляют при обычном серологиче-ском исследовании.
Впоследствии выяснилось, что супрессирующий Kp a-эффект можно от-четливо наблюдать только при одном из трех обязательных условий:
–– гомозиготность по гену Kp a;
–– присутствие гена K в позиции транс; –– присутствие молчащего гаплотипа K о.
Kp a-эффект сильнее проявляется при 3-м варианте, когда лица Kp(a + ) име-ют генотип Kp a / K о [164, 390]. Присутствие гаплотипа K o на противоположной хромосоме позволяет более четко увидеть подавляющее действие гена Kp a на другие гены KEL в Kp а-гаплотипе. Подобно этому подавляющее действие гена Kp a на экспрессию антигена k и других Kell-антигенов легче обнаружить у людей kKp a / KKp b , чем kKp a / kKp b, т. е. когда гены Kp a и K находятся в поло-жении транс.
На рис. 5.3 представлены результаты семейного исследования, демонстриру-ющие супрессивный эффект гена Kp a на ген k. Ослабление антигена k (k + W) на-блюдалось у представителя первого (I м) и второго (II 2) поколения: I м имела генотип Kp a / K o, II 2 – генотип Kp a / K (Kp a транс по отношению к K). У I м все высокочастотные антигены были супрессированы. У других членов семьи анти-гены Kell имели нормальную выраженность.
Tippett [370] установила, что сыворотки анти-k и анти-Js b имели разный титр при титровании 5 образцами эритроцитов Kp(a +b −). Один образец
386
эритроцитов от человека k + Kp(a +b −) Js(a −b + ), второй гаплотип которого был, по-видимому, K o, показывал отчетливо низкий титр; другие 4 образца k + Kp(a +b −) Js(a −b + ), полученные от гомозигот kKp a Js b / kKp a Js b, показали небольшое снижение титра антител анти- k и анти-Js b, что свидетельствова-ло о сниженной экспрессии антигенов k и Js b на эритроцитах гетерозигот K o.
Daniels и соавт. [150], Yazdanbakhsh и соавт. [404] полагают, что Kp a-эффект проявляется только низкой синтезирующей способностью Kp a-аллеля, в ре-зультате чего количество гликопротеинов Kell на эритроцитах снижено. Конформационные изменения в Kell-гликопротеине, которые могли бы препят-ствовать связыванию Kell-антигенов с антителами, не столь выражены.

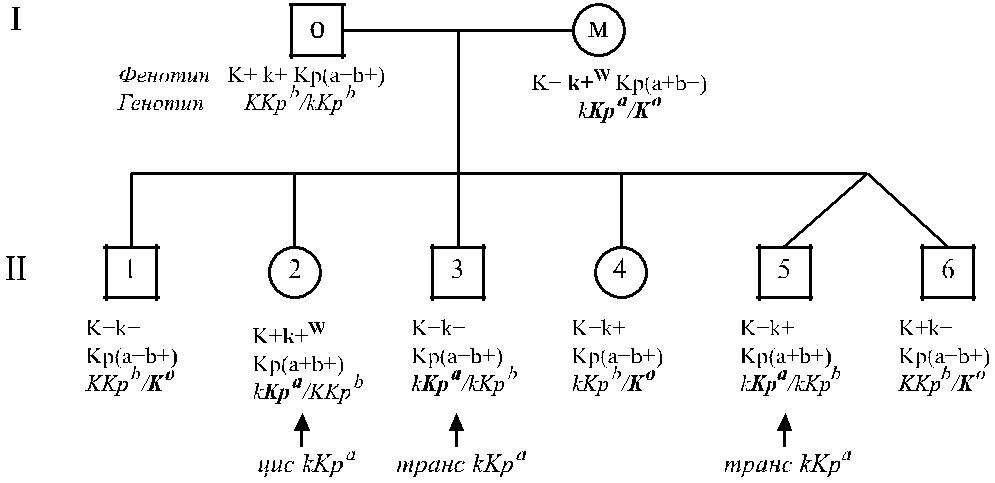
Рис. 5.3. Результаты исследования семьи, показывающие депрессивный эффект Kp a на k (по Walsh и соавт. [390]). Ослабление k наблюдали у I м (Kp a /K o) и II 2 (Kp a /K).
Waheed, Kennedy [385] на модели экспрессии кДНК- конструктов в клет-ках эмбриональной почки человека нашли, что Kp a (Trp 281) замедляет про-движение Kell-гликопротеинов к поверхности клетки, удерживая их на уровне аппарата Гольджи. Для того чтобы обеспечить более эффективное продвиже-ние Kell-гликопротеинов к клеточной поверхности, возникли мутации: часто встречающаяся – Kp b (Arg 281) и редко встречающаяся – Kp c (Glu 281).
Daniels и соавт. [150] описали фенотип Ko, который на самом деле тако-вым не являлся. Несмотря на то что эритроциты этого человека не содер-жали Kell-антигенов, тем не менее они адсорбировали анти-k-антитела, ко-торые затем обнаруживали в элюате. Кроме того, на эритроцитах пробанда отсутствовал антиген Kx, наличие которого является характерным призна-ком Ko- фенотипа. Наконец, 3 детей пробанда были Kp(a +b + ), и маловероят-но, что пробанд имел ген K o. Анализ экзона 8 показал, что пробанд был го-мозиготен по гену Kp a. Авторы отметили также мутации в XK- гене , что по-зволило в итоге диагностировать у пробанда фенотип McLeod. Как считают авторы, Kell-ингибирующий эффект, приведший к Ko-подобному фенотипу,
387
был обусловлен двумя причинами: гомозиготностью по гену Kp a и дефици-том Kx-протеина.
Необходимо отметить, что Kp a-эффект проявляется только в отношении часто встречающихся Kell -антигенов. Редкие антигены Kell (имеющие ча-стоту менее 10 %): K, Js a , Kp a, Kp c и др . – не подвержены ингибиции, по-скольку ген Kp a и гены K, Js a, Kp a, Kp c в одном гаплотипе, в положении цис, не встречаются (см. Ожидаемые, но не встречающиеся гаплотипы KEL).
Kikuchi и соавт. [225] привели данные , показывающие, что в отличие от гена Kp а его редко встречающийся аллель Kp с не влияет на гены KEL, с кото-рыми он находится в положении цис, как это имеет место при Kp a-эффекте. Авторы не отметили подавления экспрессии антигенов k, Js b и других часто встречающихся антигенов Kell и пара-Kell на эритроцитах лиц с фенотипом Kp(а −b −с + ).
K13-эффект
K13-эффект правильнее называть эффектом отсутствия гена K13, посколь-ку гаплотип K13 −, а не гаплотип K13, содержит ген, подавляющий экспрессию других антигенов системы Kell и пара-Kell (см. K13).
Marsh и соавт. [262], впервые обнаружившие человека с фенотипом K13 −, вна-чале полагали, что низкая экспрессия антигенов k, Kp b, Js b, Ku и K12 на эритро-цитах этого человека связана с его гетерозиготностью по гену K о. Эритроциты пробанда сильно реагировали с сывороткой анти-Kx, что свидетельствовало о наличии у этого человека гаплотипа K о. Генотип пробанда соответствовал фор-муле K13 −/K13 −K о. Однако, как показали Kaita и соавт. [220], гетерозиготность по гену K о не могла быть причиной депрессии других Kell-антигенов, посколь-ку люди, являющиеся генетически K о / kKp b Js b, нормально экспрессируют анти-гены k, Kp b и Js b. Таким образом, Marsh и соавт. [262] оставалось сделать един-ственно правильный вывод относительно ослабления антигенов Kell у лиц K13 −,
с именно: низкая экспрессия Kell у лиц K13 − обусловлена антитетичным партне-ром K13, который, будучи в гомозиготной форме и в позиции цис к другим генам KEL, кодирует более слабую, чем в норме, экспрессию антигенов Kell.
людей K13 − слабо выражены антигены K18 (Barrasso [98]), K19 и TOU (Sabo и соавт. [337]).
Вполне вероятно, что случаи ослабления Kell-антигенов, наблюдаемые мно-гими авторами, связаны с гетерозиготностью по K13 −, однако это пока невоз-можно доказать, поскольку отсутствуют сыворотки против указанного гипоте-тического аллеля K13.
Можно также предположить, что K13-эффект никак не связан с антиге-ном K13, а является проявлением пока неизвестного генетического процес-са, приводящего к уменьшению синтеза антигенов Kell, в том числе антиге-на K13, который в этом случае не производится вовсе и его экспрессия соот-ветствует 0.
388
Ожидаемые, но не встречающиеся гаплотипы KEL
Как известно, групповые антигены крови наследуются кодоминантно и не-зависимо друг от друга. Однако существует много исключений, которые ставят под сомнение непреложность этого правила и еще раз подчеркивают огромное разнообразие не только форм групповых антигенов крови, но и способов их на-следственной передачи. Приведем некоторые примеры:
––частичное доминирование (эпистазия) D над C в позиции цис. В серо-логических реакциях это проявляется следующим образом: эритроци-ты лиц CDe / cde (C и D цис) медленнее агглютинируются сывороткой анти-С и агглютинация выражена слабее, чем при тестировании эритро-цитов лиц Cde / cDe (C и D транс);
––ослабление выраженности антигена D (D u) под действием гена C, рас-положенного по отношению к гену D в позиции транс. Этот феномен проявляется в том, что эритроциты лиц CDe / cde реагируют с сыворот-кой анти-D значительно сильнее, чем эритроциты лиц Cde / cDe;
––Kp a-эффект – подавление синтеза антигенов Kell геном Kp a;
––K13-эффект – подавление синтеза антигенов Kell неизвестным геном, присутствующим в гаплотипе K13 −.
Следует упомянуть еще об одном феномене – неравновесном сцеплении, ко-торое проявляется в том, что антигены двух групповых систем предпочтитель-но наследуются вместе. Например, у людей, имеющих группу крови M, анти-ген S встречается в 2 раза чаще, чем у людей, имеющих группу крови N. Среди лиц М + 72 % являются S +, среди N + – 31 % S +. Считается, что ген S близко расположен к гену М, поэтому чаще наследуются вместе с ним, чем с геном N. Неравновесное сцепление генов M и S по сравнению с N и S послужило основа-нием полагать, что антигены MN и Ss представляют собой тесно связанную ан-тигенную систему MNS.
К наследственной передаче антигенов Kell также проявляются свои особен-ности. Помимо Kp a- и K13-эффекта существует еще одна необычная генетиче-ская закономерность, а именно отсутствие Kell-гаплотипов, которые по логике вещей должны присутствовать. Речь идет о гаплотипах, кодирующих два ред-ких антигена Kell и более, например: Kp a K, KJs a, Kp a Js a, KKp c и др. Такие га-плотипы до сих пор не обнаружены.
Фенотипы, несущие два редких антигена, встречаются, например: K +k + Kp(a +b + ), K +k + Js(a +b + ), K +k + Ul(a + )Kp(a −b + ). Однако во всех слу-
чаях семейных исследований [154, 249, 251, 252, 288, 357, 402] установле-но, что лица с фенотипом K +k + Kp(a +b + ) генетически являются KKp b / kKp a, лица с фенотипом K +k + Js(a +b + ) имеют генотип KJs b / kJs a, а лица с фенотипом
K +k + Ul(a + )Kp(a −b + ) – генотип KKp b / kUl a.
Возникает вопрос: почему гены K и Kp a, K и Js a, K и Ul a, а также гены дру-гих редких Kell-антигенов не наследуются по два и более в одном гаплотипе?
До настоящего времени стройной генетической концепции, объясняющей
389
это явление, не предложено. Некоторые авторы разделяют точку зрения Chown о том, что kKp b Js b представляет собой эволюционно более ранний гаплотип, кото-рый в результате единичных мутаций трансформировался в гаплотипы KKp b Js b, kKp a Js b, kKp c Js b и kKp b Js a. Далее логика нарушается, поскольку остальные 5 редких генов: Ul a, Wk a, K23, K24 и K25 – не имеют аллелей. Согласно предпо-ложению Chown, гаплотипы KKp a, KJs a и Kp а Js a могли сформироваться вслед-ствие двойных мутаций, вероятность которых ничтожно мала в связи с редко-стью генов K, Kp а, Kp c, Js a и др. Однако, как полагают Issitt и Anstee [204], с мо-мента открытия редких антигенов Kell выполнено огромное количество иссле-дований, и если бы такие двойные мутации (мутации предыдущих мутаций) су-ществовали, они были бы обнаружены.
Не лишена оснований и другая точка зрения, что антигены системы Kell ко-дируются 10 гаплотипами (рис. 5.4). Один из них – общий (частый), 9 других – редкие. Первый гаплотип (общий) состоит из гена R − (R-минус), кодирующе-го все антигены Kell, за исключением редких. Другие 9 гаплотипов представле-ны одним из редких генов, которые кодируют 1 редкий и все остальные часто встречающиеся антигены.
R −

K
Kp a
Js a
Ul a
Wk a k, Kp b , Js b , 11, 12, 13, 14, 18, 19, 22
Kp c
K23
K24
K25
Рис. 5.4. Гаплотипы KEL. Гаплотип R − производит общие Kell-антигены: k, Kp b, Js b, 11, 12, 13, 14, 18, 19 и 22; гаплотип K – антиген K и общие Kell-антигены; гаплотип Kp a – антиген Kp a и общие Kell-антигены и т. д.
соответствии с этой схемой гаплотипы, содержащие 2 редких антигена и более, исключены. Остается непонятным, почему в локусе KEL отсутствуют генные конверсии и другие формы обмена генетическим материалом между го-мологичными хромосомами, как это имеет место в системе резус. По-видимому,
с этом проявляется своеобразие рассматриваемого генного локуса.
Итак, подавляющее большинство людей гомозиготны по гаплотипу R − и со-ответственно содержат весь набор общих Kell-антигенов: k Kp b Js b 11 12 13 14 18 19 22.
390
Система Kx
Система Kx включает 1 антиген – Kx (ISBT 019001 или XK1).
Redman и соавт. [326] выделили протеин Kx посредством иммунопреципи-тации анти-Kx-антителами и определили его мол. массу, составляющую око-ло 37 кДа. Затем было установлено, что Kx-протеин фосфорилируется и паль-митилируется [120, 121], но не гликозилируется [198, 224]. Он представлен в мембране эритроцитов 10 трансмембранными доменами [198], состоящими из
У аминокислот (рис. 5.5).
Предполагаемая топология Kx-протеина в мембране эритроцита пред-ставлена на рис. 5.1. Белок Kx связан дисульфидной связью через Cis 347 с Cis 72 гликопротеина Kell. Терминальные участки Kx-протеина, N и C, по-гружены в клетку.
По мнению Russo и соавт. [331], комплекс Kx – Kell формируется в эн-доплазматическом ретикулуме и транспортируется к клеточной поверхно-сти. Отсутствие вещества Kx в эритроцитах приводит к уменьшению экс-прессии Kell-антигенов на поверхности клеточной мембраны (фенотипу McLeod).
Система Kx кодируется Х-сцепленным геном, XK , и является самостоятель-ной антигенной системой независимой от Kell, хотя и тесно с ней связанной.
Kx-протеин выражен на эритроцитах лиц с фенотипом Ko сильнее, чем на эритроцитах с обычным Kell-фенотипом [267]. Однако указанная особен-ность , как полагают Lee и соавт. [238], Carbonnet и соавт. [122], обусловле-на не столько количеством Kx-протеина на этих клетках, сколько тем, что в эритроцитах обычного Kell -фенотипа Kx- протеин связан с белком Kell, что мешает ему с той же силой участвовать в реакции агглютинации с сыворот-кой анти-Kx.
У противоположность антигенам Kell антиген Kx не денатурируется дити-отрейтолом (ДТТ) и 2-аминоэтилизотиоурониумбромидом (АЕТ), которые раз-рушают дисульфидные связи. Эритроциты, обработанные ДТТ и АЕТ, приобре-тают серологические свойства эритроцитов Ko с высокой степенью экспрессии
Kx-антигена [102, 111].
Анти-Kx и анти-Km
в пациента Klaas, имевшего фенотип McLeod (см. Антиген KL), развилась гемолитическая трансфузионная реакция, вызванная антителами анти-KL, ко-торые, как вскоре выяснилось, представляют собой смесь двух антител разной специфичности и могут быть отделены друг от друга с помощью адсорбции и последующей элюции (Van der Hart и соавт. [377], Marsh и соавт. [258, 267]).
Антигены, выявляемые с помощью этих антител, получили обозначение Kx и Km, а соответствующие им антитела – анти-Kx и Km.
Анти-Kx-антитела, как установили Marsh и соавт. [267], сильно реагиру-ют с эритроцитами Ko, но не реагируют с эритроцитами McLeod (табл. 5.5).
391
| 1 | MKFPASVLAS VFLFVAETTA | ALSLSSTYRS GGDRMWQALT LLFSLLPCAL VQLTLLFVHR | 60 | |||||||||||||||||||||||
| 61 | 120 | |||||||||||||||||||||||||
| DLSRDRPLVL LLHLLQLGPL | FRCFEVFCIY FQSGNNEEPY VSITKKRQMP KNGLSEEIEK | |||||||||||||||||||||||||
| 121 |
|
|
|
|
|
| 180 | |||||||||||||||||||
| EVGQAEGKLI THRSAFSRAS | VIQAFLGSAP QLTLQLYISV MQQDVTVGRS LLMTISLLSI | |||||||||||||||||||||||||
| 181 | VYGALRCNIL AIKIKYDEYE |
|
|
|
|
| 240 | |||||||||||||||||||
| VKVNRLAYVC IFLWRSFEIA TRVVVLVLFT SVLKTWWVI | ||||||||||||||||||||||||||
| 241 |
|
|
|
|
|
| 300 | |||||||||||||||||||
| ILINFFSFFL YPWILFWCSG | SPFPENIEKA LSRVGTTIVL CFLTLLYTGI NMFCWSAVQL | |||||||||||||||||||||||||
| 301 |
|
|
|
|
| 360 | ||||||||||||||||||||
| KIDSPDLISK SHNWYQLLVY | YMIRFIENAI LLLLWYLFKT DIYMYVCAPL LVLQLLIGYC | |||||||||||||||||||||||||
| 361 |
|
|
|
| 420 | |||||||||||||||||||||
| TAILFMLVFY QFFHPCKKLF | SSSVSEGFQR WLRCFCWACR QQKPCEPIGK EDLQSSRDRD | |||||||||||||||||||||||||
| 421 |
|
| LCSA | |||||||||||||||||||||||
| ETPSSSKTSP EPGQFLNAED | ||||||||||||||||||||||||||
Рис. 5.5. Аминокислотная последовательность Kx-протеина по Ho и соавт. [198].
Подчеркиванием выделены участки фосфорилирования.
в эритроцитами обычного Kell-фенотипа они взаимодействуют слабо. Таким образом, антиген Kx присутствует на эритроцитах Ko, отсутствует на эритроци-тах McLeod, выражен, хотя и слабо, на эритроцитах лиц, имеющих нормальный Kell-фенотип.
Таблица 5.5
Дата: 2019-02-24, просмотров: 395.