Как уже указывалось выше, серологически определяемые антигены А, В и
35 не являются непосредственными продуктами генов. Гены А, В и Н контроли-руют синтез соответствующих трансфераз. В настоящее время строение генов АВО и Н расшифровано (рис. 3.7). Их удалось клонировать и секвенировать. Расшифрована также аминокислотная последовательность А- и В-трансфераз, которые отличаются друг от друга двумя аминокислотами в позициях 266 и 268 (рис. 3.8).

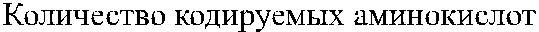

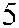
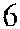
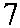
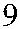
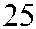
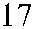
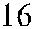
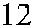
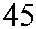
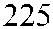
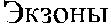
Рис. 3.7. Строение гена АВО.
| MARVLRTLAG | KPKCHALRPM | ILFLIMLVLV | LFGYGVLSPR | SLMPGSLERG | 50 | |
| FCMAVREPDH | LQRVSLPRMV | YPQPKVLTPC | RKDVLVVTPW | LAPIVWEGTF | 100 | |
| NIDILNEQFR | LQNTTIGLTV | FAIKKYVALF | KLFLETAEKH | FMVGHRVHYY | 150 | |
| VFTDQPAAVP | RVTLGTGRQL | SVLEVRAYKR | WQDVSMRRME | MISDFCERRF | 200 | |
| LSEVDYLVCV | DVDMEFRDHV | GVEILTPLFG | TLHPGFYGSS | REAFTYERRP | 250 | |
| QSQAYIPKDE *GDFYYLGGFF | GGSVQEVQRL | TRACHQAMMV | DQANCIEAVW | 300 | ||
| HDESHLNKYL | **GDFYYMGAFF | PEYLWDQQLL | GWPAVLRKLR | FTAVPKNHQA | 350 | |
| LRHKPTKVLS | ||||||
| VRNP | 354 | |||||
Рис. 3.8. Аминокислотная последовательность А-* и B-трансферазы**.
Гены АВО содержат по 1062 пары оснований и кодируют пептиды, состоя-щие из 354 аминокислот (Reid, Lomas-Francis [186]). Секвенирование генов А
8. В позволило установить отличающие их последовательности в 7 кодонах, 4 из них (в позициях 176, 235, 266 и 268) могут быть причиной замены амино-кислот в трансферазах. Секвенирование гена О 1 показало его идентичность с А 1 до нуклеотида 261, с которого рамка считывания нарушается с образовани-ем стоп-кодона (Daniels [87]). Такой аллель кодирует синтез пептида, не облада-ющего какой-либо трансферазной активностью. Возможно также образование
112
нестабильного информационного РНК-транскрипта. Секвенирование гена А 2 выявило делецию одного нуклеотида в кодоне, предшествующем стоп-кодону в аллеле А 1. Делеция приводит к инактивации стоп-кодона и синтезу А-трансферазы, которая содержит 21 аминокислотный остаток дополнительно (Olsson и соавт. [174]). Аллель О, описанный Yamamoto и соавт. [238], в насто-ящее время получил обозначение О 1. Другой аллель О, встречающийся с высо-кой частотой и получивший обозначение O 1v (О 1-вариант), также характеризу-ется делецией в позиции 261. В его присутствии синтез активной трансфера-зы блокируется (Olsson и соавт. [174]). Еще один вариант аллеля О, обозначен-ный как О 2, не содержит делеции в позиции 261, однако отличается от А 1 дву-мя кодонами, и как результат заменами аминокислот Arg 176 Gly и Gly 268 Arg. Замена аргинина на глицин приводит к конформационным изменениям молеку-лы трансферазы и отражается на ее специфической активности.
Синтез АВО-трансфераз контролируют 7 экзонов протяженностью 18 кб, при-чем на долю экзонов 6 и 7 приходится 77 % генетическго материала (см. рис. 3.7). Делеция G 261 в генах O 1 и O 1v выявлена в экзоне 6. Замены нуклеотидов, опре-деляющие различия аллелей А, В и О 2, локализуются в экзоне 7 (табл. 3.14).
Таблица 3.14
Нуклеотидаяя последовательность в экзонах 6 и 7 локуса АВО,
Дата: 2019-02-24, просмотров: 397.