Большая часть антигенных веществ А, В и Н синтезируется в процессе эри-трогенеза за счет активности соответствующих трансфераз. Вместе с тем неко-тороее количество указанных группоспецифических субстанций эритроциты адсорбируют из плазмы. Гликосфинголипиды, присутствующие в плазме и не-сущие вещества Н, А или В, могут встраиваться в мембрану эритроцитов.
Renton и Hancock в 1962 г. обнаружили, что эритроциты группы О, перели-тые реципиенту с группой А, приобретают А-антиген. Указанные эритроциты реагировали с антителами анти-А,В и лектином анти-А1 из Dolichos biflorus. С сывороткой анти-А лиц группы В эти эритроциты не реагировали. Авторы уста-новили, что антитела анти-А,В взаимодействуют с детерминантами, располо-женными на цепях типа 1 и 2, в то время как лектин распознает антигенную де-терминанту, локализованную на цепях типа 2. Подобную картину наблюдали в экспериментах с эритроцитами Oh. После контакта с гликолипидной фракцией плазмы лиц О Le(a −b −) выделителей эритроциты Oh приобретали способность агглютинироваться антителами против цепей 1Н-типа, но не агглютинирова-лись анти-Н-антителами, присутствующими у лиц Oh, а также анти-Н-лектином из Ulex europaeus. Очевидно, что антитела анти-Н, имеющиеся у лиц Oh, подоб-но анти-Н-лектину из Ulex europaeus, распознают А-антигенную детерминанту на цепях 2Н-типа.
Лимфоциты приобретают антигены Н, А и В из плазмы. Эти антигены встра-иваются в мембрану химическим путем в виде гликосфинголипидов, вырабаты-ваемых секреторными клетками. Существует и другое суждение: все групповые АВО-антигенные детерминанты, присутствующие в этх клетках, пассивно ад-сорбированы ими из плазмы. Изогемагглютинины, нередко содержащиеся в ти-пирующих анти-HLA-сыворотках, могут реагировать с АВО-антигенами лим-фоцитов, адсорбированными из плазмы, и искажать результаты лимфоцитоток-сического теста.
На тромбоцитах антигены Н, А и В появляются за счет не только адсорб-ции указанных субстанций из плазмы, но и собственного синтеза. Тромбоциты
108
лиц А2 несут меньше антигена А по сравнению с людьми, имеющими под-группу А1.
Биохимия антигенов АВО и Н
После открытия групповых антигенов возникла проблема установления их структуры. Задачей иммунохимиков в области групп крови человека явля-лось выделить и охарактеризовать структуры, ответственные за специфические свойства веществ, обладающих антигенной активностью, и объяснить, почему они независимы в серологических реакциях.
Выделение антигенов А и В из эритроцитов оказалось непростой задачей. На эритроцитах и других клетках они представлены в водонерастворимой форме. Их удалось выделить экстракцией этанолом. Однако вскоре выяснилось, что эти веще-ства содержатся во многих органах и тканях организма человека, при этом они рас-творимы в воде. Для их выделения к 5 г различных тканей добавляли 25 мл воды, экстракт кипятили в течение 10 мин и затем центрифугировали. Полученный оса-док растворяли в 2,5 мл изотонического раствора натрия хлорида. О присутствии субстанций А и В судили по способности экстрактов угнетать активность анти-А-и / или анти-В-антител (Freidenreich и Hartmann, 1938).
Эти и другие подобные исследования позволили установить, что наиболь-шее количество вещества А и В содержится в секреторных тканях (слизистая оболочка желудка, слюнные железы, жидкость кист яичников) и в меконии. Эти же вещества были выделены из стенок желудков лошадей, коров и свиней. Процедуру чаще выполняли замораживанием – оттаиванием экстрактов с по-следующим растворением высушенного осадка в охлажденном 90 % раство-ре фенола. Фракция, не поддававшаяся растворению, обладала наибольшей ан-тигенной активностью. Высокой степени очистки удавалось добиться ультра-центрифугированием и использованием органических растворителей, напри-мер этанола. Оказалось, что по своей природе группоспецифические вещества А, В и Н являются мукополисахаридами, содержащими приблизительно 85 % углеводов и 15 % белков. Мягкий кислотный гидролиз приводил к исчезнове-нию специфической активности субстрата. При этом высвобождались сахара. Изучение структуры полисахаридов клеточных мембран бактерий подтверди-ло их антигенные различия, обусловленные именно присутствием тех или иных терминальных углеводных группировок.
Существенный прогресс в изучение природы веществ А, В и Н внесли работы Watkins’a и Morgan’a, показавших присутствие анти-Н-подобных агглютининов в сыворотке угря. Последние вызывали агглютинацию эритроцитов человека груп-пы О. Их активность ингибировалась L-фукозой. При последующих исследовани-ях обнаружено, что способность анти-А-лектинов агглютинировать эритроциты А устраняется добавлением в них N-ацетил-D-галактозамина. Анти-В-антитела ней-трализовались D-галактозой соответственно. Эти результаты были подтверждены при использовании экзогликозидаз, выделенных из Trichomonas foetus и Clostridium
109
welchii. Указанные ферменты разрушали вещества А, В и Н. В то же время актив-ность этих ферментов устраняли N-ацетил-D-галактозамин, D-галактоза и L-фукоза соответственно, что указывало на химическую природу группового вещества.
29. настоящее время химическая структура групповых веществ хорошо изуче-
на (рис. 3.6).
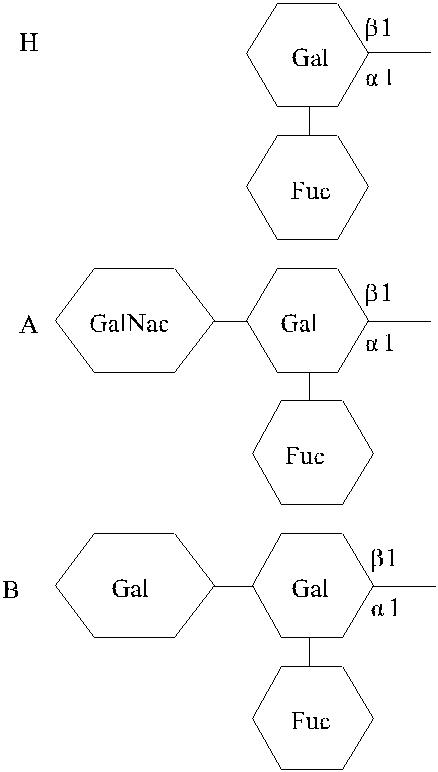
Рис. 3.6. Структура антигенных детерминант Н, А и В.
Антигены систем АВО и Н представляют собой олигосахаридные цепи, связанные с полипептидами (гликопротеины) или церамидами (гликосфинго-липиды).
Выделяют 2 класса олигосахаридных цепей, которые экспрессируют АВН-антигены. Первый из них представлен N-гликанами – разветвленными струк-турами, связанными через аминогруппы аспарагина, и N-ацетилглюкозамин. Второй класс представлен О-гликанами, имеющими простую или сложную структуру, связывание в них происходит через гидроксильные группы серина или треонина также через N-ацетилглюкозамин.
Гликосфинголипиды (углеводные цепи, присоединенные к церамиду) под-разделяют в зависимости от биохимической природы на глобозиды, лактозиды и ганглиозиды.
Основная масса антигенов Н, А и В организма представлена гликопротеина-ми, доля гликосфинголипидов существенно меньше.
110
Антигены Н, А и В формируются трансферазами, которые присоединяют соот-ветствующие моносахариды к цепям-предшественникам.
Н-антиген представлен L-фукозой, присоединенной в позиции С-2 терми-нального галактозного остатка.
А- и В-антигены появляются в результате присоединения к фукозилиро-ванному галактозному остатку (Н-антигену) N-ацетил-D-галактозамина или D-галактозы в позиции С-3. Хотя структура Н-антигена представлена не только фукозой, данная группировка считается иммунодетерминантной, поскольку де-фукозилирование приводит к утрате Н-серологической активности субстрата. Аналогичным образом N-ацетил-D-галактозамин и D-галактозу относят к имму-нодетерминантным структурам, определяющим А- и В-серологическую актив-ность соответственно (Schenkel-Brunner [195]).
Выделяют шесть типов АВН-активных цепей (типы 1 – 6). Цепи типа 1 присутствуют в секретах, плазме и тканях энтодермального происхождения. Цепями типа 2 представлено большинство АВН- активных олигосахаридов на эритроцитах и в тканях экто - и мезодермального происхождения. Тип 3 несет антигенные детерминанты в гликолипидах эритроцитной мембраны и в муци-не у индивидов группы А (Anstee [68]). Тип 4 связан с гликолипидами и пред-ставлен в небольшом количестве на эритроцитах (Anstee [68], Daniels [87], Schenkel-Brunner [195]) . Тип 6 присутствует в виде свободных олигосахари-дов в грудном молоке и моче. Цепи 5- го типа в организме не встречаются, они синтезированы искусственно (Daniels [87], Schenkel-Brunner [195]).
Синтез Н-антигена происходит при участии α1,2-L-фукозилтрансферазы, ко-торая обеспечивает перенос фукозы от гуанозин-дифосфата (ГДФ) к галактоз-ному остатку цепи-предшественника в позиции С-2. Известны 2 типа α1,2-L-фукозилтрансферазы, синтез каждого из них контролируют высокогомологичные, однако генетически независимыме друг от друга локусы FUT1(H) и FUT2(SE). Они расположены на хромосоме 19. Продукты указанных генов (ферменты) обе-спечивают фукозилирование и образование Н-активных структур в различных тканях. FUT1(H) обладает большей аффиностью к цепям типа 2, в то время как FUT2(SE) – к цепям 1-го типа. У подавляющего большинства людей антиген Н присутствует в обязательном порядке, Н-дефицитные фенотипы очень редки.
Н-антиген, образовавшийся в результате действия α1,2-L-фукозилтрансфераз, является субстратом для дальнейшего гликозилирования А- и В-специфическими трансферазами, обеспечивающими присоединение иммунодетерминантных груп-пировок: N-ацетил-D-галактозамина и / или D-галактозы, после чего субстрат при-обретает А- и / или В-антигенные свойства.
Гены, контролирующие А- и В-трансферазы, независимы от локусов FUT1(H) и FUT2(SE), картированы на хромосоме 9, в локус АВО. Последний нередко содержит молчащие аллели О 1, О 2 и др., в присутствии которых синте-за А- и В-трансфераз не происходит. У лиц, гомозиготных по таким аллелям, ве-щество Н не конвертируется далее в антигены А.
111
Присутствие Н-, А- и В-трансфераз в сыворотке крови и на эритроцитах устанавливают с помощью специфических антител, которые нередко образуют-ся после трансплантации органов (Eiz-Vesper и соавт. [96]).
Н. В. Бовин и др. (1990) создали искусственные А- и В-субстанции биохи-мическим синтезом, однако они, несмотря на их структурное сходство с есте-ственным группоспецифическим веществам, не нашли применения, посколь-ку их адсорбционная активность в отношении α- и β-изогемаагглютининов была низкая.
Дата: 2019-02-24, просмотров: 378.