· Межмолекулярные ОВР – реакции, в ходе которых окислитель и восстановитель находятся в разных молекулах
Мп+4О2 + 4НCl-1 →Mn+2Cl2 +Cl2 0+2H2O
· Внутримолекулярные ОВР – реакции, в ходе которых окислитель и восстановитель (атомы разных элементов) находятся в составе одного вещества.
2К +5ClO3-2 = 2KCl-1 + 3O20
· ОВР самоокисления-самовосстановления – реакции входе которых атомы одного и того же элемента, находящиеся в составе одного вещества, являются и окислителями и восстановителями,
Cl 02 +2KOH =KCl-1 + КCl -1O+H2O
Направление окислительно-восстановительных реакций. Можно ли предсказать возможность протекания окислительно-восстановительных реакций? При прохождении темы «химическая термодинамика» мы узнали, что такую возможность предоставляет второй закон термодинамики. Если энергия Гиббса окислительно-восстановительной реакции ниже нуля (∆G˂0), то реакция может протекать в прямом направлении. Если указанная энергия выше нуля (∆G˃0), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция.
Рассмотрим для примера направление реакций взаимодействия магния и палладия с водой. Энергия Гиббса реакции
Мg0 + Н+12О-2(Ж) =Mg +2O-2 +H20
при стандартных состояниях и 298 К равна -94.5 кДж/ моль. Отсюда следует, что окисление магния в этих условиях возможно, а обратная реакция окисления водорода оксидом магния невозможна.
Энергия Гиббса реакции
Pd0 + H+12O-2(ж) = Pd+2O-2 +H20
При стандартных состояниях и 298 К равна + 126,5 кДж/ моль. Отсюда окисление палладия водой при этих условиях невозможно, а обратная реакция окисления водорода оксидом палладия вполне возможна.
Роль окислительно-восстановительных процессов. ОВ процессы играют важную роль в природе и технике. В качестве примеров окислительно-восстановительных процессов, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека. Процессы горения топлива, протекающих в топках котлов тепловых электростанций и в двигателях внутреннего сгорания и реактивных двигателях ракет, являются примерами важных окислительно-восстановительных реакций.
При помощи ОВР получают металлы, органические и неорганические соединения, проводят анализ различных веществ, очищают многие вещества, природные и сточные воды, газовые выбросы электростанций.
Электрохимические процессы
Электрохимическая ячейка (Рис 8.1) состоит из двух электродов –металлических пластин, соединенных через вольтметр и погруженных в растворы их ионов. Если пластину металла поместить в раствор его ионов, то в зависимости от природы металла и концентрации ионов:
- металл может переходить в раствор, при этом пластина заряжается отрицательно, например,
Zn→Zn+2 +2e;
- ионы металла могут разряжаться на пластине, при этом пластина заряжается положительно, например,
Cu+2 +2e→ Cu
Поскольку цинк заряжается отрицательно, а медь положительно, электроны движутся по внешней цепи от цинка к меди.
Электродным потенциалом называется разность потенциалов между пластиной металла и раствором, содержащим его ионы.
Солевой мостик или электрохимический мостик необходим для замыкания цепи между двумя электродами и обеспечения электронейтральности растворов.
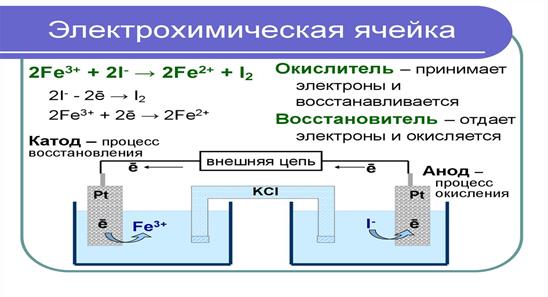
Рис. 8.1 Схема электрохимической ячейки
Анод – электрод, на котором происходит окисление. Анод –отрицательный электрод.
Катод – электрод, на котором происходит восстановление. Катод – положительный электрод.
Окисление на Аноде: Zn→Zn+2 +2e;
Восстановление на катоде: Cu+2 +2e→ Cu
______________
Zn + Cu+2 =Zn+2 +Cu
В гальваническом элементе ток возникает за счет протекания химической окислительно-восстановительной реакции. Первый гальванический элемент – элемент Вольта. Он состоял из медных и цинковых пластин, разделенных сукном, смоченным раствором серной кислоты.
При схематической записи гальванического элемента, заменяющей рисунок, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а проводниками 2-го рода – двумя чертами. Схема элемента Даниэля –Якоби, например, записывается в виде
Zn│Zn+2││Cu+2│Cu
Э..д.с. ячейки (электродвижущая сила) равна разности потенциалов двух соединенных между собой электродов. Э.д.с. характеризует способность электронов к движению во внешней цепи.
| Электрохимические процессы |
↓ ↓
| Гальванические процессы | Электролиз |
↓ ↓
| Превращение энергии химической реакции в электрическую | Превращение электрической энергии в химическую |
При гальванических процессах энергия химической реакции переходит в электрическую, а при электролизе электрическая энергия переходит в химическую.
Согласно гидратационной теории гальванических элементов, при погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются, и в гидратированном состоянии переходят в раствор, который при этом заряжается положительно. В самом металле появляется избыток электронов, придающих ему отрицательный заряд.

Рис.8.1. Гидратация ионов металла при растворении
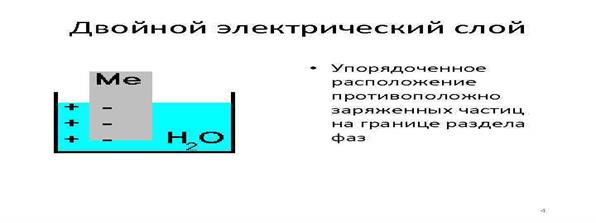
Рис.8.2. Схема возникновения двойного электрического слоя
В результате формирования двойного электрического слоя между металлом и окружающей его водной средой создается некоторая разность потенциалов, которую принято называть электродным потенциалом металла. По мере перехода ионов металла в водную среду увеличивается отрицательный заряд металла и положительный заряд раствора. Поэтому все чаще ионы металла притягиваются обратно на металлическую пластинку. Наступает равновесие:
Ме + mН2О = Ме(Н2О) n+m + nе (19.1)
Из этого уравнения видно, что под влиянием полярных молекул воды происходит разъединение ионов и электронов (растворение), а взаимное притяжение, обусловленное различными зарядами, вновь объединяет их на металле:
Ме ↔Меn+ + ne (19.2)
Равновесное состояние определяется природой металла - способностью его ионов гидратироваться, силой взаимодействия между ионами и их валентными электронами. Каждый металл обладает при равновесии определенным электродным потенциалом. Концентрация ионов металла при равновесии очень мала. Если в водную среду дополнительно ввести некоторое количество ионов металла Меn+ в виде какой-нибудь растворимой соли, то равновесие (19.1) будет смещено влево, что приведет к уменьшению избытка электронов на металлической пластинке. Таким образом, электронный потенциал, а, следовательно, отрицательный заряд металлической пластины, тем меньше, чем больше концентрация ионов металла в раствре.
Возьмем два сосуда. В один из них, содержащий раствор сульфата цинка, опустим цинковый электрод, а в другой, содержащий раствор сульфата меди – медный электрод. Состояние равновесия для электродов выражается уравнениями:
Zn0 ↔ Zn2+ + 2е (19.3)
Сu0 ↔ Сu2+ + 2е (19.4)
Способность растворяться у цинка больше, чем у меди, поэтому и концентрация избыточных электронов на цинковом электроде больше. Если соединить электроды внешним проводником, то электроны с цинковой пластинки будут переходить на медную. Этот переход электронов нарушит равновесие (19.3) и (19.4), и новые ионы цинка перейдут в раствор, а на медном электроде будут восстанавливаться ионы меди из раствора. Происходящие процессы можно выразить электронными уравнениями:
Zn0 – 2е = Zn2+ окислительный процесс
Сu2+ + 2е = Сu0 восстановительный процесс
Однако, следует учесть, что если, сосуды с растворами электролитов не соединены, то в растворе сульфата цинка будут накапливаться положительно заряженные ионы Zn2+, а в растворе сульфата меди – отрицательно заряженные ионы SО42¯, что воспрепятствует дальнейшему течению процесса. Во избежание этого оба раствора соединяют с помощью трубки, заполненной раствором электролита. Это сделает возможной диффузию катионов Zn2+ и анионов SО42¯ из одного сосуда в другой.
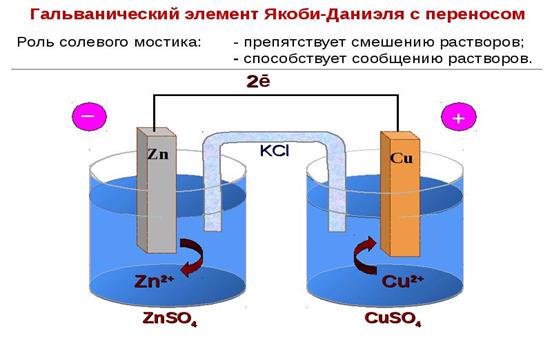
Рис.8.3. Гальванический элемент с применением соединительной трубки
Диффузия ионов может быть достигнута и с помощью пористой перегородки (вместо соединительной трубки). Благодаря диффузии протекают окислительно-восстановительные процессы на электродах. Суммирование этих процессов дает уравнение, совпадающее с уравнением, выражающим взаимодействие цинка с раствором соли меди:
Zn0 + Сu2+ = Zn2+ + Сu0
Различие заключается лишь в том, что при действии цинка на раствор соли меди электроны непосредственно переходят от атомов цинка к ионам меди, а при работе медно-цинкового гальванического элемента электроны совершают путь по внешнему проводнику, т.е. возникает электрический ток.
Гальванический элемент изображается электрохимической схемой:
(-) Zn ׀ Zn2+ ׀׀ Сu2+׀ Cu (+)
Одна черта обозначает поверхность раздела между электродом и раствором, две черты – пористую перегородку или соединительную трубку между растворами. Цинковый электрод, с которого поступают электроны, считается отрицательным, а медный – положительным. Названия электродам даются в соответствии с протекающими на них процессами. Анодом называется электрод, на котором протекает окислительный процесс.
Катодом – электрод, на котором протекает восстановительный процесс. В медно-цинковом гальваническом элементе цинк является анодом, а медь – катодом. Такая схема означает, что цинковый электрод опущен в раствор его соли, а медный электрод – в раствор соли меди. Между растворами расположена пористая перегородка или соединительная трубка.
Чтобы получить гальванический элемент, электроды необязательно погружать в растворы их же солей. Так, в элементе Вольта, цинковый и медный электроды погружены в раствор серной кислоты:
А (-) Zn ׀ Н2SО4 ׀ Сu (+) К
На аноде окисляется цинк:
Zn0 – 2е ↔ Zn2+
На катоде восстанавливаются ионы водорода из кислоты:
2Н+ + 2е ↔ Н2
Таким образом, элемент Вольта дает электрический ток за счет взаимодействия цинка с серной кислотой:
Zn + Н2SО4 = ZnSО4 + Н2
Дата: 2018-12-28, просмотров: 397.