Молекулярность определяется числом частиц, участвующих в элементарном взаимодействии.
Мономолекулярная реакция N2O5 ↔NO2 +NO +O2
Бимолекулярная реакция Н2 + J2↔2 НJ
Тримолекулярная реакция 2NO +Cl2 ↔2NOCl
Уравнение для определения скорости химической реакции называется кинетическим уравнением:
N2(г) + 3Н2(Г) ↔2NH3(г)
Vпр =kпр [N2] [Н2 ]3
Порядок реакции определяют по показателям в кинетическом уравнении.
Реакция Порядок реакции (n)
А→В 1
2А→В 2
А +В→С 2
А +В +С +…+ …→ п
Теоретически порядок реакции предсказать трудно, определяется порядок реакции экспериментально. Порядок реакции зависит от сложности. Если реакция простая, т.е. протекает в одну стадию, то порядок реакции равен сумме стехиометрических коэффициентов: n =∑νi ,где νi коэффициент перед формулой.
Например, если реакция протекает в одну стадию
аА +вВ→сС n =а+в,
То кинетическое уравнение принимает вид: V= k сАа сВв (3.2) и называется законом действующих масс.
Однако в большинстве случаев реакции многостадийны. А для многостадийных реакций порядки реакции по реагентам, как правило, не совпадают с стехиометрическими коэффициентами, а общий порядок не равен сумме порядков реакций. Соответственно, для расчета скорости химической реакции берут основное уравнение 3.1, а не частный случай – закон действующих масс (3.2).
Наиболее часто встречаются реакции первого, второго, иногда – третьего порядка. Реакции более высокого порядка, чем третий неизвестны.
Итак, порядок простой (одностадийной) реакции равен сумме стехиометрических коэффициентов, а сложной (многостадийной) реакции ниже этой суммы.
Реакции нулевого порядка
СаСО3(тв) → СаО (тв) +СО2 (г)
n=0
Vпр= kпр const =k.
Скорость данной гетерогенной реакции не зависит от концентрации, такие реакции называются реакциями нулевого порядка.
Реакции первого порядка
Скорость реакции первого порядка характеризуется кинетическим уравнением
Vпр= kпр c
Vпр= -dc|dt
-dc|dt =kс -dc|с =kdt lnc=-kt +lnc0 ==lnc0 - kt
Концентрация реагентов и скорость реакции первого порядка изменяется по экспоненциальному закону.
Реакции второго порядка
n =2
Н2(г) + J2(г)↔2 НJ(г)
Vпр= kпр c2
Реакции третьего порядка
2NO+O2→NO2
Vпр= kпр c2 *с зависимость скорости реакции от температуры
Правило Вант-Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно правилу Вант-Гоффа при повышении температуры на 10 градусов скорость многих реакций увеличивается в 2-4 раза
V 2 = V 1 γ (Т2-Т1)/10, где V2, V1 – скорости реакций при температурах Т2 и Т1, γ – коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции
( γ энд >γ экз). Для многих реакций γ лежит в пределах 2-4.
Пример. Т2=90º
Т1=20º γ=3 V90=V20 390-20|10= V20 37
Уравнение Аррениуса. В 1889 г шведский ученый С. Аррениус на основании экспериментов вывел уравнение, которое носит его имя.
k = k 0 e ( E a / RT ) , где k – константа скорости реакции; k0 – предэкспоненциальный множитель; e – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа-для химических реакций лежит в пределах 40-400 кДж/моль.
Энергия активации
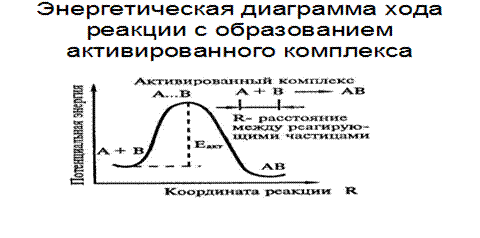
Рис.6.4. Энергетическая диаграмма реакции с образованием активированного комплекса
Каталитические реакции. Катализаторы – это вещества, изменяющие скорость реакции, но сами в реакцию не вступают, т.е. в конце раекции они остаются целыми. Изменение скорости реакции под действием катализаторов называется катализом. Вещества увеличивающие скорость реакции называются катализаторами , уменьшающие ингибиторами.
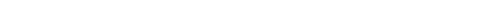
Рис. 6.5. Путь реакции
Таким образом, при участии катализатора энергия реакции уменьшается. Катализ может быть гомогенным и гетерогенным. Гомогенный катализ при котором все находится в одной фазе, гетерогенный катализ когда реагирующие вещества находятся в разных фазах.
Химическое равновесие
аА+ вВ ↔ сС+ dD - реакция обратима
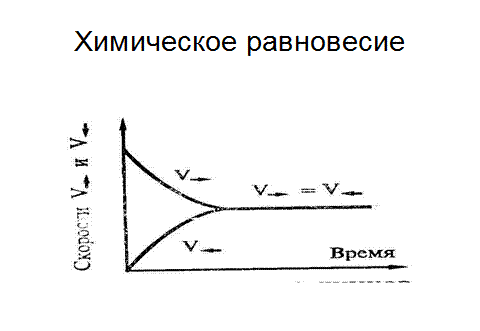
Рис. 6.6. Химическое равновесие
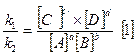 - закон действующих масс
- закон действующих масс
lnКравн = 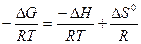
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в таком направлении которое ослабляет внешнее воздействие:
· при увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции.
· при увеличении давления всей системы равновесие смещается в сторону меньшего числа молей газа.
· при увеличении продуктов реакции равновесие смещается в сторону обратной реакции, т.е. исходных веществ.
· для экзотермических процессов для смещения равновесия в сторону прямой реакции необходимо понизить температуру.
· для эндотермических реакций для смещения равновесия в сторону прямой реакции необходимо повысить температуру.
Примеры.
I. Mg CO3(т) ↔MgO(т) + СО2 (г)
∆ H0 =117,4 кДж/моль
Написать выражение для:
1) Vпр реакции
2) Vобр. реакции
1) Vпр реакции =kпр [1]
2) Vобр реакции =kобр [СО2]
Кравн = 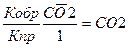
При повышении температуры равновесие смещается вправо
II. Н2 (г) + ½ О2 (г)↔ Н2О(ж)
Q=285,5 кДж/моль
∆ H0 =-285,5 кДж/моль
1) Vпр реакции =kпр [Н2]*[О2]1/2
2) Vобр реакции =kобр [Н2О]
Кравн = 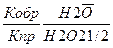
К= 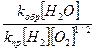
· Увеличиваем концентрацию в 2 раза – во сколько раз увеличится скорость?
Vпр реакции =kпр [2]*[2]1/2 =2*1,4=2,8
· Увеличиваем объем всей системы в 3 раза, концентрация уменьшается в 3 раза
Vпр реакции =kпр [3]*[3]1/2 =3*1,73=5,2 т.е. скорость уменьшится в 5,2 раза
· Повышаем температуру, равновесие смещается в обратную сторону.
N2(г) + Н2 (г) ↔2NH3 + Q ∆ H< 0
Рис.6.7. Зависимость скорости реакции от давления
Лекция №7
Дисперсные системы
Дисперсные системы состоят из дисперсной фазы и дисперсионной среды. В зависимости от размеров дисперсной фазы дисперсные системы делят на группы:
1)взвеси (суспензии, эмульсии), у которых частицы имеют размер 1000 нм(10-6 м) и более;
2)коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм (10-9 до5*10-7 м).
Дисперсные системы также классифицируются по агрегатным состояниям дисперсной фазы и дисперсной среды.
Таблица 7. Типы дисперсных систем
| Тип дисперсной системы | Фазовое состояние | Примеры | |
| Дисперсионной среды | Дисперсной фазы | ||
| Аэрозоль | Газ | Жидкость | Туман и облака |
| Аэрозоль | Газ | Твердая | Дым и пыль |
| Пена | Жидкая | Газ | Взбитые сливки, мыльная пена |
| Эмульсия | Жидкая | Жидкая | Молоко, майонез |
| Золь | Жидкая | Твердая | Краска |
| Твердая эмульсия | Твердая | Жидкая | Масло |
| Гель | Твердая | Жидкая | Желе, агар-агар |
| Твердая пена | Твердая | Газ | Лава, пемза |
| Твердая эмульсия | Твердая | Жидкость | Жемчуг, опал |
| Твердая золь | Твердая | Твердая | Некоторые драгоценные камни (бриллиант, рубин) |
Коллоидные растворы. Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 1 до 500нм. Суммарная поверхность этих частиц громадна. Если предположить, что частица имеет форму шара диаметром 10 нм, то при общем объеме этих частиц 1 см3 они будут иметь площадь поверхности 100м2. Поверхность коллоидных частиц обладают способностью адсорбировать те или иные частицы, в том числе ионы из раствора. Характерной особенностью коллоидных частиц является наличие заряда на их поверхности. Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель.
Существуют лиофильные (гидрофильные) коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не не взаимодействует с ядром частиц.
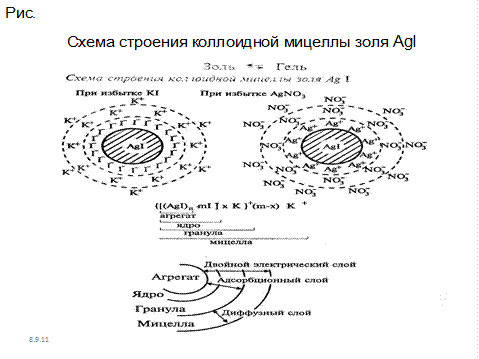
Рис.7.1. Схема строения коллоидной мицеллы золя AgI
Как видно из рисунка, ядро состоит из электронейтрального агрегата частицы с адсорбированными ионами элементов, входящих в состав ядра (в данном случае Ag+ и I-. Кроме этого коллоидная частица имеет противоионы и молекулы растворителя. Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
Оптические свойства коллоидных растворов. Если рассматривать путь светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым. Этот оптический эффект называется конусом Тиндаля (рис. 33/ )
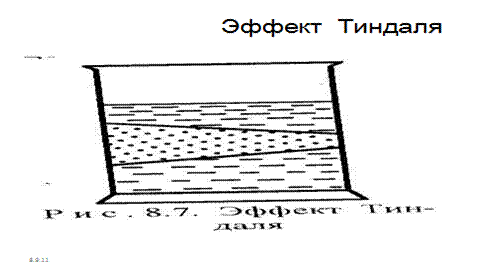
Рис. 7.2. Эффект Тиндаля.
Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное и прокуренное помещение.
Кинетические свойства коллоидных частиц. Для коллоидных растворов характерно движение частиц дисперсной фазы, вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении. Его впервые наблюдал шотландский ботаник Броун. Именно поэтому движение частиц дисперсной фазы в дисперсионной среде называется броуновским.
Изучение броуновского движения показало, что кинетические свойства коллоидных частиц близки к кинетическим свойствам истинных растворов. Однако скороти перемещения частиц в коллоидных растворах меньше, чем в истинных.
Электрические свойства коллоидных растворов. В 1909 г. профессор Московского университета Ф.Ф. Рейсс наблюдал воздействие постоянного электрического тока на диспергированную в воде глину и описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глина) перемещалась к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости (рис.34).
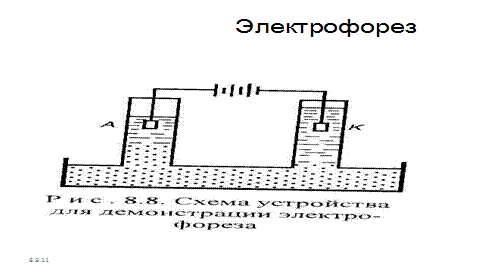
Рис. 7.3. Схема устройства для демонстрации электрофореза
Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса .
Электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела возникает двойной электрический слой ( рис ), состоящий из тонкой адсорбционной части и протяженной диффузной части. Между фазами возникает разность потенциалов, называемая электротермодинамическим потенциалом (фи). Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или ξ (дзета)- потенциалом (рис.7.4).

Рис. 7.4. Двойной электрический слой
Дата: 2018-12-28, просмотров: 496.