| Элементы | Электронная конфигурация | Группа |
| s | ns 1-2 | I А, II А |
| p | ns 1-2 np 1-6 | III А-VI II А |
| d | ns 2 ( n -1) d 1-10 | I В-VI II В |
| f | ns 2 ( n -1) d1(n-2)f4-14 | Актиноиды, лантаноиды |
Периодическая система состоит из периодов, групп и подгрупп. Период последовательный ряд элементов, размещенный в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
Малые периоды содержат 2 и 8 элементов, большие периоды –18-32 элемента, седьмой период остается незавершенным. Группы делятся на главные (основные) и побочные подгруппы. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги). К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, B, S, N, O, F и подгруппа инертных газов. К побочным подгруппам (подгруппам В) принадлежат d и f-элементы.
Периодичность свойств химических элементов
Распределение электронов в атомах влияют на многие свойства атомов (размер радиуса, степень окисления, энергия ионизации, сродство к электрону, электроотрицательность).
Атомные радиусы
В расчетах используется эффективный или кажущийся радиус, т.к. атомы не имеют строго определенных границ. Это обусловлено волновой природой электронов. Чем больше радиус, тем слабее удерживаются внешние электроны в атомах и, наоборот, с уменьшением радиуса электроны больше притягиваются к ядру.
В группах, с увеличением порядкового номера, т.е. сверху вниз атомный радиус возрастает за счет появления новых электронных уровней.
В периодах с увеличением порядкового номера радиусы ионов уменьшаются, что можно объяснить ростом силы электростатического притяжения электронов с увеличением заряда ядра атомов.
Энергия ионизации – это энергия, которую необходимо затратить для превращения 1 моль атомов в газовой фазе в 1 моль катионов в газовой фазе. Первая энергия ионизации характеризует способность атома отдавать один электрон:
Э – е¯ =Э+
Энергия ионизации (I) характеризует восстановительную способность атома.
Энергия ионизации по периоду растет. Наименьшая энергия ионизации у щелочных металлов, с увеличением заряда ядра увеличивается связь электрона с ядром.
В группах энергия ионизации сверху вниз уменьшается, это связано с увеличением радиуса атома и ослаблением связи электрона с ядром.
Сродство к электрону. Сродство к электрону характеризует способность атома образовывать отрицательно заряженные ионы:
Э + е¯ =Э¯
Наибольшим сродством к электрону обладают р-элементы VII А группы. Для большинства металлов и благородных газов характерны малое даже отрицательное значение сродства к электрону.
Электроотрицательность . ЭО, условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.
Найти самое полярное соединение.
KCl CsCl LiCl NaCl
ЭО (Cl) =2,83
ЭО (К)=0,92 ∆ЭО=1,91
ЭО (Cs )=0,86 ∆ЭО=1,97
ЭО (Li )=0,97 ∆ЭО=1,96
ЭО (Na)=1,01 ∆ЭО=1,82
Таким образом, самое полярное соединение CsCl.
Лекция №2
Химическая связь
Вопросы:
1. Типы химической связи;
2. Механизм образования ковалентной связи;
3. Свойства ковалентной связи: насыщаемость, гибридизация и т.д.
4. Кратность связи: двойная, тройная связь
5. σ, π,δ – связи
6. Пространственная конфигурация молекул
7. Линейные, угловые, пирамидальные, тетраэдрические молекулы
8. Энергия и длина связи
9. Полярная связь
10. Дипольный момент связи молекул
11. Гибридизация: sp1 ,sp2, sp3
12. Метод валентных связей и метод молекулярных орбиталей
13. Ионная связь
14. Межмолекулярные взаимодействия
15. Разновидности ковалентной связи: водородная донорно-акцепторная
16. Комплексные соединения
Химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом. Существует 5 типов химической связи:
1. ковалентная
2. ионная
3. металлическая
4. водородная
5. межмолекулярные взаимодействия (вандер-ваальсовы взаимодействия)
Существуют различные теории, описывающие образование химической связи:
1. Метод валентных связей (ВС)
2. Метод молекулярных орбиталей (МО)
3. Электростатическая теория кристаллического поля
Химическая связь
↓ ↓
 |
| Ковалентная | ионная | металлическая |  водородная водородная
| Силы Ван-дер-Ваальса |
↓
| Неполярная |
| полярная |
Рис. 3.1. Виды химической связи
Ковалентная связь
Связь, образованная путем обобществления электронной пары.
При рассмотрении ковалентной связи, нужно обратиться к электронной теории валентности Дж. Льюиса и В.Коссель,1916 г., которая гласит, что при образовании химической связи атомы стремятся приобрести электронную конфигурацию благородного газа за счет:
· потери или приобретения электронов;
· обобществления электронов
· Правило октета. Каждому атому элемента второго периода требуется для создания устойчивой электронной конфигурации восемь электронов.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода с антипараллельными спинами происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (Рис.3.2).
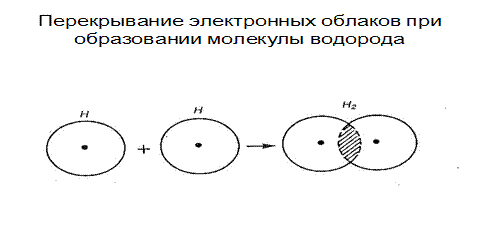
Рис. 3.2. Перекрывание электронных облаков при образовании молекулы водорода
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (Рис. 3.2). При приближении атомов с параллельными спинами энергия возрастает и не происходит образования молекул.
Таким образом, ковалентная связь образуется 2-мя электронами с противоположными спинами, за счет перекрывания электронных орбиталей, происходит обобществление электронов.
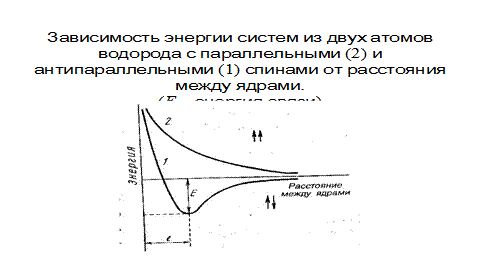
Рис. 3.3. Зависимость энергии систем из двух атомов водорода с параллельными (2) и антипараллельными (1) спинами от расстояния между ядрами. (Е – энергия связи)
Однако, при очень большом сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами я (длина связи l св) при котором система имеет минимальную энергию. При таком состоянии выделяется энергия
Метод ВС базируется на следующих основных положениях:
· химическая связь образуется как результата перекрывания АО с образованием электронных пар
· атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад вносит кулоновские силы взаимодействия частиц.
· Химическая связь в соответствии с принципом Паули лишь при взаимодействии электронов с антипараллельными спинами.
· Характеристика химической связи (энергия, длина, полярность) определяется типом перекрывания АО.
Донорно-акцепторный механизм образования ковалентной связи
Обменный механизм метода ВС не может объяснить образования химических связей в некоторых соединениях. Например, у иона аммония NH4+ образует 4 ковалентные связи с водородом, хотя у азота всего 3 неспаренных электрона.
4-ая ковалентная связь появляется по донорно-акцепторному механизму, согласно которому общая электронная пара появляется за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали (акцептора).
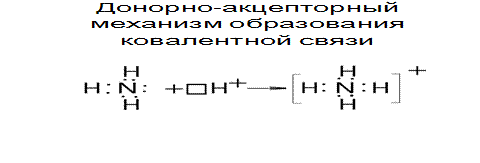
Рис.3.4. Донорно-акцепторный механизм образования ковалентной связи
Таким образом, в ионе аммония азот проявляет валентность, равную 4.
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами что и остальные три ковалентные связи, т.е. в ионе аммония все ковалентные связи равноценны.
Особенностями ковалентной связи являются направленность и насыщаемость.
Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи (стремление атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами). Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах.
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. Число связей обычно в пределах от 1 до 6. Общее число валентных орбиталей в атоме (которые могут быть использованы для образования химических связей), определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Полярность ковалентной связи.
Если ковалентная связь образована одинаковыми атомами, например, Н-Н, О=О, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственноатом получает заряд, называемый эффективным зарядом атома δ-.У второго атома повышается плотность положительного заряда δ+. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда на длину диполя.
μсв =δ lд
Электрический момент диполя имеет единицу измерения кулон на метр (Кл м). Как видно из таблицы 1 , электрический момент диполя растет с увеличением разности ЭО.
Таблица 1. Электрический момент диполя химической связи в молекулах.
Дата: 2018-12-28, просмотров: 430.