Ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями АО в пространстве.
Сигма-связь. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Сигма связь может возникать при перекрывании s-орбиталей (рис.2.8.а), s и p-орбиталей (рис.2.8,б), p- орбиталей (рис 2.8,в), d-орбиталей (рис.2.8,г),а также d и s-орбиталей, d и p-орбиталей, f- орбиталей друг с другом. Сигма связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
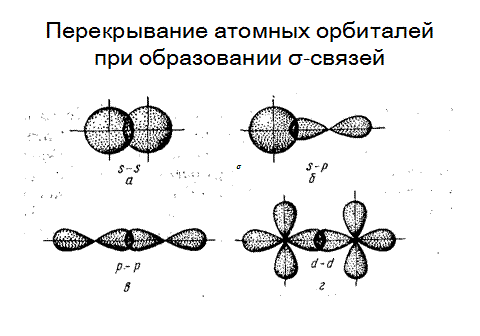
Рис. 3.8. Образование сигма-связи при перекрывании атомных орбиталей
Пи-связь. Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра взаимодействующих атомов, называется π-связью. Пи- связь может возникать при перекрывании
p - p орбиталей (рис.2.9,а), p и d -орбиталей (рис.2.9,б), d и d - орбиталей (рис 2.9,в), а также f и p-орбиталей, f и d-орбиталей, f-f орбиталей друг с другом.
. 
Рис.3.9.Перекрывание атомных орбиталей при образовании π-связи
Связь,образованная перекрыванием d –орбиталей всеми 4-мя лепестками, называется δ-связью (рис.3.10).

Рис.3.10. Направления перекрывания атомных орбиталей при образовании δ-связи
Соответственно, s-элементы могут образовать только σ-связи, p-элементы σ и π связи, d-элементы σ,π,δ-связи, а f-элементы σ,π,δ- и еще более сложные связи.
Кратные связи. Делокализованные связи. Кроме простых σ-связей существуют кратные (двойные, тройные) связи, которые образуются при наложении σ,π,δ-связей. При наложении π- связи на σ- связь образуется двойная связь, например, в молекуле кислорода, этилена, диоксида углерода. Кратная связь изображается двумя черточками: О=О, О=С=О, Н2С=СН2
≡При наложении двух π- связей на σ- связь образуется тройная связь, например, в молекуле азота, ацетилена, оксида углерода. Тройная связь изображается тремя черточками: N≡N, С≡О, НС≡СН.
Число связей между атомами в методе ВС называется кратностью связи. Кратные связи делокализованы, т.е. охватывают не 2 атома, а часть или целые молекулы или ионы.
Ионная химическая связь
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает между атомами с лишь при случае большой разности ЭО атомов, например, между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов V и VI групп (NaF, KCl).
Для ионной связи не характерна направленность, она не насыщена. Для молекул характерна ионная кристаллическая решетка.
Водородная связь
Дата: 2018-12-28, просмотров: 458.