1)Процентная концентрация – это число граммов растворенного вещества в 100г раствора.
2)Молярная концентрация – это число молей растворенного вещества в одном литре раствора
Задача. Сколько граммов NaCl нужно взять для приготовления 250 мл 0,1 М раствора.
Дано: 0,1 М, 250 мл
М (NaCl)=23+35,5=58,5
58,5 гр –1 л (H2 O) –1 М
5,85 гр – 1л - 0,1 М
Х -0,25
Х= 5,85*0,25=1,425 г.
3)Нормальная концентрация – это число грамм-эквивалентов вещества в одном литре раствора.
1 г-экв в 1 л - 1 Н р-р
1 г-экв H2SO4 - М (H2SO4 )= 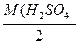 =
= 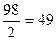
1 г-экв Аl2 (SO4 )3 = 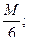
1 г-экв Аl2 (ОН )3 = 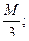
Задача. Сколько граммов H2SO4 необходимо брать, чтобы приготовить 250 мл 0,01 Н раствор?
1 Н – 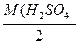 =
= 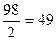
0,01 Н – 0,49 г
1л – 0,49 г
0,25 л – Х
Х= 0,49*0,25=0,1225.
Общие свойства растворов. Общими являются свойства растворов, которые не зависят от концентрации и практически не зависят от природы растворенных веществ. Они также называются коллигативными (коллективными). Такие свойства проявляются в идеальных растворах. Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. К идеальным растворам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества. К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление. Эти свойства проявляются в случае нелетучих растворенных веществ, т.е. веществ, давлением паров которых можно пренебречь.
Закон Рауля. Французский ученый Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ∆pA пропорционально молярной доле растворенного нелетучего вещества хв:
P0A - PA = ∆pA = P0A * ХВ, ( 8.1 ), где P0A , PA - давления насыщенного пара растворителя соответственно над чистым растворителем и раствором; ∆pA - разность между давлениями насыщенного пара растворителя над раствором, pA и растворителем P0A.
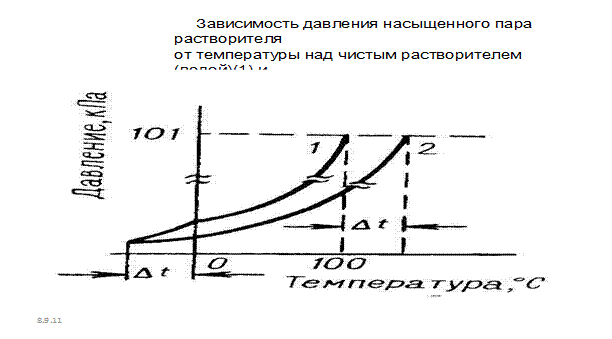
Рис. 7.5. Зависимость давления насыщенного пара растворителя от температуры
Из уравнения (8.1 ) следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается. Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя (рис. 36.)
Повышение температуры кипения ∆Ткип пропорционально моляльности раствора сm
∆Ткип =Кэ с m , (8.2) где K э - эбулиоскопическая постоянная растворителя.
Согласно второму следствию из закона Рауля, температура замерзания раствора (кристаллизации)раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем (рис 36). Понижение температуры замерзания (кристаллизации) ∆Тзам пропорционально моляльности раствора
∆Тзам = Кк с m (8.3) где Кк - криоскопическая постоянная.
Значения Кэ и Кк зависят от природы растворителя.
Таблица 8 – Эбуллиоскопические и криоскопические постоянные некоторых растворителей
| Постоянные растворителей, кг*К* моль-1 | Растворитель | |||
| вода | этанол | бензол | тетрахлорид углерода | |
| Кэ | 0,52 | 1,22 | 2,53 | 5,02 |
| Кк | 1,85 | 1,99 | 5,12 | 29,8 |
Используя уравнения 8.2 и 8.3, можно определить молярную массу вещества. Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масса растворенного вещества и растворителя mA , то молярную массу растворенного вещества МВ определяют по уравнению
МВ = 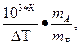
где К либо Кэ или Кк
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом.
Если раствор и растворитель разделены полупроницаемой (проницаемой для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления (рис.7.6.)
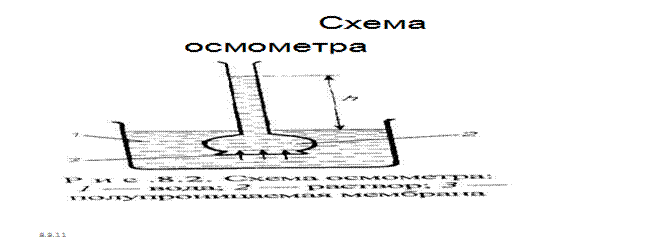 Рис.7.6. Схема осмометра
Рис.7.6. Схема осмометра
Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Оно равно давлению столба раствора в осмометре высотой h.(37). При равновесии внешнее давление уравновешивает осмотическое давление. Если внешнее давление, приложенное более концентрированному раствору, выше осмотического π, т.е. р>π, то скорость перехода молекул растворителя концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор. Этот процесс, называемый обратным осмосом, применяется при очистке воды, при получении питьевой воды из морской. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
πV= nRT или π= 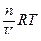 , откуда
, откуда
π= сRT , где
R –универсальная газовая постоянная,
n- количество растворенного вещества,
V- объем раствора, Т – абсолютная температура, с – молярная концентрация раствора.
Закон Вант-Гоффа. Осмотическое давление π численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при заданной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы воды с одинаковым давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим. Например, среднее осмотическое давление крови при 36ºС равно 780 кПа.
Гипертонические растворы сахара и соли (рассол) применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между молекулами раствора и растворенного вещества. Учесть эти взаимодействия очень трудно. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности
А= γс, где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициент активности измеряют экспериментально. Для этого измеряют какие-либо свойства раствора и определяют коэффициент активности как частное отделения экспериментального результата на теоретически рассчитанную по законам идеальных растворов:
γ = 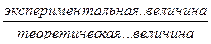
Итак, общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентрации используется активность.
Сольватация (гидратация) ионов – взаимодействие частиц растворенного вещества с растворителем (водой).
Сольваты (гидраты) – комплексы образованные частицами растворенного вещества и окружающими их частицами растворителя (водой).
Привести схему гидратации ионов.
Рис.
Na+[H2O]6Cl[H2O]8 гидратирование ионов в растворе.
· Как правило с увеличением температуры растворимость солей в воде растет (рис. ), за исключением Na2SO4, Na2SO4· H2O
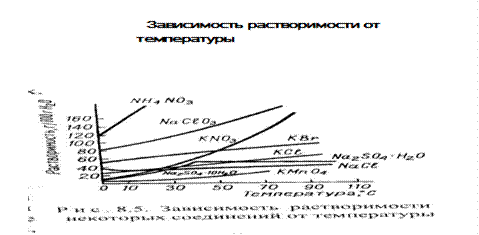
Рис.7.7. Зависимость растворимости от температуры
· Абсолютно нерастворимых веществ нет. Растворимость описывается произведением растворимости веществ.
BaSO4↔Ba+2+SO4-2 -
Этот процесс является гетерогенным. Поэтому константа равновесия этого процесса определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента:
Кр= ПРBaSO4=[ Ba+2][ SO4-2 ]
ПРBaSO4 =1,08·10-10 это табличная величина.
ПРAgBr =3,3·10-10 это табличная величина.
Дата: 2018-12-28, просмотров: 519.