Электрон - это микрочастица, масса которой очень мала, скорость движения велика. Двигаясь с огромной скоростью вокруг ядра, электрон размазывается в электронное облако или говорят выглядит как поле, т.е. можно сказать что орбиталь - это область вокруг ядра, где нахождение электронов более вероятно. В 1927 г . Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения микрочастицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В любой момент времени можно определить только лишь одно из этих свойств.
Вследствие принципа неопределенностей нельзя рассчитать траекторию движения электрона в атоме. В квантовой механике классическое понятие траектории заменяет волновая функция Ѱ.
Чтобы узнать траекторию или волновую функцию, необходимо решить фундаментальное уравнение квантовой механики – уравнение Шрёдингера:
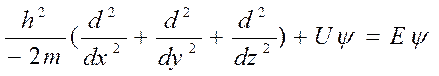
где U – потенциальная энергия,
Ѱ – волновая функция, Ѱ2 – плотность вероятности, вычисленная для определенного момента времени, определенной точки пространства, пропорциональна вероятности.
Двигаясь вокруг ядра, электрон может находиться в любой точке атома. Однако вероятность пребывания его в различных областях пространства неодинакова. Если на пространственной диаграмме изобразить вероятность нахождения электрона в области вокруг ядра точками, плотность которых пропорциональна вероятности обнаружения электрона в данном месте, то получится картина, напоминающее облако.
Поэтому современным представлениям отвечает понятие об электронном облаке, под которым понимается область в пространстве вокруг ядра, где с наибольшей вероятностью может находиться электрон. Электронное облако называется также атомной орбиталь.
 Графически атомная орбиталь изображается в виде ячейки
Графически атомная орбиталь изображается в виде ячейки
При решении уравнения Шредингера возникают некоторые константы, характеризующие поведение электрона в атоме. Таких констант 3, они называются квантовыми числами.
Ψх,у , z =Ψ nlm , полученные квантовые числа n , l , m характеризуют состояние электрона в атоме.
Главное квантовое число, n
Общий запас энергии электрона в атоме определяет главное квантовое число. Оно может принимать целые значения от 1 до бесконечности.
Наименьшей энергией обладает электрон с n=1. С увеличением значения главного квантового числа n энергия электрона возрастает. Электроны, которые характеризуются одним и тем же значением главного квантового числа, имеют электронные облака примерно одного размера и близкие по значению энергии. Поэтому можно сказать, что электроны в атоме образуют электронные слои или энергетические уровни, которым соответствует определенное значение n. Эти уровни обозначаются цифрами в соответствии со значением главного квантового числа или буквами латинского алфавита (табл.1.2):
Таблица 1.2. Энергетические уровни
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Буквенные обозначения уровня | К | L | M | N | O | P | Q |
Если, например n=4, то электрон находится на четвертом энергетическом уровне, или на N уровне. Электроны внешнего энергетического уровня обладают максимальным запасом энергии и наименьшей связью с ядром. Максимальное количество электронов, которое может находиться на том или ином уровне, определяется по формуле: N=2n2, где N – максимальное число электронов на уровне; n – номер энергетического уровня.
На внешнем энергетическом уровне может находиться не более восьми электронов, а на первом не более двух.
Дата: 2018-12-28, просмотров: 399.