1873 г. голландский ученый И. Ван-дер.Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионные взаимодействия.
Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.2.12-а).
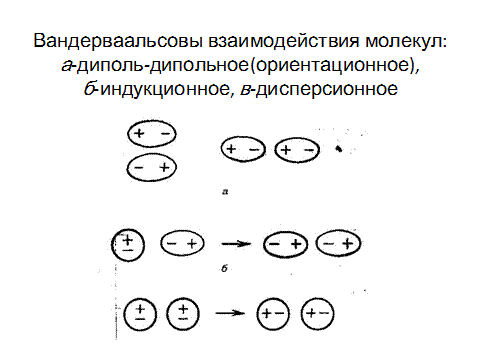
Рис. 3.12. Вандерваальсовы взаимодействия молекул
А – диполь-дипольное (ориентаионное); б-индукционное
в- дисперсионное
Возникающее между диполями взаимодействие называется диполь-дипольным взаимодействием.
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рис3.12.-б). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени.
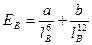
Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекул превратиться в диполи под воздействием электрического поля.
В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. (рис.3.12-в).В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия , включающие дисперсионные силы, а для полярных молекул и диполь- дипольное притяжение и индукционные взаимодействия.
Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных соединений.
CuSO4 +4NH3 =[Cu(NH3)4 ]SO4
Комплексные соединения состоят из двух сфер: внутренней и внешней. В приведенном выше примере внешней сферой является SO42-. Внутренняя сфера, называемая комплексом, включает центральный атом, называемый комплексообразователем, координирует вокруг себя ионы и молекулы, называемые лигандами. При записи внутреннюю сферу заключают в квадратные скобки. Число лигандов, координируемых комплексообразователем называется координационным числом. В зависимости от заряда различают анионные и катионные комплексы.
Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Наиболее распространенные комплексообразователи – это ионы d-элементов.
Лиганды. К числу лигандов относятся простые анионы
(CN-, Cl-), молекулы, имеющие неподеленные электронные пары.
Связь между внешней и внутренней сферой ионная, между комплексообразователем и лигандами – донорно-акцепторная.
Дата: 2018-12-28, просмотров: 497.