Одна из первых моделей строения атома ранняя планетарная модель атома Нагаоки: в 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
модель атома Нагаоки: жестко закрепленные электроны движутся вокруг жестко закрепленного, положительно заряженного ядра приведена на рис.1,а.
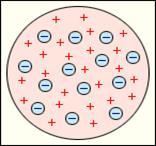
В 1904 году Дж.Томсон (Англия) предложил модель строения атома, согласно которой атом можно представить в виде положительно заряженной сферы с вкрапленными электронами. И модель такого атома была названа «пудинг с изюмом». Модель строения атома по Томсону приведена на рис.1,б.
В 1910 г. в лаборатории Э.Резерфорда (Англия) в опытах при бомбардировке металлической фольги α-частицами было установлено, что некоторые α-частицы рассеиваются фольгой. Отсюда Резерфорд заключил, что в центре атома существует положительно заряженное ядро малого размера, окруженное электронами. Наличие положительно заряженного ядра в атоме получило подтверждение в дальнейших экспериментах. Радиусы ядер лежат в пределах 10-14 - 10-15 м, т.е. в 104-105 раз меньше размера атома. Резерфорд предсказал существование протона и его массу, которая в 1800 раз превышает массу электрона. .
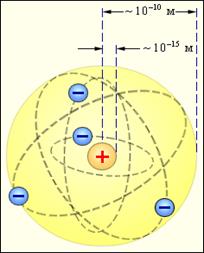
В 1910г. Резерфорд предложил ядерную планетарную модель атома, в которой атом представлен в виде миниатюрной Солнечной системы. Согласно этой модели, весь положительный заряд и почти вся масса атома (99,4%) сосредоточены в атомном ядре. Размер ядра ничтожно мал по сравнению с размером атома. Вокруг ядра по замкнутым эллиптическим орбитам движутся электроны, образуя электронную оболочку атома. Заряд ядра равен суммарному заряду электронов.
Модель атома Резерфорда приведена на рис. 1,в.
а 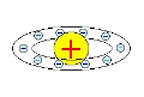
б в
Рис.1.1 Модели атомов:
а - модель атома Нагаоки; б – модель атома Томсона; в – модель атома Резерфорда
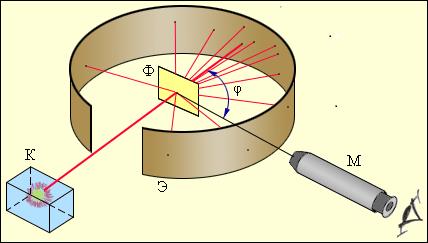
Рисунок 1.2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
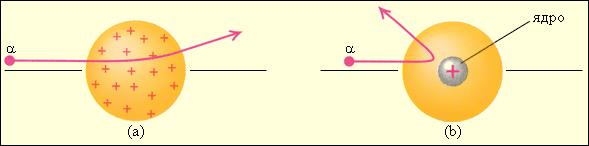
Рисунок 1.3. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро, однако атом не исчезает, атом устойчив. Спектры излучения атомов линейчатые.
В 1900г. М. Планк высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (колебания) ν:
Е= h ν, где h – постоянная Планка (6,626∙10-34 Дж∙с.
В 1910 г. датский ученый Н.Бор, используя модель Резерфорда и теорию Планка разработал теорию, которая очень хорошо объяснила весь спектр атомарного водорода, а также легла в основу физической модели Бор ввел 3 постулата.
I постулат Бора: электрон вращается вокруг ядра по строго определенным стационарным орбитам, и не излучает энергию
II постулат Бора: при переходе с одной орбиты на другую электрон поглощает или испускает. Этим объясняется на практике линейчатый характер атомных спектров.
III постулат Бора: Энергия излучается не непрерывно, а квантами.
Модель атома Бора: Согласно модели атома Бора, электрон перескакивает на более высокую орбиту при поглощении фотона и соскакивает на более низкую при излучении фотона. Кроме того, Бор указал, что разные энергетические уровни содержат разное количество электронов: первый уровень - до 2 электронов; второй уровень - до 8 электронов… К сожалению, описать атомы со сложной структурой, опираясь на модель Бора, не представляется возможным. Поэтому, в 20-х годах прошлого века получила широкое распространение квантово-механическая модель (КММ) атома.
Дата: 2018-12-28, просмотров: 425.