Основные причины мужского псевдогермафроди тизма сводятся к трём группам:
• нарушению дифференцировки и развития тестикул;
• дисфункции тестикул;
• нарушению рецепции андрогенов.
Нарушение дифференцировки и развития яичек может быть результатом различных аномалий Y-хромо-сомы. Полная делеция этой хромосомы во всех или в части клеток ведёт к кариотипу ХО или XO/XY. Возможна также делеция короткого плеча этой хромосомы при сохранении самой Y-хромосомы -кариотип XY(p-) или XY/ XY(p) — при мозаицизме. Если мутация носит ограниченный характер и затрагивает изолированно гены, контролирующие ключевые этапы в тестикулогенезе, то кариотип может быть XY, без хромосомных аномалий.
Клинически это проявляется в виде нескольких форм врождённой дисгенезии гонад—нарушения, при котором страдает дифференцировка как гормонообразую-щей, так и семяобразующей части тестикул.
При «чистой» дисгенезии гонад — кариотип 46XY, но фенотипический пол — женский, с первичной аменореей, высоким ростом, евнухоидными чертами телосложения и безволосыми подмышками и лобком. Яички не закладываются вообще, производные вольфова протока регрессируют, а мюллерова— сохраняются. Реже бывают рудиментарные остатки тестикулярной ткани, дающие минимальные признаки маскулинизации. Механизм нарушения основан на отсутствии эмбрионального фактора дифференцировки тестикул или его рецептора. Мужской антиген присутствует в части случаев и не выявляется у некоторых больных. Описаны семейные родословные с наследованием по Х-сцепленному рецессивному и аутосомно-доминантному типам. Почти треть пациентов страдает от гонадобластом и дисгермином рудиментарных гонад.
Смешанная дисгенезия гонад отличается мозаичным кариотипом 45XO/46XY, а также присутствием яичка с одной стороны и атрофичной гонады—с другой. Фенотип больных наиболее часто—женский, напоминающий синдром Шерешевского-Тернера, иногда —классически яркий, нередко—неполный. Могут






 быть и мозаичные случаи с промежуточным строением гениталий, и даже мужской фенотип. На стороне яичка имеется семявыносящий проток, в то же время есть матка и часто — фаллопиевы трубы. Тестикула выделяет андрогены и обусловливает пубертатную маскулинизацию, но в ней утолщены стенки семенных канальцев, и образуется мало сперматозоидов, вследствие чего больные бесплодны.
быть и мозаичные случаи с промежуточным строением гениталий, и даже мужской фенотип. На стороне яичка имеется семявыносящий проток, в то же время есть матка и часто — фаллопиевы трубы. Тестикула выделяет андрогены и обусловливает пубертатную маскулинизацию, но в ней утолщены стенки семенных канальцев, и образуется мало сперматозоидов, вследствие чего больные бесплодны.
Мозаицизм объясняется потерей Y-хромосомы из-за ее анафазной задержки или нерасхождения при митозе. Атрофия одной гонады может зависеть от преобладания в ней клеток с кариотипом 45X0. Хотя сохранённая тестикуда в постнатальном периоде выделяет андрогены, очевидно, что в критический период маскулинизации наружных гениталий ее функция была недостаточна, поскольку они не маскулинизировались. Задержка ингибирующего влияния продуктов тестикулы между 8-й и 14-й неделями развития вызывает персистирование производных мюллерова протока. Варьирование фенотипа может зависеть от преобладания линий ХО или XY-клеток в сохранной гонаде в критический период.
Агонадизм — вариант дисгенезии гонад при карио-типе 46XY и полном отсутствии как гонад, так и производных обоих протоков — вольфова и мюллерова. При этом регрессия зародышевого яичка происходит пос- ле выделения антимюллерова пептида, но до начала продукции фетальных андрогенов. В результате мюл-леров проток исчезает, а вольфов — не дифференцируется в мужские гениталии и также регресирует. В классическом варианте внутренних половых органов нет совсем, а наружные—женского типа. В зависимо- сти от точного момента регрессии тестикулы возмож- на фенотипическая вариация. Этиология синдрома неизвестна, точно определено отсутствие хромосомных аберраций.
Иногда нарушение дифференцировки гонад при муж- ском псевдогермафродитизме бывает частичным и касается лишь клеток Лейдига, синтезирующих андрогены, а семенные канальцы развиваются нормально. Фенотип больных женский, иногда—с расщеплен- ной недоразвитой мошонкой. Мюллеровых производных нет, а из вольфовых имеются семявыносящий проток и придаток яичка.
У взрослых семенные канальцы нормальны, но спер- матогенез понижен. Клеток Лейдига почти совсем нет. Уровень андрогенов соответствует нормальному женскому. Они имеют адренокортикальное происхождение. Уровень ЛГ сильно повышен, но ни ЛГ и хорионичес-кий гонадотропин не дают прироста содержания анд рогенов в крови. Уровень ФСГ нормален. Очевидно,
имеет место отсутствие или торможение развития клеток-предшественников лейдиговских. Вероятнее всего, это связано с дефектом рецепторов ЛГ/хорионическо- го гонадотропина на этих клетках. Видимо, присутствующие у больных вольфовы структуры требуют для дифференцировки очень незначительного количества андрогенов. В то же время мюллеровы структуры регрессируют, так как антимюллеров ингибирующий полипептид — продукт клеток Сертоли, а не клеток Лей-дига.
Во многих случаях мужского псевдогермафродитизма дифференцированные тестикулы перестают функционировать, что и вызывает нарушение полового развития.
Это может быть проявлением недостаточности антимюллерова ингибирующего фактора. Чаще всего клинически пациент выглядит как мужчина с парными семенниками, полной дифференцировкой вольфовых производных и маскулинизацией наружных половых органов. В юношеские годы происходит пубертат по мужскому типу. Однако имеется односторонний криптор-хизм, а на противоположной стороне—паховая грыжа с семенником и мюллеровыми структурами в грыжевом мешке (матка и фаллопиевы трубы). От 5 до 13 % пациентов имеют опухоли яичка. Описаны семейные случаи с различными типами наследования.
Считается, что нарушения как синтеза, так и секреции, структуры, рецепции и, наконец, своевременности выделения антимюллерова фактора могут обусловливать данную аномалию.
Значительно чаще дисфункциональный мужской псевдогермафродитизм является результатом различных нарушений продукции андрогенов тестику-лами и адренокортикоцитами. Это—невирилизующие формы адреногенитального синдрома (врожденной гиперплазии коры надпочечиков) у мальчиков (см. выше). Девочки при этих энзимопатиях рождаются нормальными, лишь при дефиците 3-в-гидроксисте-роиддегидрогеназы бывает в последующем незначительный вирилизм. Все нарушения аутосомно-рецес-сивны, многие затрагивают и продукцию неполовых стероидов в коре надпочечников (см. выше).
У пациентов с мужским хромосомным полом тестикулы нормально дифференцируются, и мюллеровы производные регрессируют, но наружные половые органы из-за фетальной недостаточности тестостерона сформированы по женскому типу, в виде урогенитального синуса или (при дефиците 3-в-гидроксистероиддегидро-геназы) — промежуточны.
Краткая характеристика этих форм мужского ложного гермафродитизма дана ниже в табл. 15. Дополни-
321
Таблица 15 Дефекты биосинтеза тестостерона при мужском псевдогермафродитизме
| Дефектный фермент | Наружные гениталии | Кортизол | Альдостерон | Андрогены | Половое созревание |
| Холестерин-20-22-десмолаза | Женские или уроге-нитальный синус | 
| 
| 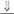
| Не доживают |
| 3-(3-гидроксисте- роиддегидроге- наза | Промежуточные | 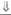
| 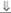
|  (дегидро-эпианд-ростерон периферического происхождения) (дегидро-эпианд-ростерон периферического происхождения)
 (17-ОН-прегнено-лон) (17-ОН-прегнено-лон)
| Гинекомастия при низком уровне эстрогенов |
| 17а-гид-роксилаза | Женские или уроге-нитальный синус | 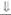
|  (дезоксикортико-стерон, кортикосте-рон, гипертензия) (дезоксикортико-стерон, кортикосте-рон, гипертензия)
| 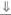
| Гинекомастия при низком уровне эстрогенов |
| 17,20-десмола-за | Женские или уроге-нитальный синус | N | N | 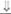
| Задержано |
| 17в-гидрокси- стероиддегидро- геназа | Женские или уроге-нитальный синус | N | N | (тестостерон)  (андростендион) (андростендион)
| Гинекомастия при низком уровне тестостерона и вы- соком - эстрогенов. Происходит активная периферическая конверсия андростендиона в эстрон |
тельные сведения о данных аномалиях можно найти выше, в разделе, посвященном врождённой гиперплазии коры надпочечников.
Третья принципиально возможная форма мужского псевдогермафродитизма связана с полной или частичной нечувствительностью тканей-мишеней к андроге- нам.
Самая важная ее разновидность — полная андро-генорезистентность или синдром Морриса (тестику- лярная феминизация).
При данном нарушении мужской хромосомный пол (46XY), нормально дифференцируются семенники, находящиеся в пахах, а мюллеровы производные отсутствуют. Несмотря на нормальный мужской или повышенный уровень тестостерона, вольфовы производные не развиваются, а наружные гениталии — женские. Уровень ЛГ повышен, ФСГ—нормален или повышен. Уровень эстрогенов — на нижней границе женской нормы. Эстрогены имеют тестикулярное происхождение. Синдром связан с женской психофизиологической ориентацией. Больные осознают себя женщинами и воспитаны как девочки. При половом созревании у них появляется женский бюст. Синдром наследуется либо с Х-хромосомой, либо аутосомно-до-минантно и ограничен полом. Патогенез связан с отсутствием цитоплазматического рецептора дигид-ротестостерона, либо с пострецепторным и ядерным дефектом ответа на дигидротестостерон. До половой зрелости яички нормальны. После полового созревания клетки Лейдига гипертрофированы, но сперматогенез угнетён.
322
Частичная форма резистентности к андрогенам — синдром Рейфенштейна — отличается меньшей степенью пубертатной феминизации и более маскулинизированным фенотипом.
Как известно, во многих периферических тканях— печени, сальных железах, волосяных фолликулах и коже наружных половых органов — действует фермент 5-а-редуктаза, превращающая тестостерон в более активный 5-а-дигидротестостерон. Этот НАДФ-зависимый фермент также способен восстанавливать двойную связь в 4-5 положении в С-21 стероидах. При наследственной аутосомно-рецессивной аномалии данного энзима развивается нарушение мужской половой дифференцировки, ограниченное наружными гениталиями, некоторыми вторичными половыми признаками и простатой. Производные вольфова протока, развитие которых зависит от тестостерона, оформляются нормально. Мюллеров проток, в основном, инволюцирует в срок. Однако предстательная железа недоразвита, оволосение лица и тела недостаточное, мужская линия роста волос на лбу и висках не оформляется, и акне в пубертатный период не характерны. Имеется гипоспадия с открытием уретры в промежности. Может быть урогенитальный синус с отдельным отверстием вагины или слепая рудиментарная вагина. В детстве часто бывает крип-торхизм, но в пубертате яички нисходят в мошонку, которая растет и пигментируется. Пенис увеличивается, а гортань претерпевает маскулинизацию. Упомянутые особенности зависят от сохранения те стостерон-зависимых и выпадения дигидротесто-
 стерон-зависимых вторичных половых признаков. Хотя оба андрогена имеют идентичный цитозольный рецептор, очевидно, его аффинитет к дигидротесто- стерону в ряде структур выше, или связывание рецептора с хроматином более выражено при наличии на рецепторе восстановленного андрогена. Уровень ЛГ увеличен, клетки Лейдига гиперплазированы, уровень ФСГ несколько повышен, что может быть результатом нарушения сперматогенеза при крипторхизме. Известно, что для эффективного созревания сперматозоидов существенны температурные условия (завершающие этапы процеса нарушаются при температуре выше 34°С). В мошонке температура ниже, чем в брюшной полости и паховом канале. Именно этим объясняют снижение сперматогенеза при крипторхизме, в том числе и в случае данной 5-ос-редук-тазной формы мужского псевдогермафродитизма.
стерон-зависимых вторичных половых признаков. Хотя оба андрогена имеют идентичный цитозольный рецептор, очевидно, его аффинитет к дигидротесто- стерону в ряде структур выше, или связывание рецептора с хроматином более выражено при наличии на рецепторе восстановленного андрогена. Уровень ЛГ увеличен, клетки Лейдига гиперплазированы, уровень ФСГ несколько повышен, что может быть результатом нарушения сперматогенеза при крипторхизме. Известно, что для эффективного созревания сперматозоидов существенны температурные условия (завершающие этапы процеса нарушаются при температуре выше 34°С). В мошонке температура ниже, чем в брюшной полости и паховом канале. Именно этим объясняют снижение сперматогенеза при крипторхизме, в том числе и в случае данной 5-ос-редук-тазной формы мужского псевдогермафродитизма.
ЖЕНСКИЙ ПСЕВДОГЕРМАФРОДИТИЗМ
Для развития этого синдрома необходим внутриутробный избыток андрогенов при наличии у плода кариотипа 46ХХ. Избыток андрогенов может создаваться как самим плодом, так и возникать в материнском организме.
Первая ситуация развивается при вирилизующих формах врожденной гиперплазии коры надпочечников у девочек. Вторая бывает либо результатом секреторной деятельности материнских опухолей — андро-стером разной локализации, либо провоцируется ят-рогенно (экзогенно).
Вирилизующие формы врожденной адренокор-тикальной гиперплазии уже были рассмотрены выше, в главе, посвященной патофизиологии надпочечников. Мальчики с этими синдромами (кроме недостаточности 3-в-гидроксистероиддегидрогеназы) имеют при рождении нормальный половой фенотип. У девочек выраженная вирилизация наступает при дефицитах 21 -гидроксилазы и 11 -в-гидроксилазы. Сла-бовирилизующим действием обладает и дефект 3-в-гидроксистероиддегидрогеназы, описанный выше в разделе о мужском псевдогермафродитизме. Дефицит 21 -гидроксилазы, ген которой находится в хромосоме 6, сцеплен с гаплотипом ГКГС Bw47. Болезнь наиболее часто встречается у эскимосов Аляски.
Из-за дефицита кортизола синдромы сопровождаются избытком АКТГ, нехваткой алъдостерона и кор- тикостерона. Это вызывает сольтеряющий синдром.
При дефекте 11-в-гидроксилазы, в связи с наличием гипердезоксикортикостеронемии, больные развивают артериальную гипертензию (см. выше).
Для всех синдромов этой группы характерны промежуточный тип наружных половых органов при рождении и последующая постнатальная вирилизация (рис. 89). Сильнее всего это выражено при наиболее часто регистрируемом 21 -гидроксилазном дефиците. Так как генотип женский, и тестикулярной ткани нет, не вырабатывается антимюллеров пептид, и мюллеровы структуры развиваются (имеются фаллопиевы трубы и матка). Андрогенов вырабатывается достаточно, чтобы маскулинизировать наружные гениталии и вызвать вирилизацию вторичных половых признаков, но недостаточно, чтобы индуцировать развитие вольфовых производных. Больные обоего пола в детстве растут быстро, но ранняя оссификация метаэпифизарных хрящей делает их в конечном итоге относительно невысокими. У мальчиков гиперпродукция андрогенов подавляет генез гонадотропинов, поэтому при наличии ярких внешних признаков возмужалости, а также эрекции и нормального либидо сперматогенез в тестикулах малоэффективен, и могут быть азооспермия и малые по размеру яички.
Материнский организм вирилизует плод, обладающий кариотипом 46ХХ, если имеются гормонально-активные андростеромы коры надпочечников, арре-нобластомы или лютеомы яичников, а также при наличии у матери вирилизующей формы врождённой гиперплазии коры надпочечников. Во всех случаях роль защитного барьера может играть плацента, спо-
Рис. 89. Женский псевдогермафродитизм (по М. Юлесу и И.Холло, 1967)
323
собная ароматизировать значительные количества андрогенов в эстрогены.
Назначение тестостерона и других андрогенов беременным может вызвать вирилизацию плода женского пола, но такие случаи весьма редки. Часто назначаемые при беременности с целью её сохранения прогестины, по некоторым данным, могут преобразовываться в слабые андрогены, но их этиологическая роль в развитии женского псевдогермафродитизма не доказана.
Вместе с тем убедительно показано, что прогесте рон, назначенный при беременности, нарушает развитие тимуса у зародышей обоего пола (Чурилова Н.И., 1999). Диэтилстильбэстрол при назначении беременным вызывает блокаду 3-{3-гидроксистероиддегидрогеназы и парадоксально усиливает влияние андрогенов на плод, хотя сам является эстрогеном. Экзогенные андрогены не способны вызвать дифференцировку вольфовых производных у женского плода. Их маскулинизирующий эффект отражается только на строении наружных гениталий.
При агенезии мюллеровых структур на почве ауто-сомно-доминантных мутаций развивается полное отсутствие (или гипоплазия) вагины и гипоплазия (отсутствие) матки. Могут быть эктопии и дисгенезии почек и аномалии строения шейного отдела позвоночника по типу синдрома Клиппелъ-Фейля. Это состояние со-
четается с нормальным женским кариотипом и функциональными яичниками и известно как синдром Майера-Рокитанского-Кюстера-Хаузера. При хирургической коррекции и восстановлении влагалища у пациенток с нерезко выраженной гипоплазией матки возможна даже беременность.
Рассмотрев нарушения половой дифференцировки, переходим к эндокринным аспектам регуляции функций гонад и нарушениям этих процессов.
НАРУШЕНИЯ РЕГУЛЯЦИИ ФУНКЦИЙ ПОЛОВЫХ ЖЕЛЕЗ
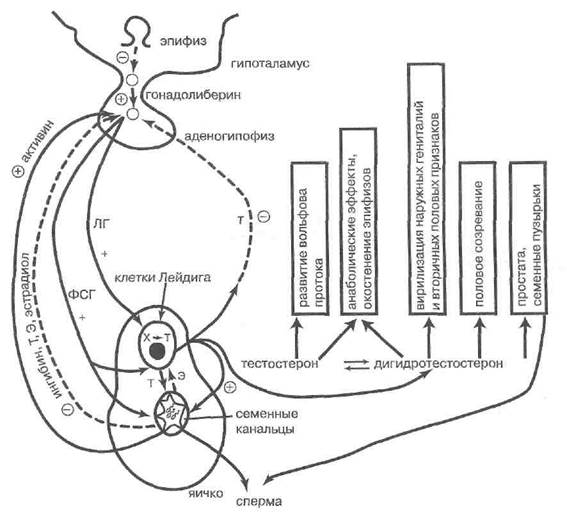
Гипоталамо-гипофизарный нейросекреторный комплекс при некотором сдерживающем и циклообразующем влиянии эпифиза осуществляет гонадотропные функции у лиц обоего пола.
Аркуатное ядро гипоталамуса в импульсно-пиковом режиме выделяет невидоспецифический декапептид го- надолиберин (рис. 90), стимулятор пролиферации и секреторной активности гонадотрофов аденогипофиза. Преимущественно люлибериновое или фоллибериновое действие гонадолиберина на эти клетки зависит от пер-миссивного фонового содержания различных половых стероидов и от скорости нарастания концентрации гона долиберина. Самой важной детерминантой селективной стимуляции освобождения ФСГ либо ЛГслужит ча-
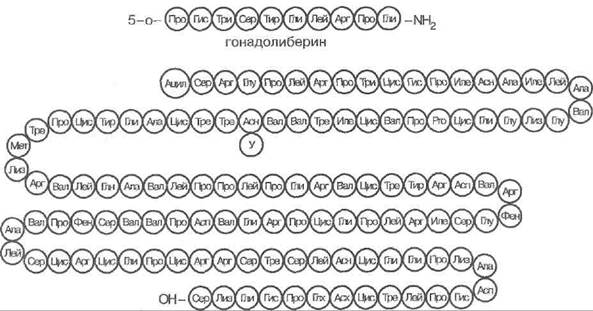
(3 - субъединица лютропина человека
Рис. 90. Структура гонадолиберина (вверху) и в-субъединицы лютроиииа человека (по Н. А. Юдаеву с соавт., 1976; по Д. К. Клоноффу., Дж. К. Караму, 1998)
324
стота пульсации секреции гонадолиберина. Длительная постоянная секреция или инфузия гонадолиберина может, наоборот, оказывать гонадостатический эффект. Гонадолиберин имеется во многих отделах головного мозга и обладает поведенческими эффектами. Опиат- ные пептиды тормозят, а норадреналин — стимулирует его продукцию.
Гонадотрофы аденогипофиза, составляющие в нем до 10% и часто соседствующие с лактотрофами, образуют под действием гонадолиберина гликопроте-идные гормоны, близкие по структуре — лютропин [ЛГ) и фоллитропин (ФСГ). Большинство гонадотрофов вырабатывают оба гонадотропина, некоторые специализированы.
Гонадотропины состоят из вырабатываемой в избытке общей а-субъединицы, которую разделяют с ТТГ И хорионическим гонадотропином (см. выше), а так-же В-субъединицы, имеющей у каждого из этих регуляторов свою структуру (рис. 90). В гонадотрофах образуются сначала прогормоны, затем они процессируются в гормоны и приобретают углеводные компоненты путём посттрансляционной модификации. В небольших количествах нормальный аденогипофиз выделяет и хори-О нический гонадотропин.
ЛГ у человека содержит более 15 % углеводов, а ФСГ— 16%. Углеводные остатки необходимы для поддержания биологической и иммунологической специфичности гонадотропинов и замедляют их захват и распад в печени. Так как оба гормона поступают в кровь нерегулярными пиковыми импульсами, а время полувыведения фоллитропина больше, чем лютропина, концентрации ЛГ В крови характеризуются в течение суток крайней вариабельностью, а ФСГ— несколько более постоянны. ФСГ в яичках индуцирует сперматогенез, а в яичниках — созревание фолликулов. ЛГ— стимулятор развития интерстициальных клеток семенников и секреции андрогенов, у самок он также стимулирует разрыв фолликулов, образование жёлтого тела и секрецию эстрогенов и прогестерона. Биологическое действие ЛГ и ФСГ на мужской и женский организмы более детально рассматривается в следующих разделах.
Гонадотропиновая секреция находится под сложным контролем комплекса гормонов гонад. Подробно эти вопросы затронуты ниже, при рассмотрении эндокринных функций гонад. Вкратце следует отметить, что малые концентрации эстрогенов снижают частоту секреторных пиков гонадолиберина и чувствительность к нему гонадотрофов. Но длительное и существенное повышение концентрации эстрогенов, напротив, увеличивает освобождение гонадолиберина и ЛГ. Эта положительная обратная связь устанавливается в конце периода полового созревания. Прогестерон в
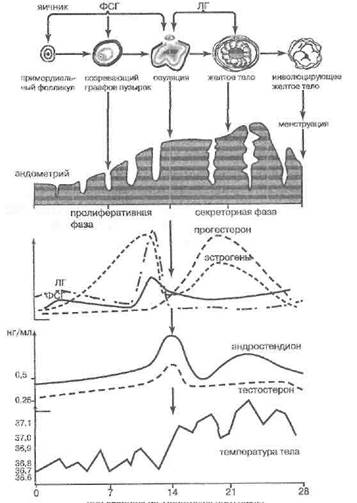
Дни овариально-менструального цикла
Рис 91. Ритмические гормональные и физиологические изменения при нормальном оВариалыю-менструалыюм цикле (по А. Уайту с соавт., 1981 по А. А. Пищулину, 1991)
малых концентрациях снижает частоту импульсов го-надолибериновой секреции, но при значительном повышении уровня прогестерона чувствительность гона-дотрофов к гонадолиберину и продукция ЛГ в гипофизе растут.
Продукция гонадолиберина, ЛГ и ФСГ подавляется тестостероном. Тестостерон сам снижает частоту импульсов гонадолиберина и ЛГ, а также переходит в гипофизе в эстрадиол, который уменьшает чувствительность гонадотрофов к гонадолиберину. Выше уже шла речь о том, что именно ослабление этого сервомеханизма даёт толчок гормональным изменениям при половом созревании.
Сильным тормозом секреции ФСГ (но не ЛГ) у лиц обоего пола служит продукт клеток Сертоли и гранулёзных клеток яичника—ингибин. Противоположное действие оказывает другой пептид обратной связи тех же клеток — активин.
325
|
|
| Рис. 92. Биосинтез андрогенов и их превращения в различных органах и тканях |
В ходе нормального полового цикла женщины концентрации гонадотропинов меняются сложно-согласованным образом (рис. 91). У мужчин также имеются ритмические вариации в их продукции. Детальнее эти вопросы обсуждены ниже.
Постоянно высокий уровень гонадотропинов в крови характерен для первичного гипогонадизма и эктопической выработки этих гормонов, а низкий—для вторичного гипогонадизма.
Пролактин {лактотропный или лютеотропный гормон, ПРЛ) является аденогипофизарным биорегулятором соматомаммотрофной группы. Этот гормон можно считать и регулятором половых функций, поскольку его мишенями служат как экзокринная молочная железа, так и гонады, и анаболическим регулятором, близким к СТГ и плацентарному лак-тогену. ПРЛ— древняя эволюционная находка и имеется у амфибий и других животных, не располагающих молочными железами. ПРЛ животных активен у человека и отличается от человеческого очень мало (например, у бычьего и овечьего гормона 95 % общих аминокислот с человеческим, а у свиного — 98%!
Как уже отмечалось выше в разделе, посвященном патофизиологии гипоталамо-гипофизарного нейросек-реторного аппарата, аркуатное и паравентрикулярное ядра гипоталамуса регулируют продукцию пролакти- на в основном путём ее сдерживания через дофамин, выполняющий роль пролактостатина путём воздействия на D2-рецепторы лактотрофов.
В связи с этим многие дофаминомиметики являются блокаторами лактации. Жженый ячмень и другие крупы, входящие в состав эрзац-кофейных напитков, содержат дофаминовые соединения, что позволяло еще древним китайцам использовать эти продукты для прекращения лактации у женщин. По этой же причине современные диетологи не рекомендуют употребление эрзац-кофейных напитков при кормлении грудью (Во ронцов И. М., Мазурин А. В., 1980).
Стимулятором со свойствами пролактолиберина является гипоталамический и гипофизарный ауток-ринный ВИП. Существуют и другие кандидаты на роль пролактолиберина (см. ниже). При стрессе опиат-ные пептиды стимулируют пролактиногенез, что считается важным условием развития стресса без дистресса, так как анаболизирующее действие пролак-тина и стимуляция его малыми дозами андростероидо-генеза существенно активируют фазу восстановления при стрессе и, возможно, позволяют избежать стрессор-ного иммунодефицита. Пролактолиберином является
326
и тиролиберин, хотя две эти функции не обязательно изменяются однонаправленно.
Суточный ритм пролактиногенеза характеризуется, как и у СТГ, ночным максимумом.
Ген прогормона ПРЛ находится в хромосоме 6. Из прогормона в лактотрофах процессируется собственно ПРЛ, имеющий одну цепь из 198 аминокислот и три дисульфидных связи, который выделяется в кровоток. Препролактин в минимальных количествах также секретируется в кровь. Кроме лактотрофов аденоги-пофиза, небольшое количество пролактина выделяют Т-лимфоциты.
У человека за пределами гонад, молочных и сальных желез и клеток иммуно-нейроэндокринного комму-никативно-регуляторного аппарата значимого количества рецепторов ПРЛ не обнаружено.
Нарушения функции тестикул широко распространены. До 6 % мужчин бесплодны из-за той или иной формы и степени тестикулярной недостаточности. Опухоли семенников являются самой частой формой злокачественных неоплазий у мужчин 20-35 лет и третьей по значению онкологической причиной смертности в этой возрастной группе. Все эти нарушения часто сопряжены с эндокринной дисфункцией яичек.
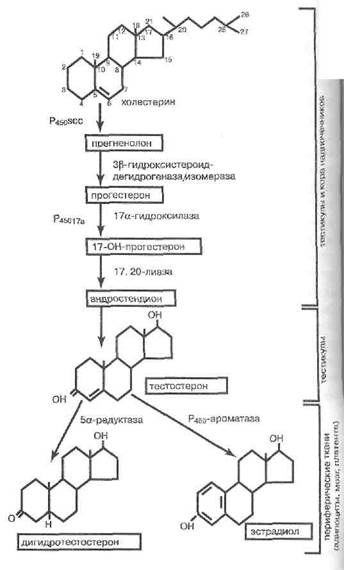
В настоящее время известно, что мужская гонада —яичко (семенник) служит как органом сперматогенеза, так и источником андрогенов, причём это основной орган, секретирующий в кровь тестостерон и дигидротестостерон. Так, первый на 95% имеет у мужчин тестикулярное происхождение. Установлена также секреция нормальными семенниками эстради- ола.
Гормоны яичка вырабатывают интерстициальные клетки Лейдига, а сперматогенезом занимаются семенные канальцы, где находятся клетки Сертоли. Яичко — и источник, и одна из важных мишеней андро генов, поскольку последние имеют рецепторы в клетках семенных канальцев и нужны для сперматогенеза.
В клетках Лейдига из готового холестерина липо-протеидов плазмы крови и, в меньшей мере, из холестерина, синтезированного de novo, вырабатываются андрогены. Путь андростероидогенеза в семеннике показан на рис. 92. Он содержит 5 этапов, катализируемых соответствующими энзимами, причём лишь пятый этап, зависимый от 17-в-гидроксистероид-де-гидрогеназы, практически уникален для семенника, а остальные воспроизводятся и в коре надпочечников. Ключевой этап всего процесса — отщепление боковой цепи холестерина с помощью цитохрома P450scc и превращение холестерина в прегненолон — находится под контролем ЛГ аденогипофиза. Пролактин, стимулирующий в малых дозах продукцию тестос терона, напротив, в высоких концентрациях подавляет андростероидогенез. Кроме того, пролактин нарушает конверсию тестостерона в более активный дигидротестостерон.
Взрослый молодой мужчина секретирует в кровь до 6000 мкг тестостерона в сутки, причём запас этого стероида в тестикулах в 200 раз меньше, то есть кругооборот андрогенов характеризуется огромной скоростью. Дигидротестостерон образуется и в яичке, и на периферии, во всех мишенях андрогенов в количестве около 3000 мкг в день.
Интересно и практически важно, что нормальный мужчина не лишён продукции женских сексуальных начал.
Периферические ткани содержат ароматазу, превращающую у мужчин в норме до 0,3% суточной продукции тестостерона и более 1,5% суточной продукции дигидротестостерона в женские половые гормоны — эстрон и эстрадиол. Эстрадиол, кроме того, возикает и в самой тестикуле. Таким образом, те-стикулярный эстрадиол и эстрадиол, полученный путём конверсии тестостерона и эстрона, составляет у мужчин до 45 мкг в день. К тому же периферические ткани вырабатывают в сутки до 66 мкг эстрона. Особенно значительная часть этого естественного эстро-генного фона здорового мужчины вырабатывается жировой тканью, в этом плане активен также мозг. Эс-трогенная функция липоцитов повышена при ожирении и усиливается с возрастом. В дополнение к тестикуляр-ным и адипоцитарным эстрогенам следы женских половых стероидов имеются и в секрете сетчатой зоны коры надпочечников. Эстрогены мужчины — частичные синергисты и частичные антагонисты эффектов андрогенов. Они существенны для подавления продукции ФСГ при реализации гипоталамо-питуитар-но-гонадной обратной связи.
В крови гормоны яичек на 50% связываются со специфическим сексогормонсвязывающим глобулином. Только 3% тестостерона свободно, оставшееся количество связано с альбумином. Последние две фракции биологически доступны тканям.
Андрогены действуют на внутриклеточный рецептор, кодируемый в длинном плече Х-хромосомы. Превращение тестостерона в дигидротестостерон имеет место прямо в ядрах клеток-мишеней. И дигидротестостерон, и тестостерон, который служит для первого прогормоном, связываются с одним и тем же рецепторным белком, но комплекс с участием тестостерона наиболее активно действует на экспрессию генов в одних тканях (мышцы, вольфовы производные), а дигидротестостероновый комплекс — в других (предстательная и сальные железы, волосяные фолликулы). Имеются и отличия в репертуаре программ, запускаемых двумя основными те-стикулярными стероидами. Некоторые эффекты анд рогенов, например, секреция жидкости семенными пузырьками, не опосредованы генетически, а зависят от прямой активации гормонами выработки ц-АМФ. (Расмуссен Г., 1982).
Спектр эффектов андрогенов включает эмбриональную маскулинизацию развития производных воль-фова протока, контроль органогенеза молочных желёз, вирилизацию формирования наружных половых органов, стимуляцию развития вторичных половых признаков возмужалости в пубертатный период. Андрогены
327
способствуют развитию либидо у лиц обоего пола, а также реализации мужских психофизиологических стереотипов полового поведения и мужской тенденции к выбору активных оборонительных реакций при стрессе.
Андрогены — это анаболизирующие гормоны, способствующие биосинтезу белка во многих органах — гениталиях, центральной нервной системе, скелетных мышцах, скелете, почках и миокарде, печени, слюнных, потовых, сальных и молочных железах. Под влиянием андрогенов стимулируется синтез не любых белков, а связанных с дифференцировочными программами упомянутых органов в мужском организме.
Андрогены — стимуляторы сперматогенеза и секреторной деятельности, простаты, сальных желёз и семенных пузырьков (где они не только увеличивают выход семенной жидкости, но и обогащают ее фруктозой, необходимой для движения сперматозоидов). Для клеток вышеназванных желез андрогены служат и митогенными стимулами. Они способствуют липолизу, особенно в гиноидных зонах, в то же время в органах, гиперплазирующихся под андрогенным влиянием, эти гормоны усиливают биосинтез фосфо-липидов. Важный аспект метаболической активности как мужских, так и женских половых гормонов — стимуляция окостенения эпифизов длинных трубчатых костей — связан с продукцией под их контролем белка остеокальцина и является основным механизмом, останавливающим рост конечностей в длину. Ан дрогены повышают основной обмен, несколько способствуют гипергликемии, уменьшают потери немочевинного азота, ускоряют катаболизм пуринов.
Важным аспектом их деятельности служит стимуляция супрессорных функций лимфоцитов. В вилочко-вой железе андрогены способствуют инволютивным изменениям тимоцитов и эпителия. Следует отметить физиологическую роль андрогенов в половой системе женского организма— они, например, способствуют нормальной скорости и репертуару биосинтеза белков в матке и яйцеводах. Еще раз напомним, что формирование либидо и сила полового влечения различного знака зависят у лиц обоего пола от андрогенов. Именно андрогены — первичные эротогенные гормоны любого взрослого индивида (Линде Д., Гамбург Д., 1972), в то время как знак эротических прдпочтений зависит от того поведенческого типа, который был запрограммирован при дифференциров-ке организма и особенно мозга.
Андрогены яичек секретируются неодинаково в различные возрастные периоды. Первый максимум их продукции достигается во втором триместре внутриутробной жизни плода. При этом плазменная концентрация тестостерона поднимается до 3-4 нг/дл.
328
Уже в третьем триместре содержание андрогенов падает. После рождения, на протяжении первых 3-4 месяцев, андростероидогенез вновь активируется (плазменное содержание тестостерона составляет до 2,5 нг/дл). Но со 2-й половины 1 -го года жизни и до возраста 11-12 лет в секреторной деятельности яичек наступает спад.
С 12 до 17 лет продукция тестостерона плавно и быстро нарастает, достигая после пубертата максимума. До 60 лет она у большинства здоровых мужчин не снижается, обеспечивая уровень тестостерона плазмы около 5 нг/дл. В старости происходит некоторое уменьшение плазменного уровня тестосте рона, особенно заметное на восьмом десятке лет жизни, но и у долгожителей он составляет более 2,5 нг/дл.
Краткие сведения о семяобразующей функции яичек и эндокринной роли клеток Сертоли можно для целей данной главы резюмировать следующим образом. Клетки Сертоли находятся в семенных канальцах в составе их сперматогенного эпителия, выполняя функции своего рода нянек или поддерживающих элементов для находящихся тут же гамет и их предшественников. Их рост и пролиферация стимулируются андрогенами, без которых сперматогенез невозможен. ФСГ аденогипофи-за стимулирует созревание сперматид. Этот аденогипо-физарный гормон также индуцирует в клетках Сертоли выработку андрогенсвязывающего белка, что позволяет накапливать андрогены в просвете канальца и удерживать там их критическую концентрацию, нужную для сперматогенеза. ФСГ индуцирует в сертолиевых клетках продукцию трансферрина, что необходимо для обеспечения сперматогенного эпителия железом. По данным Б.В. Покровского (1976), ФСГ стимулирует экспрессию рецепторов ЛГ на клетках Лейдига, косвенно способствуя андростероидогенезу. У половозрелого мужчины ЛГ и ФСГ взаимозаменяемы при поддержании сперматогенеза.
Клетки Сертоли сами не образуют тестостерона, но рецептируют андрогены и превращают тестостерон клеток Лейдига в дигидроформу, а также в эстра диол. Этот процесс также стимулируется в них с помощью ФСГ. Эстрадиол клеток Сертоли паракринно подавляет андростероидогенез в клетках Лейдига.
Собственная эндокринная активность клеток Сертоли связана с тем, что они способны к выработке вышеупомянутых пептидных гормонов — ингибина и акти- вина.
Ингибин — сигнал обратной связи в гипоталамо-гипофизарно-гонадной оси—способен сильно подавлять продукцию гонадолиберина и, несколько слабее, уменьшать секрецию ФСГ, но не ЛГ. Это гликополипеп-тид, гомологичный фетальному антимюллерову инги-
|
|
Рис. 93. Регуляция продукции тсстикулярных андрогеиов и их биологические эффекты в пренаталыюм и постнатальном периодах. Т-тсстостсрон, Э — эстрадиол, X — холестерин
 бирующему полипептиду, который продуцируют плодные предшественники клеток Сертоли.
бирующему полипептиду, который продуцируют плодные предшественники клеток Сертоли.
Активин — другой полипептид клеток Сертоли, реализующий механизм положительной обратной свя-зи с аденогипофизом, где стимулирует продукцию ФСГ.
При нарушениях сперматогенеза происходит усиление продукции ФСГ. Константа спермообразования у взрослого человека — 74 дня. Следовательно, острые воздействия на сперматогенный эпителий могут не сказываться на количестве сперматозоидов более двух месяцев. Приведенные выше положения иллюстрируются рис. 93.
Практически все органы женской половой системы способны к эндокринной и паракринной активности.
Теперь об эндокринной функции женских гонад.
Яичники — женские гонады, органы овогенеза и источник более чем 30 гормонов и паракринных биоре-
гуляторов, влияющих на циклическое осуществление женских половых функций. Без их нормальной функции беременность невозможна.
Яичник содержит под капсулой корковый слой, где расположены фолликулы, основная герминативная и гормонообразующая часть органа. Большая часть из них—незрелые примордиальные фолликулы, имеющие тонкий слой фолликулярных клеток—гранулёзу — и окружённые базальной мембраной. Часть фолликулов в яичнике половозрелой женщины находится на разных стадиях созревания и инволюции. Наиболее крупные могут развивать толстую оболочку — теку. Здесь же могут обнаруживаться желтое тело, а также результат его инволюции — белые тела. Клетки гранулёзы и внутренней части теки, а также клетки желтого тела являются стероидогенными. Они способны к выработке соответственно эстрогенов, андрогенов и прогести-нов. Но половыми стероидами гормонообразование в яичниках не исчерпывается.
329
Таблица 16 Овариальные гормоны и аутокоиды (по Дж. Окленду, В. Лингаппе, 1997, модифицировано)
| Биорегулятор | Источник | Факторы , управляю щие его продукцией |
| Андрогены | Тека, интерстициальные клетки | ЛГ |
| Эстрогены | Гранулёза, желтое тело | ФСГ |
| Прогестины | Жёлтое тело | ЛГ, пролактин |
| Ингибин (фолликулостатин) | Гранулёза, тека, жёлтое тело | ФСГ, ЭФР, ИФР-1, гонадолиберин, ВИП, ТФР |
| Активин | Гранулёза | ФСГ |
| Антимюллеров ингибирующий полипептид | Гранулёза, cumulus oophorus | ЛГ,ФСГ |
| Фоллистатин | Фолликулы | ЛГ.ФСГ |
| Релаксин | Жёлтое тело, тека, плацента, матка | ПРЛ.ЛГ.окситоцин, ПГ |
| Активатор и ингибитор мейоза ооцитов | Фолликулярная жидкость | ? |
| Фолликулярный регуляторный белок (ингибитор секреции и роста клеток гранулёзы) | Фолликулярная жидкость, гранулёза, жёлтое тело | ФСГ, гонадолиберин |
| Активатор плазминогена | Гранулёза | ? |
| Внеклеточные мембранные белки | Гранулёза, фолликулярная жидкость | ФСГ, гонадолиберин |
| Инсулиноподобный фактор роста (ИФР)-1 | Гранулёза | СТГ, ФСГ, ЛГ, ЭФР, ТФР, ФРТ.эстрогены |
| Аналог эпидермального фактора роста (ЭФР) | Гранулёза, тека | Гонадотропины |
| Трансформирующий фактор роста (ТФР)-а | Тека, интерстиций | ФСГ |
| Основной фактор роста фибробластов | Жёлтое тело | ? |
| Трансформирующий фактор роста (ТФР)-(З | Гранулёза, тека, интерстиций | ФСГ, ТФР, фибронектин |
| Тромбоцитарный ростовой фактор (ФРТ) | Гранулёза | ? |
| Фактор роста нервов | Яичник | ? |
| Проопиомеланокор-тин (ПОМК) | Жёлтое тело, интерстиций, гранулёза | ? |
| Энкефалин | Яичник | ? |
| Динорфин | Яичник | ? |
| Гонадолиберин | Гранулёза, фолликулярная жидкость, другие структуры | ? |
| Окситоцин | Гранулёза, жёлтое тело | ЛГ.ФСГ, ПГF2а |
| Вазопрессин | Яичник, фолликулярная жидкость | ? |
| Ренин | Фолликулярная жидкость, тека, жёлтое тело | ЛГ.ФСГ |
| Ангиотензин II | Фолликулярная жидкость | Ренин |
| Атриопептин | Фолликулярная жидкость, желтое тело, яичник | ? |
| Ингибитор и стимулятор образования желтого тела | Фолликулярная жидкость | ? |
| Ингибитор секреторных всплесков гонадотропинов | Гранулёза | ? |
| Блокатор связывания ЛГ с рецепторами | Жёлтое тело | ? |
| Нейропептиды (Y, кальцигенин, вещество Р, соматостатин, гистидил-метиониновый пептид) | Нервные окончания | 9 |
| Вазоактивный кишечный полипептид (ВИП) | Нервные окончания | ? |
| Онкобелок c-mos | Ооциты | Эмбриогенетические |
| Эйкозаноиды, в том числе - простагландины (ПГ) | Повсеместно | Различные |
Некоторое представление о чрезвычайном богатстве внутрисекреторных потенций яичников и о сложности овариальной регуляции даёт табл. 16. Поистине уникальное разнообразие регуляторных факторов яичника заставляет с уважением вспомнить доктрину преформистов, размещавших в данном органе «бесконечный ряд гомункулусов».
Во время внутриутробного развития для проявления признаков женского пола эндокринная функция яичников не требуется. Как уже описывалось выше, при отсутствии гена SRY, эмбриональная гонада и мюллеровы структуры развиваются в яичник и внут-
330
ренние гениталии спонтанно, а вольфов ход регрессирует. В фетальном яичнике закладывается до 7 млн овогониев, развитие которых останавливается в профазе мейоза, к рождению их остается до 1 млн, к 10 годам — не более 0,4 млн. Небольшая часть этого пула будет использоваться в половозрелом организме на протяжении всего фертильного периода. Таким образом, овоцит до его созревания и оплодотворения может жить десятки лет. Это способствует кумуляции мутаций в овоцитах и делает риск генетических дефектов плода у пожилых женщин много большим.

 Во втором триместре беременности временная активация продукции гонадотропинов обеспечивает
Во втором триместре беременности временная активация продукции гонадотропинов обеспечивает
созревание гонадостата — системы гипоталамус-гипофиз-яичник, связанной обратными связями в функциональное целое. Затем продукция гонадотропинов
понижается.
В детстве секреция гонадотропинов у девочек стабильно низкая. Незрелый яичник вырабатывает минимальные количества половых стероидов. В момент родов большое значение имеют изменения в уровне половых гормонов, связанные со стероидо-
генной активностью плодоплацентарного комплекса. Плацента насыщает организм плода эстрогенами. В первые дни после родов их уровень падает. Эти изменения обусловливают особое переходное состояние
новорожденных — гормональный криз или синкаино- генез (Шабалов Н.П. и соавт., 2003). Он проявляется у 60-70% новорожденных, чаще — у девочек. Симптомы синкаиногенеза в период 3-6-го дня жизни включают нагрубание молочных желёз, угри, десква-мативный вульвовагинит, арборизацию носовой сли-
зи, иногда отек кожи наружных гениталий. Падение
уровня эстрогенов на 5-8-й день жизни вызывает
бурную реакцию матки новорожденной девочки, эндометрий отторгается, и наступает метрорагия, для-
щаяся 1-2 дня. Продукция гонадотропинов на фоне быстрого падения уровня половых стероидов временно возрастает. Все эти изменения иногда образно характеризуют как «малый пубертат». И в этот период, и в дальнейшем источники основной части половых гормонов — неовариальные. В последующем детстве у девочек половые стероиды надпочечни-кового происхождения играют большую роль для организма (адренархе).
При половом созревании девочек, которое начинается в 9-11 лет, происходит установление импульсного характера секреции гонадолиберина в гипоталамусе и повышается чувствительность гонадотрофов к гонадолибе- рину, а секреция гонадотропинов также приобретает пульсирующий характер. Эпизодические повышения го-надотропной функции и стероидогенеза в гонадах у девушек-подростков происходят во сне.
По достижении критической массы тела в 48 кг или критической комбинации массы жировой ткани, воды и общего веса тела, гипоталамус девочек становится менее чувствительным к обратному ингибирующему влиянию половых стероидов. У девушек с ожирением это может происходить раньше, а при пониженной массе тела — задерживаться. Подобная связь анатомически закреплена перекрыванием в дугообразном ядре цент-


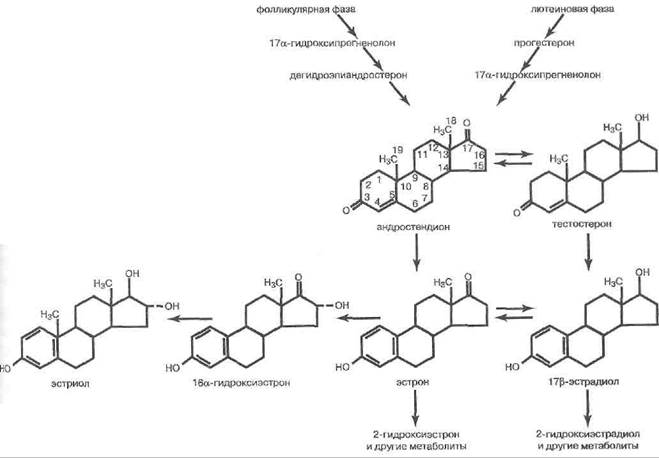
Рис. 94. Пути стероидогенеза в яичниках
331
ров продукции гонадолиберина и зон, ответственных за эффект липостата.
Увеличенная секреция овариалъных гормонов приводит к развитию полного комплекса вторичных женских половых признаков.
В дальнейшем у половозрелых женщин в течение всего детородного периода поддерживается циклический характер гонадотропиновой и гонадной секреции, описанный подробно ниже. В постменопаузальном периоде из-за израсходования фолликулов продукция ова-риальных гормонов резко снижается, а аденогипофи- зарных гонадотропинов — наоборот, значительно растет. Обычно менопауза наступает в 50-51 год.
Гонадотропная функция гипоталамо-гипофизарного нейросекреторного аппарата в норме в половозрелом женском организме характеризуется следующим.
При низком пермиссивном уровне эстрогенов пики гонадолибериновой секреции следуют часто, и гона-долиберин стимулирует в аденогипофизе преимущественно продукцию ФСГ. При высоком пермиссивном уровне эстрогенов пики гонадолибериновой секреции становятся реже, а в аденогипофизе стимулируется в основномы продукция ЛГ. Гонадотропины оказывают своё действие на яичник через рецепторы семейства, связанного с G-белками и циклонуклеотид-про-теинкиназные посредники.
Принципиально для яичника ФСГявляется стимулятором роста и пролиферации клеток гранулёзы, экспрессии рецепторов ЛГ, активатором конверсии андро- генов в эстрогены (ароматазная реакция).
ЛГ для яичника служит стимулятором андростеро-идогенеза во внутренней части теки (в основном, как и в тестикулах, на этапе превращения холестерина в пре- гненолон), а также способствует превращению гранулёзных клеток в лютеиновые, формируя желтое тело. Стероидогенез в яичниках и биологическая характеристика овариальных стероидов обладают некоторыми важными особенностями. В яичнике синтезируются ан- дрогены (клетками интерстиция и теки под контролем ЛГ), эстрогены (путем ароматизации андрогенов в клетках гранулёзы, а также желтом теле — под контролем ФСГ) и прогестины (в клетках желтого тела под контролем ЛГ). Пути биосинтеза этих гормонов показаны на рис. 94. Как и адренокортикоциты, овариальные клетки предпочитают в качестве сырья для стероидо-генеза готовый холестерин из ЛПНП плазмы крови, хотя могут производить холестерин и сами, из ацетата.
Главный овариальный андроген (С-19-стероид)-андростендион. Его собственная андрогенная активность мала. Он преобразуется в эстрогены, в основном — яичником, но также жировой тканью и другими органами. Возможно и преобразование андростенди-
332
она в тестостерон. Превращение андростендиона в тестостерон у женщин в норме незначительно. Оно может усиливаться при наличии андростером яичников и при понижении ароматазной реакции в яичниках. Это приводит к гирсутизму и даже к вирильности.
Эстрогены яичников (С-18-стероиды) — это образуемый из андростендиона эстрон (Е1) и дериват тестостерона — эстрадиол (Е2). Адипоциты и другие экстраовариальные ткани дают преимущественно Ег У женщин детородного возраста преобладает Е2 так как доминирующий фолликул и желтое тело синтезируют в основном именно его. В постменопаузальный период, при отсутствии функционирующих фолликулов, большее значение приобретает Е1 Из Е1 и Е2 в почках, печени и других тканях может формироваться эстри- ол (Е3), основной эстроген, выводимый с мочой. При беременности плодо-плацентарный комплекс подключается к продукции эстрогенов, поставляя, главным образом, эстриол (Е3). Биологическая активность Е1/Е2/Е3 соотносится примерно как 1/10/3.
Печень — главный орган катаболизма и взаимопревращения эстрогенов. Синтез оксипроизвод-ных эстрогенов в печени и других тканях стимулируется тиреоидными гормонами, а продукция эстриола при гипертиреозе, наоборот, снижается. В печени эстрогены подвергаются также о-метилированию до катехол-эстрогенов, которые выводятся с мочой.
Интересно, что у жеребцов основным местом продукции эстрадиола, которым их моча уникально богата, служат ... семенники, содержающие эстрогенов намного больше, чем яичники кобыл. Хотя В.В. Мая ковский отмечал: «Деточка, все мы немножко лошади...», у людей и обезьян продукция эстрогенов в семенниках минимальна, а в надпочечниках—несравнимо меньше, чем в яичниках, поставляющих у женщин 95 % этих гормонов.
Эстрогены — гормоны-индукторы считывания генетических программ, ответственных за развитие вторичных женских половых признаков. Они действуют через образование комплекса в цитозоле клеток-мишеней с рецепторным белком эстрофилином I. Комплекс стероида и рецептора (эстрофилин-11-5S-стероидный комплекс) поступает в ядра клеток, где взаимодействует с цис-регуляторными элементами хроматина. Возможно, в некоторых тканях, в частности, матке — внутриядерному транспорту комплекса содействует а-фетопротеин.
Эстрогены осуществляют стимуляцию роста в ряде органов, прежде всего, половых. Они способствуют росту матки и протоков молочных желез. В связи с этим, гиперэстрогенизм является фактором риска для развития миом матки, а также рака грудной железы.
 Эстрогены стимулируют окостенение метаэпифи-зарных хрящей и останавливают рост тела в длину у девушек. При нехватке эстрогенов отложение кальция в костях нарушается, что лежит в основе остеопороза, развивающегося у женщин в постменопаузальный период (см. выше). В то же время в организме половозрелой женщины в детородный период эстрогены способствуют повышению содержания кальция в крови и его отложению в длинных трубчатых костях, вызывая потерю кальция тазовыми костями. В сальных железах и кожных волосяных фолликулах эстрогены тормозят пролиферацию клеток и секрецию.
Эстрогены стимулируют окостенение метаэпифи-зарных хрящей и останавливают рост тела в длину у девушек. При нехватке эстрогенов отложение кальция в костях нарушается, что лежит в основе остеопороза, развивающегося у женщин в постменопаузальный период (см. выше). В то же время в организме половозрелой женщины в детородный период эстрогены способствуют повышению содержания кальция в крови и его отложению в длинных трубчатых костях, вызывая потерю кальция тазовыми костями. В сальных железах и кожных волосяных фолликулах эстрогены тормозят пролиферацию клеток и секрецию.
Внутриклеточным медиатором ростовых эффектов эстрогенов во многих тканях служат орнитиндекар-боксилаза и её продукты — полиамины путресцин и спермидин.
Эстрогены обладают способностью стимулировать биосинтез фосфолипидов, особенно—в половых органах, но также и в печени. С этим связаны их липотроп-ный, антиатерогенный и гиполипопротеидемический эффекты.
Другие аспекты действия эстрогенов рассмотрены ниже при описании овариально-менструального цикла.
Зная, что именно андрогены служат в нормальном женском организме основными предшествениками эс трогенов, остаётся лишь удивляться прозорливости 3. Фрейда. Задолго до открытия половых стероидов он писал (1921 г.): «... в каждом человеке имеются муж- ские и женские элементы, только, в соответствии с принадлежностью к тому или иному полу, одни не соизмеримо более развиты, чем другие, поскольку дело касается гетеросексуальных лиц».
Единствеными реально значимыми природными прогестинами (С-21 -стероиды) у человека служат про гестерон и 17-гидроксипрогестерон. Их вырабатывают интерстициальные и текальные клетки яичника, но особенно — желтое тело (временная эндокринная железа, формируемая внутри яичника из остатков фолликула после овуляции — см. ниже). В желтом теле биосинтез прогестерона примерно в 30-40 раз эффективнее, чем в других овариальных структурах. Проге стерон вырабатывается и в плаценте (см. ниже).
Некоторые женщины вырабатывают необычный прогестин — 20-в-оксипрегнандиол. Показано, что, попадая через грудное молоко к новорожденному, это соединение блокирует образование диглюкуронида-билирубина печенью ребенка и вызывает продлённую неонатальную гипербилирубинемию.
Транспорт прогестерона в крови осуществляют транскортин и орозомукоид.
Прогестины, гормоны-индукторы программ беременности, действуя через двукомпонентный цитоплаз-
матический А-В-рецептор, обеспечивающий внутриядерное проникновение гормона и его взаимодействие с негистоновыми белками хроматина, осуществляют комплекс изменений, которые нужны для имплантации и гестации. Они активируют секрецию желез эндометрия, децидуальную реакцию, ингибируют сокращения миометрия, тормозят на центральном уровне оксито-циновую секрецию в ответ на растяжение влагалища. В грудных железах прогестины способствуют гиперплазии железистых клеток.
Прогестерон ускоряет дифференцировку тимоци-тов, обладает иммуносупрессорным эффектом. Имеются наблюдения о связи между прогестероном и уровнем продукции белков острой фазы в печени. Про гестерон также является термогенным гормоном, повышая уровень температуры тела в лютеальную фазу овариально-меструального цикла. Другие эффекты прогестерона рассмотрены ниже.
Интегральная характеристика ритмических эндокринных функций гипоталамо-гипофизарно-овариально-го аппарата в норме сводится к следующему.
В пубертате под влиянием импульсно-циклических колебаний секреторной активности гонадотрофов начинается циклическое созревание и атрезия групп фолликулов (от 3 до 30 за один раз) в яичнике и соответствующие цикловые изменения в уровне эстрогенов и прогестинов. Эти колебания заставляют эстроген-зависимые ткани и органы претерпевать созревание и фазовые изменения. Проявлением этих взаимодействий гипоталамуса, гипофиза, яичников и матки служит овариалъно-менструальный цикл, а установление первого такого периода носит название менархе (ГуркинЮ.А, 1993).
В ходе осуществления менструального цикла периодически меняется и активность других эндокринных желез —щитовидной, надпочечников, а также продукция ряда белков в печени, функция всех органов-мишеней овариальных гормонов. Ритмичность деятельности яичника, а также клеток-мишеней его гормонов связана с необходимостью обеспечить оптимальные условия, с одной стороны, для полового акта и оплодотворения яйцеклетки, с другой—для сохранения и развития зиготы.
Циклическая деятельность гипоталамо-гипофизар-но-гонадной оси и тканей-мишеней овариальных гормонов продолжается вплоть до возрастного уменьшения гонадотропной и гонадной эндокринной активности {климактерического периода).
Цикличность заключается в чередовании фолликулярной фазы (когда преобладает продукция андроге-нов в теке яичника и их ароматизация в эстрогены в гранулёзе) и лютеальной фазы (когда остатки разорван-
333
ного при овуляции зрелого фолликула насыщают организм прогестероном).
В начале очередного цикла (рис. 91) под влиянием гонадолиберина усиливаются секреция ФСГи с некоторым отставанием по фазе — также ЛГ. Под влиянием ФСГ в яичнике группа примордиальных фолликулов начинает созревать и расти. Обычно лишь один фолликул из группы достигает пика созревания и даёт начало зрелой яйцеклетке, которая и выйдет в половые пути женщины в день овуляции, на границе фолликулярной и лютеальной фаз.
ЛГ при участии ФСГ стимулирует в яичнике также синтез, превращения и секрецию стероидных гормонов. Клетки теки, побуждаемые ЛГ, вырабатывают андрогены, и те диффундируют в клетки гранулёзы, где превращаются с участием фермента ароматазы, чувствительного к ФСГ, в эстрогены (17-в-эстради-ол, и, в меньшей степени — в эстрон, эстриол). В результате уровень эстрогенов нарастает в течение всей фолликулярной фазы (Пищулин А. А. ,1991).
Под влиянием эстрогенов эндометрий в матке про-лиферирует, утолщается и приобретает прямые железы, содержащие жидкий секрет. Вагинальный эпителий накапливает гликоген, слущивается, и животный крахмал переходит во влагалище в лактат, обусловливая закис-ление вагинального содержимого и предохраняя половые пути от развития ряда патогенных микроорганизмов.
В самом яичнике эстрогены вместе с ИФР- I стимулируют пролиферацию фолликулярных клеток, что еще больше увеличивает фолликул. Первичные фолликулы переходят во вторичные. Появляется доминантный фолликул, опережающий в росте все прочие и приобретающий толстую оболочку — теку. Наружная тека имеет соединительнотканную структуру, а внутренняя тека — представлена интерстициальными клетками, близкими к клеткам Лейдига тестикул и образующими андрогены.
Эстрогены и ФСГстимулируют экспрессию рецепторов ЛГна клетках теки и гранулёзы. Это ведет к началу стимуляции с помощью ЛГ продукции андроге- нов в теке, эстрогенов и, особенно — прогестерона в гранулёзе в конце фолликулярной фазы. Андрогены замедляют дальнейшую пролиферацию клеток гранулёзы. Прогестерон стимулирует выброс ФСГи его пик в середине цикла. ФСГ усиливает транспорт жидкости в полость фолликула. Вторичный фолликул увеличивается в диаметре и превращается в третичный (граафов пузырёк). Под влиянием эстрогенов наступает срединный пик секреции ЛГ.
В середине цикла (чаще на 11-13-й день), на фоне всплеска в секреции обоих гонадотропинов, вызванного гиперэстрогенизмом и прогестеронемией, а так-
334
же максимума продукции яичниковых андрогенов, доминантный созревший фолликул разрывается, нарушая целостность стенки яичника. Яйцеклетка выходит в яйцевод и далее движется к эндометрию. Создается возможность её оплодотворения (Уайт А. с соавт.,1981), Остаток фолликула под действием ЛГ превращается в желтое тело. Клетки желтого тела под действием ЛГ и пролактина синтезируют и выделяют большое количество эстрогенов и особенно — прогестерона. При этом уровень ФСГи ЛГ понижа-ется, так как прогестерон инактивирует положительный механизм обратной связи, и секреция аденогипо-физа временно находится лишь под ингибирующим влиянием 17-в-эстрадиола.
Прогестин-эстрогеновая стимуляция эндометрия приводит к превращению прямых желёз в извитые, жидкий секрет трансформируется в густой, начинается его активное выделение (секреторная фаза развития эндометрия). Прогестерон поддерживает тонус шейки матки и делает миометрий тела матки менее возбудимым.
При быстром ингибировании прогестинами и эст рогенами секреции ЛГ желтое тело, зависящее от его тройного действия, может сохраняться лишь недолгое время, уровень прогестерона достигает акрофазы на 8-9 день после овуляции, и corpus luteum инволюцирует в пределах 2-х недель. Это ведет к стремительному падению концентраций эстрогенов и прогестерона. В отсутствие этих гормонов эндометрий не может больше поддерживаться в секреторной фазе и отторгается. Следует менструация, которая начинается на фоне минимального содержания прогестиновых и эстрогеновых стероидов и знаменует окончание трёхфазного цикла, средняя общая продолжительность которого составляет около 28 суток. Сама менструальная фаза цикла длится 3-5 дней.
Надо отметить, что эндометрий матки как в небе-ременном состоянии, так и при беременности является источником нескольких гормонов и множества цитоки-нов. Здесь вырабатываются пролактин, релаксин, ренин, опиаты, кортиколиберин, кальцигенин, фиб- ронектин, разнообразные факторы роста, интер- лейкины и эйкозаноиды.
На основе этих потенций при формировании плаценты с участием плода беременная женщина обретает новый мощный эндокринный орган.
При этом в случае оплодотворения и наступления беременности характер эндокринной активности гонад меняется, и система выходит из циклов путем продления прогестиновой фазы за счет образования формирующейся плацентой хорионического гонадотропина. Имплантация следует как раз на пике лютеальной секреции прогестерона. С 11-12-го дня после оплодотво-
 рения концентрация хорионического гонадотропина удваивается каждые 2-3 дня. Секреция хорионического гонадотропина, в отличие от ЛГ и ФСГ, не ингибиру-ется прогестинами и эстрогенами, поэтому он поддерживает в сохраняющемся желтом теле беременности длительную прогестероновую секрецию, обеспечивающую с помощью высокого уровня прогестинов нормальное протекание беременности вплоть до становления стероидогенной функции самой плаценты, не менее чем в течение 6-8 недель. К тому же беременная матка перестает выделять простагландины, оказывающие при обычных циклах лютеолитический эффект.
рения концентрация хорионического гонадотропина удваивается каждые 2-3 дня. Секреция хорионического гонадотропина, в отличие от ЛГ и ФСГ, не ингибиру-ется прогестинами и эстрогенами, поэтому он поддерживает в сохраняющемся желтом теле беременности длительную прогестероновую секрецию, обеспечивающую с помощью высокого уровня прогестинов нормальное протекание беременности вплоть до становления стероидогенной функции самой плаценты, не менее чем в течение 6-8 недель. К тому же беременная матка перестает выделять простагландины, оказывающие при обычных циклах лютеолитический эффект.
Пик секреции хорионического гонадотропина приходится на 80-й день беременности.
Примерно с 11-й недели беременности продукция хорионического гонадотропина уменьшается, но беременность развивается при стабильно высоком уровне прогестерона благодаря плаценте, которая работает вместе с плодом как единый стероидогенный комплекс, превращая фетальные андрогены — в эст рогены и вырабатывая прогестины.
Плацента — активный полигормональный эндокринный орган. Например, синтез эстрогенов жёлтым телом и плацентой столь мощен, что за 9 месяцев гес-тации у женщины образуется больше эстрогенов, чем за 100 лет непрерывных овариально-менструальных циклов.
Помимо описанного выше хорионического гонадотропина и половых стероидов (в основном эст-риола и прогестерона), плацента вырабатывает еще ряд гормонов.
Хорионический соматомаммотропин (он же — плацентарный лактоген) — гомолог СТГи ПРЛ, стимулирующий при беременности развитие молочных желёз. Его уровень в крови беременных растет с 6-й недели и до 6-го месяца беременности. Данный гормон в настоящее время считают основным сигналом, обусловливающим метаболические изменения в организме женщин, характерные для беременности. Под его влиянием происходит адаптация к метаболической ситуации своего рода «ускоренного голодания», создающейся при беременности. Этот контринсулярный регулятор предохраняет плод от гипогликемии.
При беременности быстрый отток субстратов энергетического метаболизма к плоду и их утилизация создают постоянную тенденцию к гипогликемии. Плацен тарный лактоген усиливает липолиз, повышает уровень свободных жирных кислот в крови матери, а также содержание глюкозы и, наконец, кетоновых тел. Именно поэтому беременные женщины предрасположены к развитию кетоацидоза. Известна также связь беременности и декомпенсации сахарного диабета. Наряду с
глюкозой, благодаря действию этих гормонально-метаболических механизмов, кетоновые тела служат важным источником энергии для плода и беременной матери (Американская диабетическая ассоциация, 2003).
Пролактин (ПРЛ) — врабатывается в плаценте клетками синцитиотрофобласта. Высокий уровень ПРЛ при беременности поддерживают аденогипофиз матери и плода, а так же децидуальная ткань плаценты. ПРЛ стимулирует иммунитет, функции желтого тела беременности, готовит к лактации молочные железы и участвует в регуляции водно-солевого обмена у плода. Вместе с плацентарным лактогеном, он участвует в вышеописанной метаболической перестройке организма беременной женщины.
Плацентарные аналоги СТГ и сам гормон роста, образуемые плацентой, могут обусловить некоторое увеличение мягких тканей и хрящевых органов при беременности, подобно тому, как гормон роста вызывает это при акромегалии.
Релаксин, близкий к инсулину и ИФР, содержит две полипептидных цепи (22 и 32 аминокислоты с двумя ди-сульфидными мостиками), выделяется цитотрофобла-стом (и желтым телом), служит гормоном подготовки к родам. Релаксин оказывает при беременности расслабляющее действие на матку, перед родами расширяет её зев, размягчает шейку и уменьшает плотность лонного и иных тазовых сочленениий. Раннее введение большой дозы релаксина вызывает рассасывание плода у крыс, не нарушая продукции прогестерона.
ПОМК, его дериваты и кортиколиберин — также образуются в плаценте и имеют отношение к развитию при беременности некоторых поведенческих особенностей, а также к относительному гиперальдостеронизму у беременных и индукции акта родов (особенно важен кортиколиберин). Под их влиянием в конце беременности синтез половых стероидов уменьшается, а глю- кокортикоидов — растёт.
Плацента выделяет также тиролиберин, сомато-статин, ингибин и активин, различные факторы роста, цитокины, проренин, специфические маркеры беременности — (3-гликопротеид (имеющий, по некоторым данным, иммуносупрессорные функции) и плазменный белок А (с неизвестными функциями).
Совокупность действующих на организм и, в частности, —на центральную нервную систему сигнальных факторов, вырабатываемых плацентой, играет решающую роль в формировании так называемой «доминанты беременности».
Таким образом, эндокринные и паракринные продукты женских половых органов осуществляют регулятор-
335
ные эффекты в самом яичнике, обратную связь с гипо-таламо-гипофизарным нейросекреторным аппаратом и ЦНС, модулируя, в частности, половое поведение женщины, а также стимуляторные влияния на матку, яйцеводы, влагалище, благоприятствующие транспортировке гамет, оплодотворению и имплантации, успешному протеканию беременности.
Переходим к описанию основных заболеваний половой системы у подростков. Вначале рассматриваются варианты и проявления гипо- и гипергонадизма у юношей, а затем — у девушек.
МУЖСКОЙ ГИПОГОНАДИЗМ
Нарушения тестикулярной эндокринной функции могут быть условно разделены на мужские гипогонадизм и гипергонадизм.
Возможно развитие различных форм мужского ги-погонадизма и гипергонадизма.
Гипогонадизм у мужчин — тестикулярная недо статочность — проявляется нарушением сперматогенеза, гипоандрогенизмом, часто — недоразвитием вторичных половых признаков и, как правило, — бесплодием. Гипогонадизм может иметь первичное, вторичное и внежелезистое происхождение. Из-за нехватки андрогенов внешний вид больных похож на картину, наблюдавшуюся после кастрации у евнухов («евнухо- дизм»).
Вторичный гипогонадизм развивается из-за поражения гипоталамо-гипофизарного нейросекреторного аппарата и бывает гипогонадотропным.Он наблюдается либо как врождённый, либо как приобретённый синдром при множестве разных нарушений.
Врождённые формы вторичного гипогонадизма чаще всего связаны с наследственными дефектами. При синдроме Кальмана (см. также выше раздел, посвященный гипоталамо-гипофизарному нейросекре-торному комплексу) имеется сцепленная с Х-хромосо-мой рецессивная недостаточность фактора, ответственного за миграцию гонадолиберинергических нейронов из обонятельного мозга в аркуатное ядро. Недостаточность продукции гонадолиберина и гонадот- ропинов сочетает признаки гипогонадизма с аносми-ей и дефектами срединных анатомических структур мозга и черепа, глухотой и синдактилией. Больные подростки внешне евнухоидны и имеют крипторхизм. Частота этого нарушения находится в пределах 1:10000-1:60000.
Описан наследственный аутосомно-рецессивный дефект в-субъединицы ЛГ— синдром Паскуалини. У больных евнухоидный вид, но продукция ФСГне нарушена, поэтому сперматогенез идёт удовлетвори-
336
тельно, хотя из-за гипоандрогенизма отмечают оли-гозооспермию, и поэтому в большинстве случаев фер-тильность снижена.
Синдром Мэддока, описанный в виде единичных случаев неизвестной этиологии, это сочетание евнухоидизма и хронической вторичной адренокортикальной недостаточности. У пациентов отсутствует продукция гонадотропинов и АКТГ. Так как клиника синдрома часто развертывается после пубертата, его отнесение к врожденной разновидности вторичного гипогонадизма вызывает сомнения.
Краниофарингиомы могут нарушать изолированно продукцию гонадолиберина, вызывая врождённый вторичный гипогонадизм. Приобретенный вторич ный гипогонадизм встречается нередко. К нему могут привести различные факторы, угнетающие продукцию гонадолиберина и гонадотропинов. Среди них — тяжелые физические нагрузки (гипогонадизм спортсменов), голодание, стресс, аутоиммунные поражения гипоталамуса и гипофиза (см. выше). Нередко такой гипогонадизм сочетается с другими гипота-ламо-гипофизарными синдромами и симптомами — несахарным мочеизнурением, гипергликемией, нарушениями термостатической и липостатической регуляции. Так как в аркуатном ядре имеются и половые, и липостатические регуляторы, очень часто гипогонадизм сочетается с гипоталамическим ожирением. Поэтому, в клинике существует термин «адипозоге- нитальная дистрофия», обозначающий сочетание приобретенного гипогонадизма и гипоталамического ожирения. Данное понятие обозначает не нозологическую форму, а симптомокомплекс, который может иметь различные (в том числе опухолевые, травматические, аутоиммунные, инфекционные, комбинированные) причины, поражающие дугообразное ядро.
Персистирующая гиперпролактинемия у мужчин и у женщин служит важной причиной приобретенного вторичного гипогонадизма.
Первичный гипогонадизм у мужчин в классическом виде наблюдается при кастрации. Поэтому прежде чем представить обзор его разнообразной этиологии, опишем типовые гормонально-метаболическиеи патофизиологические последствия экстирпации тести-кул. Многие симптомы кастрации однотипны у мужчин и женщин и воспроизводятся в соответствующем виде при удалении яичников. Поэтому описание этого синдрома в разделе, посвященном нарушениям овариаль-ных функций, повторено не будет. Евнухоидный внешний вид кастратов воспроизводится полностью или частично во всех случаях, когда имеется ранний гипо-андрогенизм любой этиологии. Следовательно, данное

 описание приложимо не только к евнухоидизму, вызванному кастрацией.
описание приложимо не только к евнухоидизму, вызванному кастрацией.
Симптомокомплекс кастрации развивается при полном удалении гонад. Если оставить даже небольшую часть ткани семенника (1 %), компенсаторная гипер-гонадотропная гиперфункция оставшейся ткани предотвратит развитие гипоандрогенизма.
Последствия кастрации тем выраженней, чем раньше она произведена. У лиц, кастрированных в зрелом возрасте, нарушения могут быть минимальны и выражаться, в основном, в стерилизации. Даже частота бритья бороды после удаления семенников у половозрелых пациентов длительное время остается неизменной, так как многие морфогенетические эффекты анд- рогенов (и, стало быть, — их отсутствия) нуждаются в длительном временном периоде для своего полного проявления. Более того, при сформировавшихся стереотипах полового поведения половозрелые кастраты могут длительное время сохранять способность к обычной половой жизни и рефлекторно поддерживаемое либидо, хотя у них имеется аспермия. В дальнейшем поздний гипоандрогенизм выражается в уменьшении оволосения тела, истончении волос на голове, снижении либидо, эрекции, могут быть приливы крови к лицу, как у женщин в климактерический период. Уменьшается мышечная сила, возникает геродерма— постарение кожи, могут быть гинекомастия и изменение распределения жира по гиоидному типу.
При кастрации неполовозрелого организма изменения касаются наиболее широкого круга органов и систем.
При раннем гипоандрогенизме долго продолжается рост конечностей в длину, а развитие пубертатных особенностей таза и плечевого пояса, костей черепа— наоборот, задерживается.
Поэтому при евнухоидизме рост больных высокий за счет изменения длины ног (нижние конечности составляют не менее половины длины тела + 5 см). Размах рук превышает длину тела + 5 см. В то же время таз и плечи относительно узкие, затылочная кость несколько уплощена. Нередко бывает искривление позвоночника, связанное с отставанием формирования мышечного каркаса осанки при гипоандрогенизме. Все это создает вид астеничный, хотя евнухоиды физически чаще всего полноценные люди (рис. 95 — слева). При кастрации, произведенной во взрослом состоянии, нередко бывает вторичное ожирение (рис. 95 — справа). Развитие гениталий «останавливается на том этапе, когда была произведена кастрация» (Медведева Н.В., 1947). Полового созревания не наступает, а выраженность имевшихся вторичных половых признаков уменьшается. Голос у рано кастрированных мужчин из-за со-
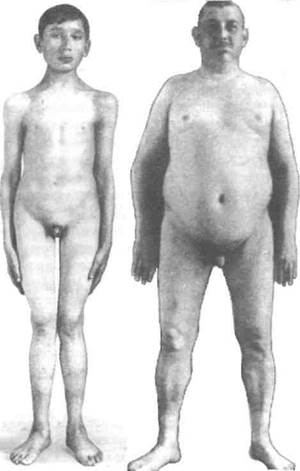
Рис. 95. Евнухоидизм (по В. Фальта, 1913)
хранения детского строения гортани остается высоким, горловым, лишен обертонов. Однако гортань растёт, что создает иногда очень своеобразный, уникальный вокальный тембр. Это обстоятельство даже служило в прошлом причиной кастрации певчих. До сих пор любителей музыки волнует драматическая история блистательного итальянского певца XVIII столетия Фари-нелли, кастрата с детства, обладавшего неповторимым голосом, близким к своеобразному сопрано.
Затянувшийся инфантилизм сменяется у кастратов ранней старостью, у многих из них укорочен или отсутствует период психосоматической зрелости. Из-за гипер-липопротеидемии быстрее развивается атеросклероз.
Тем не менее вышеназванный исторический пример, а также история средневекового французского философа П. Абеляра и хроникальные сведения о евнухах, занимавших видные военные, политические и государственные должности в Византии, Оттоманской Порте и других странах Востока подчёркивают, что при евнухоидизме, связанном с первичным гипогонадизмом,
337
индивид остается умственно полноценной личностью и может быть полноценным социально, тем более, что происходит сублимация половой энергии в иных формах активности.
Метаболические последствия первичного гипогона-дизма и кастрации включают наклоность к ожирению (больше—у женщин), снижению основного обмена, ги-перхолестеринемии, креатининемии и креатинурии (больше — у мужчин). Несмотря на контринсулярный характер действия половых стероидов на обмен глюкозы, кастрация не ведет к гипогликемии.
Первичная тестикулярная недостаточность разнообразна по этиологии и бывает как врожденной, так и приобретенной.
Врожденный характер первичный мужской гипого-надизм носит при синдроме Кляйнфельтера (47XXY, частота 1/400-1/500), который проявляется в тестикулах дизгенезией семенных канальцев и андрогенной недостаточностью. Сюда же относятся многие случаи мужского псевдогермафродитизма. Некоторые формы врожденной тестикулярной недостаточности вызывают только дефект сперматогенеза при отсутствии гипоан-дрогенизма. Таковы варикоцеле и крипторхизм (составляющие до 40% всех причин мужского бесплодия), а также аутосомно-рецессивный синдром системной неподвижности клеточных ресничек, при котором азооспермия сочетается с хроническими обструктивными бронхитами). Эти состояния не являются эндокринопа-тиями. При синдроме делъ Кастильо имеется наследственная аплазия герминативных клеток сперматоген-ного эпителия, уровень сперматогенеза резко понижен, а содержание ФСГ повышено. При этом клетки Серто-ли сохранены, и гипоандрогенизма не наблюдается. Есть предположение, что аналогичные состояния могут быть результатом приобретенного аутоиммунного поражения, спровоцированного вирусной инфекцией.
Приобретенная первичная тестикулярная недостаточность, кроме кастрации, развивается в результате воспаления тестикул и их придатков. Орхит и орхо-эпидидимит бывают инфекционными (наиболее характерно их развитие при свинке), а также аутоиммунными. Аутоиммунные орхиты могут провоцироваться травмой яичек и нарушением гематотестику-лярного барьера (модель такого заболевания была получена на животных Э. Витебским). Провокатором аутоиммунного орхита может выступить и вирусная инфекция (эпидемический паротит, вирус ECHO, арбовирусы). При свинке от 7 до 12% пациентов мужского пола в катамнезе развивают гипогонадизм (Тимченко В.Н., 1986). Известны токсические причины аутоиммунного орхита. Очень характерен ауто-
338
иммунный орхит хронических алкоголиков, который, по некоторым сведениям (Тунг С, 1976), отмечается почти у 60% таких пациентов и представляет важную причину бесплодия при алкоголизме, особенно— юношеском и раннем. При многих системных болезнях с иммунопатологическим компонентом гипогонадизм также может быть результатом аутоиммунных поражений яичек. Гранулёматозные хронические инфекции (особенно часто — проказа и туберкулёз) также поражают яички.
Яички — один из самых радиопоражаемых органов человека, так как, по закону Бергонье-Трибон-до, радиочувствительность ткани пропорциональна количеству в ней незрелых, пролиферирующих элементов, не обладающих выраженными антиоксидан-тными ресурсами. При дозах более 200 мГй, как правило, наступает нарушение сперматогенеза и андростероидогенеза, повышаются уровни ЛГи ФСГ. Патогенез этих нарушений связан с радиационным орхитом и ишемией яичек, провоцируемой их облучением. Сперматогенез и продукция андрогенов нарушаются под действием цитостатиков, спиронолакто-на, кетоконазола и других лекарств.
При хронической печёночной недостаточности, в частности, при циррозе, а также при хронической почечной недостаточности у многих больных-мужчин также отмечается вторичный гипогонадизм. Считается, что при поражении печени это связано с усиленным переходом андростендиона, не захватываемого печенью, в эст рогены во внепеченочных клетках. Гиперэстрогенизм тормозит продукцию ЛГ, что нарушает работу тестикул.
Больные циррозом печени и нефросклерозом имеют гиперпролактинемию. Ее происхождение не вполне выяснено. Очевидно, имеет место задержка клиренса ПРЛ. Гиперпролактинемия у таких мужчин способствует ги-погонадизму и гинекомастии (см. ниже). Существование гипогонадизма при первичных параплегиях, связанных с поражениями спинного мозга, свидетельствует об известной роли вегетативной нервной системы в регуляции тестикулярных функций. Большое значение при этом имеют нарушения кровообращения в денервиро-ванных яичках и аномалии эрекции и эякуляции, которые, как и любая остановка регулярной эвакуации спермы, снижают сперматогенез. Однако показано, что у спи-нальных больных страдает и функция клеток Лейдига.
Несмотря на различия в этиологии и патогенезе, клиническая картина первичного гипогонадизма у мужчин однотипна.
Если первичный гипогонадизм развивается до полового созревания, то формируется евнухоидность. У взрослых мужчин первичная тестикулярная недоста-

 точность, как и при кастрации, сопровождается выпадением волос на лице и теле, их истончением на голове, уменьшается мышечная сила, стареет кожа, могут нарушаться либидо и эрекции, возникает олигоспермия. Впрочем, в некоторых случаях (микоплазменныи орхит, лихорадочные заболевания, целиакия) сперматогенез страдает сильно, а гипоандрогенизм не возникает.
точность, как и при кастрации, сопровождается выпадением волос на лице и теле, их истончением на голове, уменьшается мышечная сила, стареет кожа, могут нарушаться либидо и эрекции, возникает олигоспермия. Впрочем, в некоторых случаях (микоплазменныи орхит, лихорадочные заболевания, целиакия) сперматогенез страдает сильно, а гипоандрогенизм не возникает.
Еще одна важная группа причин гипоандрогенизма у мужчин является внежелезистой и связана с полным (синдром Морриса) или частичным (синдром Рейфен- штейна) отсутствием тканевых рецепторов андроге нов. Поскольку эти нарушения носят врождённый характер и относятся к мужскому псевдогермафродитизму, они подробно рассмотрены в соответствующем разделе выше.
МУЖСКОЙ ГИПЕРГОНАДИЗМ
Гипергонадизм у мужчин выражается прежде всего в тестикулярном гиперандрогенизме. При раннем и врожденном гипергонадизме это связано с синдромом изосексуального преждевременного полового созревания. Механизмы нормального пубертата были описаны выше.
Преждевременным считается появление у маль чиков вторичных мужских половых признаков и уве личение половых желёз в возрасте ранее 10 лет. Преждевременное изосексуальное половое созревание у мальчиков встречается вдвое реже, чем у девочек. Оно сопровождается ранним пубертатным скачком роста с быстрой его остановкой из-за преждевременного окостенения метаэпифизарных зон. Психическое развитие при этом, как правило, соответствует возрасту, то есть отстает от физического.
Истинное или полное преждевременное половое созревание характеризуется активацией как гормоно-образующей, так и сперматогенной функции тестикул. Ложное — неполное — манифестирует гиперандро-генизмом и маскулинизацией вторичных половых признаков, но без появления сперматогенеза по взрослому типу. При классическом полном изосексуальном половом созревании активирована вся ось гипоталамус-гипофиз-гонады, поэтому в тестикуле гиперфункция эндокринных элементов сочетается с диффузной активизацией сперматогенеза.
Однако при многих случаях ложного неполного преждевременного полового созревания, хотя первичной активации гонадотропного механизма нет, он может активироваться вторично. Кроме того, при автономном, опухолевом источнике андрогенов в яичке, сверхвысокая местная концентрация андрогенов может, при низком уровне ФСГ, вызвать локальную активизацию
сперматогенеза. Поэтому дифференцировка ложного полового созревания бывает затруднительна.
Синдром преждевременного полового созревания может иметь и негонадные причины. К нему приводят нарушения функций шишковидной железы (в частности, ее гамартомы, вырабатывающие хорионический гона- дотропин — что наблюдается при macrogenitosomia praecox {синдром Пелицци) и сетчатой зоны коры надпочечников (см. выше — андростеромы и адреногени-тальный синдром). При эпифизарных причинах преждевременного возмужания активируется и гонадотропная, и гонадная функции—по истинному типу.
Считается, что возможны и неэпифизарные церебральные причины истнного повышения секреции го- надолиберина и/или гонадолибериновой чувствительности аденогипофиза, приводящие к истинному полному преждевременному половому созреванию. Среди них называют опухоли, инфекции и повреждения мозга.
Следует, однако, подчеркнуть, что гонадотропин-сек-ретирующие опухоли аденогипофиза, хотя они и встречаются нередко, и достигают больших размеров, как правило, не вызывают клиники гипергонадизма. Описаны лишь единичные случаи увеличения тестикул и ги-перандрогенизма в результате опухолевой продукции аденомами гипофиза, соответственно ФСГиЛГ. В большинстве случаев секретируются гонадотропины с дефектной структурой или их отдельные субъединицы. Это может быть связано с аномалией их гликозилирования или с наличием аутоантител к их субъединицам.
Так или иначе, гораздо чаще гипергонадизма при го-надотропиномах аденогипофиза развивается гипогона-дизм. Он отличается от первичного гипогонадизма высоким содержанием ингибина в крови (в ответ на гиперпродукцию ФСГ). Для первичного гипергонадо-тропного гипогонадизма характерен низкий уровень концентрации ингибина.
При надпочечниковых вирилизующих синдромах активируется андростероидогенез вне тестикул. Яички остаются небольших размеров, увеличения продукции гонадотропинов и активации сперматогенеза нет. Преждевременное половое созревание чаще протекает по ложному типу. Изредка в преждевременном половом созревании повинна гепатобластома, сек-ретирующая хорионический гонадотропин.
Гонадные причины преждевременного возмужания у мальчиков связаны с доброкачественными (аденомы) и злокачественными (карциномы) опухолями интерсти-циальных клеток семенника. Опухоли насыщают организм андрогенами. Сперматогенез в части пораженной тестикулы стимулируется адекватно имеющимся
339
гормональным и морфологическим изменениям, фер-тильность также наступает в раннем возрасте. Отличительной особенностью опухолевого гипергонадизма является одностороннее увеличение яичка.
Существуют аутосомная, ограниченная мужским полом, и рецессивная Х-сцепленная формы наследственной неопухолевой гиперплазии клеток Лейдига. Возможно, речь идет об их первичной гиперчувствительности к ЛГ. При этом клиническая картина соответствует очень раннему истинному преждевременному половому созреванию (в возрасте до 2 лет!) с двусторонним увеличением яичек.
Преждевременное гетеросексуальное половое созревание у мальчиков вызывается при избыточном автономном синтезе эстрогенов в организме. Чаще всего источником служат аденомы и карциномы из клеток Сертоли (реже — из клеток Лейдига), если они продуцируют аномально большие количества женских половых гормонов. При этом обычно развивается гиперэстрогенная гинекомастия. Интересно, что эстрогены могут образовываться самими опухолевыми клетками или оставшейся здоровой частью тестикул — под влиянием опухолевого хорионического гонадотропина. В первом случае продукция собственных гонадотропинов и тестостерона в неопухолевой части семенников понижена. Имеется азооспермия. Во втором случае, наоборот, — уровень гонадотропинов в плазме высокий, продукция тестостерона в неопухолевой части гонад повышена, и азооспермия нехарактерна.
Нетестикулярные опухоли, вызывающие данный синдром (например, в коре надпочечников), также описаны.
Вообще мужские гонады нередко поражаются опухолями (2-6 случаев на 100 000 мужского населения). К опухолям яичек предрасполагает высокий уровень гонадотропинов, в частности, при первичном гипого-надизме, некоторых формах мужского псевдогермафродитизма и синдроме Кляйнфелътера. В 40 раз выше риск этих новообразований при неопущении яичка в мошонку.
Самые распространенные неоплазмы тестикул (95% от общего числа) — злокачественные семиномы (герминомы из гаметогенных клеток эпителия), затем идут дисэмбриогенетические опухоли. Дизэмбриогене-тические опухоли яичек — эмбриокарциномы, хорио-карциномы, опухоли из желточного мешка, тератомы и тератобластомы — отличаются продукцией хорио нического гонадотропина. Специфическим маркером подобных опухолей считается (3-субъединица этого гормона. Семиномы выделяют её не более, чем в
340
10% случаев, а другие вышеназванные неоплазмы — в 90-100%. Ещё один маркер этих опухолей — а-фето-протеин. Хорионическии гонадотропин опухолевого происхождения влияет на продукцию половых стеро идов (см. выше), а а-фетопротеин обладает стимулирующим действием на тромбоциты, в частности, побуждая их к фрустрированному фагоцитозу.
Около 5% опухолей яичка представлены неоплазмами из клеток Лейдига и клеток Сертоли. Эти опухоли в 9/10 случаев доброкачественны и образуют половые стероиды. В зависимости от знака этих гормонов они могут вызвать феминизацию или вирилизацию у своих носителей.
Общая характеристика
эндокринных заболеваний
яичников
Условно эндокринные дисфункции яичников можно подразделить на препубертатные, относящиеся к репродуктивному периоду, а также к менопаузе и постменопаузе. В данной книге мы уделяем внимание в основном первой подгруппе.
Нарушения полового созревания у девушек могут выражаться в преждевременном (как по изосексуаль-ному, так и по гетеросексуальному типам) или в задержанном половом созревании, а также принимать форму своевременного, но гетеросексуального полового созревания с элементами вирилизации.
Иногда преждевременно развиваются лишь отдельные вторичные половые признаки. При гиперчувствительности клеток грудных желёз к эстрогенам это выражается в преждевременном телархе — увеличении молочных желёз. При усилении андрогеновой секреции в сетчатой зоне коры надпочечников может быть изолированное оволосение лобка и подмышек—преждевременное пубархе или адренархе.
О преждевременности полового созревания всего организма говорят, когда полный набор его признаков появляется у девочек в 8 лет и младше. Преждевременное созревание может быть истинным (центральным, со стимуляцией продукции гонадот ропинов) и ложным (периферическим, при неизменной или пониженной гонадотропиновой секреции и повышенном уровне половых гормонов яичников или надпочечников).
При истинной разновидности преждевременного изо-сексуального пубертата, причины гиперсекреции гонадотропинов могут быть связаны с опухолями, другими очаговыми процессами, энцефалитами и менингитами, поражающими подбугорье.
 Очень часто причиной служат неидентифицируе- мые микроаденомы или повышенная чувствительность аденогипофиза к гонадолиберину, развивающа- яся на рецепторном и пострецепторном уровнях, поэтому 90 % таких пациенток при рутинном клиническом обследовании расцениваются как случаи «идиопатического конституционального» преждевременного пубертата.
Очень часто причиной служат неидентифицируе- мые микроаденомы или повышенная чувствительность аденогипофиза к гонадолиберину, развивающа- яся на рецепторном и пострецепторном уровнях, поэтому 90 % таких пациенток при рутинном клиническом обследовании расцениваются как случаи «идиопатического конституционального» преждевременного пубертата.
Если преждевременная феминизация девочек протекает на фоне множественной фибродисплазии костей, асимметрии лица, нарушений функций черепно-мозговых нервов, появления кожных пятен цвета кофе с молоком — это расценивается как синдром МакКьюна-Ол- брайта, когда причины стимуляции гонадотропной функции могут быть связаны с аномалиями формирования турецкого седла и срединных образований черепа.
Другой симптомокомплекс, включающий изосексу-
альную преждевременную феминизацию, известен как
синдром Сильвера-Расселла (помимо преждевре-
менного пубертата, отмечаются клинодактилия, вы-
раженная задержка роста вплоть до примордиальной
карликовости, асимметрия фигуры, уменьшенное дефор-
мированное турецкое седло и треугольное лицо).
Нередко врождённый первичный гипотироз способствует развитию ускоренного истинного полового со- зревания. Тиролиберин, в избытке ситезируемый при этом, способен оказывать пролактолибериноподобный и гонадолибериноподобный эффекты.
Ложное изосексуальное половое созревание де- вушек связано с эстрогенообразующими опухолями ова- риального и надпочечникового происхождения. К нему может привести также ятрогенное действие лекарств, содержащих женские половые стероиды и изредка — опухоли, локализованные вне центральной нервной системы и вырабатывающие хорионический гонадотропин. Практически все случаи гетеросексуального преж-
|
|
девременного полового созревания у девушек вызва-ны либо вирилизующей формой врождённой гиперпла- зии коры надпочечников (обычно 21-гидроксилазной недостаточностью — см. выше), либо андростерома- ми яичника или надпочечника.
Задержка полового созревания у девочек выражается в несвоевременно позднем появлении вторичных половых признаков (позже 13 лет) и в первичной аменорее к возрасту 16 лет или старше (в норме менструации начинаются не позднее, чем через 5 лет от появления те-лархе).
Это может быть вызвано нарушением формирования
мюллеровых структур при нормальной эндокринной и
овогенной функции гонад. Однако отмечаются и случаи
гипогонадизма как гипергонадотропного (связанного с
первичной овариальной недостаточностью, например, с синдромом Шерешевского-Тёрнера), так и гипогона-дотропного (вызванного вторичной дисфункцией яичников на почве гипоталамо-гипофизарной патологии).
При своевременном гетеросексуальном половом созревании пубертат наступает в срок, но характеризуется смешанной картиной феминизации и вирилизации. К такому развитию событий могут привести наиболее часто синдром поликистозных яичников и реже — нетяжёлые малосимптомные формы вирили-зующей адренокортикальной гиперплазии.
Наиболее широким спектром женских гонадных эндокринных расстройств характеризуется репродуктивный период. Такие синдромы, как дисменорея и пре-менструальная дисфория, знакомы очень многим женщинам и у многих впервые наступают еще в подростковом периоде. Поэтому с их проявлениями должен быть знаком подростковый врач.
Дисменорея — то есть болезненные месячные, сопровождаемые тошнотой, головной болью, диареей— поражает до 50% женщин. Патогенез первичной дис- менореи связан с избыточным образованием проста-гландинов в эндометрии перед месячными и во время менструации. Простагландины, особенно PgF2а, действуя локально и системно, вызывают усиленное сокращение и ишемию матки, боль и другие симптомы.
О вторичной дисменорее говорят, когда имеется провоцирующее ее первичое заболевание. Наиболее тяжелая вторичная дисменорея наблюдается при наличии в брюшной полости эктопических островков эндометрия, реагирующих на циклические изменения эстрогенной и прогестиновой активности (эндометриоз).
Более 150 показателей функционирования женского организма циклически изменяются при осуществлении овариально-менструального цикла. Не удивительно, что так называемый синдром пременструалъного напря жения, отмечаемый почти у 5-10% женщин, характеризуется большим разнообразием проявлений.
Наиболее типична эмоционально-поведенческая сторона этого симптомокомплекса, выражающаяся в тревожости, раздражительности, эмоциональной лабильности таких пациенток. Многие проявления синдрома пременструального напряжения различаются в зависимости от конституции женщин. У очень женственных пациенток с перевесом эстрогенов он выражается в нервной напряженности и в нагрубании груди. У женщин с мальчишеским хабитусом и перевесом прогестинов/андрогенов симптомы включают депрессию и боли в животе и пояснице.
По современным представлениям, в основе синдрома лежат особенности гормонального фона в конце лю-
341
теальной фазы цикла—пониженая продукция эндоген ных опиатов и повышенная — пролактина, повышение выработки вазопрессина, нарушения в содержании а-МСГ. Следствием этого являются метаболические изменения—тенденция к гипогликемии, задержке натрия и воды. У некоторых пациенток обнаружена ауто-аллергия к собственному прогестин-связывающему белку, которая формирует циклический иммунокомплек-сный, а иногда—даже анафилактический процесс.
Несколько реже встречаются различные серьёзные нарушения, обусловливающие у половозрелых, прежде менструировавших женщин прекращение месячных. Это выражается во вторичной аменорее.
Из дальнейшего рассмотрения мы исключаем физиологическую вторичную аменорею при беременности и в менопаузе, а также неэндокринные формы вторичной аменореи — например, связанные с атрофией эндометрия на почве его повторных травм при выскабливаниях {синдром Эшермена).
Эндокринные формы вторичной аменореи у старших подростков включают расстройства гипоталамо-гипо-физарного генеза (вторичная овариалъная недоста точность) и яичникового происхождения (первичная овариалъная недостаточность).
При вторичной овариальной недостаточности, как правило, функционирующие фолликулы имеются, но происходят ановуляторные циклы. Лечение может восстановить овуляцию. Если причины овариальной недостаточности имеют центральный характер, хроническое отсутствие овуляции протекает чаще на фоне низкого уровня эстрогенов. При этом циклической гиперплазии эндометрия нет, и характерным признаком является отсутствие кровотечений при назначении прогестинов.
В некоторых случаях (тиропатии, гиперпролакти-немия) вторичная овариальная недостаточность протекает при нормальном или высоком уровне эстро генов. В этом случае рост эндометрия продолжается, и он может отторгаться в сроки, не совпадающие с ожидаемыми сроками месячных, давая дисфункциональные маточные кровотечения при отсутствии овуляции. Назначение таким пациенткам прогестерона провоцирует кровотечение.
Вторичная овариальная недостаточность (гипого-надотропный женский гипогонадизм) может быть ги- поталамической этиологии.
Как тяжелый острый, так и продолжительный хронический стресс могут нарушить пульсовой ритм секреции гонадолиберина в медиобазальном гипоталамусе. Поэтому стрессогенный образ жизни способен вызвать у пациенток вторичную аменорею при нормальных яичниках. Экстремальные соревновательно-трениро-
342
вочные нагрузки вызывают гонадолибериновую недостаточность и вторичную надовариальную аменорею у спортсменок.
Так как аркуатное ядро является структурой, вовлеченной в лептиновую регуляцию массы тела, продукция гонадолиберина и месячные нарушаются при голодании и у больных нейрогенной анорексией-бу- лимией и другими формами кахексии (см. соответствующий раздел книги).
Лекарственная гипоталамическая вторичная овариальная недостаточность может провоцироваться ад-ренергическими, дофаминэргическими и опиатэрги-ческими средствами, что нередко приводит к вторичной аменорее у наркоманок.
Гипофизарная вторичная овариальная недостаточность характерна для гипопитуитаризма (см. выше), в частности, его послеродовой формы у женщин—син дрома Шихена.
Нередко (в 10-40 % всех случаев вторичной аменореи) она вызвана гиперпролактинемическим синдро мом. В этом случае пролактин стимулирует в гипоталамусе продукцию дофамина, который через эндогенные опиаты блокирует выработку гонадоли берина. Параллельно осуществляется и прямое анти-эстрогенное действие пролактина на яичники.
Таким образом, если дефицит пролактина проявляется гипогалактией и даже агалактией, эти симптомы типичны для дебюта послеродовой гипофизарной недостаточности у матерей, в том числе—юных (Гур- кин Ю. А.., 1993), то избыток пролактина,напротив, ярко манифестирует у лиц обоего пола. До трети всех пациенток с гиперпролактинемией и подавляющее большинство пациентов развивают этот синдром на почве гормонообразующей опухоли аденогипофиза— пролактиномы (см. выше).
Редкие причины овариальной недостаточности центрального генеза связаны с синтезом аномальных а-или в-субъединиц гонадотропинов или продукцией их биологически неактивных форм с нарушенным гликозилированием.
Если все вышеназванные причины хронической ги-поэстрогеновой ановуляции и вторичной гипогонадот-ропной овариальной недостаточности исключены, предполагается наличие так называемой изолированной гипогонадотропной гипофункции яичников — синдрома, этиология которого неясна, но, предположительно, связана с наследственностью. Патогенез этого редкого вида вторичного гипогонадизма ассоциируется с недостаточной чувствительностью гонадолиберино-вых нейронов гипоталамуса к дофамину и, возможно, с избыточным действием на гипоталамо-гипофизар-ный нейросекреторный комплекс ингибина.
Еще предстоит оценить истинную распространённость малоизученной внежелезистой формы овари- альной гипергонадотропной недостаточности, связанной с аутоантителами к циркулирующим гона- Ьотропинам.
Первичная овариальная недостаточность — группа расстройств, для которых характерны аменорея при гиперпродукции гонадотропинов, а также поражения женских гонад: дизгенезия, резистентность к гона-дотропным воздействиям, либо деструктивные процессы в яичниках. В соответствии с рекомендациями ВОЗ, сегодня под первичной аменореей подразумевают отсутствие менструаций в возрасте 16 лет и старше, а не в 18 лет, как это считалось раньше.
Генетические причины первичной гипоэстрогенной гипергонадотропной недостаточности яичников включают, в первую очередь, полное или частичное отсутствие одной из Х-хромосом. При кариотипе 45X0 развивается синдром Шерешевского-Тернера — дизгенезия яичников. В 40% случаев возможны также мозаичные кариотипы с отсутствием Х-хромосомы в части соматических клеток. При этом классический синдром Шерешевского-Тернера связан с женским хромосомным полом и половым недоразвитием. Но некоторые из мозаичных пациентов имеют клетки с кариотипом 45X0 и 46XY, представляя случаи мужского псевдогермафродитизма с делецией Y-хромосомы в части клеток (см. ниже). У таких больных, в отличие от женщин с синдромом 45X0, крайне высок риск тес-тикулярных опухолей в рудиментарных клетках яичек. Поэтому кариотип всех лиц с гипергонадотропной аменореей в возрасте до 30 лет должен проверяться цито-генетически.
Синдром 45X0 — очень распространенная аномалия гоносом (частота не менее 1/3000 женщин). Яичники представлены соединительнотканными тяжами, больные бесплодны, внутренние гениталии рудиментарные женские, наружные—инфантильные женские, развитие вторичных половых признаков задержано. Имеют место первичная аменорея с гипоэстрогенной ановуляцией, низкорослость, крыловидные кожные складки на шее над плечами, бочкообразная грудная клетка, стигмы дизэмбриогенеза (например, готическое нёбо, эпикантус, невусы, низко посаженные деформированные ушные раковины), а также дисплазия костей и суставов, коарктация аорты, наклонность к лимфоста-зу. Коэффициент интеллекта у больных может быть в пределах нормы, ближе к её нижней границе. Характерны гиперсоциальность и большая внушаемость.
Первичная врождёная овариальная недостаточность с аменореей характерна и для некоторых на-
следственных дефектов стероидогенеза. При дефиците 17а-гидроксилазы она сочетается с сексуальным инфантилизмом и избытком минералокортико-идов, ведущим к артериальной гипертензии, дефицит 17,20-лиазы характеризуется половым инфантилизмом. Эти растройства подробно рассматривались как причины адреногенитального синдрома. При галак-тоземии образуются метаболиты, токсичные для яичников, и формируется овариальная недостаточность.
Редкая разновидность овариальной недостаточности — синдром резистентного яичника (синдром Сейведжа), при котором развитие фолликулов останавливается перед антральной стадией, а овуляция не имеет места. При этом женские гонады утрачивают чувствительность к ФСГ. Имеются, очевидно, наследственные формы этого нарушения, связанные с рецепторной, либо пострецепторной аномалией. Однако есть сведения и о синдроме резистентного яичника аутоиммунной природы: в связи с наличием блокирующих ауто-антител к рецепторам ФСГ (Харрисон Л., 1983).
Приобретенная первичная овариальная недостаточность может явиться следствием хирургической экстирпации гонад (кастрации) с целью удаления опухолей и их метастазов. Она также развивается при облучении яичников, применении химиотерапевти-ческих цитостатических средств, особенно — алкили- рующих агентов.
Причиной овариальной недостаточности может быть двусторонний оофорит (воспаление яичников). Этиология оофорита—инфекционная и аутоиммунная. Особенно характерны хроническое течение процесса и развитие гипогонадизма при иммунопатологических оофоритах. Аутоиммунный оофорит бывает частью плюригландулярных аутоиммунных синдромов, сочетаясь с иммунопатологическими поражениями щитовидной, околощитовидных, поджелудочной желез, но особенно часто — коры надпочечников. Интересно, что овариальная недостаточность характерна для носительниц синдромов Ди Георге и Незелофа с аплазией тимуса и иммунодефицитом.
Гиперандрогенизм у женщин, связанный с продукцией избытка андрогенов в надпочечниках, в частности, в опухолях-андростеромах, также вызывает ова-риальную недостаточность и аменорею на фоне гиперэстрогенизма, так как избыток андрогенов активно превращается в яичнике и других тканях в эст рогены.
Важнейшей и самой распространенной формой первичной овариальной недостаточности, сопровождаемой хроническим отсутствием овуляции при наличии гиперэстрогенизма, служит синдром поликистозных
343
яичников (впервые описан отечественным автором С.К. Лесным в 1928 г., известен также как синдром Штейна-Левенталя, синдром склерокистозных яичников, синдром овариальной гиперандрогении неопухолевого генеза).
Синдром наблюдается у 3-6% гинекологических пациенток.
По данным Ю.А. Гуркина (1993), синдром поли- кистозных яичников чаще всего возникает именно в пубертатном периоде.
Для более старших девочек, достигших в предшествующие сроки определённой степени полового созревания, при этом заболевании характерен феномен дефе-минизации, сменяющейся вирилизацией. Это позволяет установить наблюдение в динамике.
Хотя развернутая клиническая картина данного синдрома свойственна женщинам зрелого возраста, мы включили его рассмотрение в круг задач данной книги, так как, по нашим данным, у девушек с гипоталами- ческим синдромом пубертатного периода (см. выше) без лечения может происходить в дальнейшем закономерное развитие этого заболевания. Таким образом, вероятно, что синдром Лесного-Штейна-Левенталя имеет факторы риска, выявляемые уже в подростковом периоде (Строев Ю.И. и соавт., 2003).
Классические проявления включают ожирение, скрытый инсулинонезависимый сахарный диабет, гир-сутизм, аменорею с дисфункциональными, внецикловы-ми маточными кровотечениями, бесплодие, гипертен-зию. Гормональный фон, помимо гиперкортицизма, гиперинсулинемии, характеризуется повышением уровня ПРЛ, ЛГ(с выраженными пиками секреции), недостатком ФСГ (со сглаженными пиками секреции), ги- перандрогенизмом, гиперэстрогенемией — за счёт эстрона, вырабатываемого при периферической конверсии андрогенов, а не эстрадиола — продукта яичниковой ароматазной реакции).
Сложные этиология и патогенез данного синдрома представляют собой яркую иллюстрацию полигормонального контроля овариальных функций (рис. 96). Механизмы этого синдрома могут служить доказательством условности такого понятия, как «гонадотропные гормоны», в том смысле, что гормональные регуляторы, не относимые классической эндокринологией ни к половым, ни к гонадотропным, могут, тем не менее, иметь для гонад и их патологии важнейшее значение.
По современным данным (Барбери Р.Л. с соавт., 1984; Лингаппа В.Р., 1997), ключевым звеном в патогенезе этого гетерогенного синдрома в большинстве случаев служит инсулинорезистентность. Она порожда-
| гиперэстрогенемия |
 Рис. 96. Патогенез синдрома поликистозных яичников 344
Рис. 96. Патогенез синдрома поликистозных яичников 344

 ет гиперинсулинизм и ожирение. Гиперинсулинемия способствует также артериальной гипертензии. В условиях избытка инсулина печень понижает продукцию секс-связывающего глобулина и белка, связывающего ИФР-1. Возрастают биодоступность и уровень концентрации свободных андрогенов, эстрогенов и ИФР-1. Андрогены усиливают инсулинорезистентность и конверсируются на периферии в эстрогены. Гиперэст-рогенизм в момент, не соответствующий ходу нормального овариально-менструального цикла, ингибирует продукцию ФСГ перед менструацией. Пременструальный всплеск концентрации ФСГне происходит, что нарушает процесс вовлчения новой группы фолликулов в созревание.
ет гиперинсулинизм и ожирение. Гиперинсулинемия способствует также артериальной гипертензии. В условиях избытка инсулина печень понижает продукцию секс-связывающего глобулина и белка, связывающего ИФР-1. Возрастают биодоступность и уровень концентрации свободных андрогенов, эстрогенов и ИФР-1. Андрогены усиливают инсулинорезистентность и конверсируются на периферии в эстрогены. Гиперэст-рогенизм в момент, не соответствующий ходу нормального овариально-менструального цикла, ингибирует продукцию ФСГ перед менструацией. Пременструальный всплеск концентрации ФСГне происходит, что нарушает процесс вовлчения новой группы фолликулов в созревание.
Гиперэстрогенизм повышает у пациенток с данным заболеванием риск развития эндометриального рака матки и, по некоторым данным,—рака молочных желёз.
В свою очередь, повышенная активность (и продукция) ИФР-1 сильно стимулирует рост теки и стромы яичника. Белочная оболочка органа становится очень толстой, что само по себе мешает ходу овуляции. Кроме того, тека усиленно производит андрогены, чему способствует пермиссивный эффект ИФР-1 на её чувствительность к ЛГ. Сам инсулин, при очень высоких концентрациях действуя на текальные рецепторы ИФР-1, усиливает овариальный андростероидогенез. Андроге ны способствуют в яичнике атрезии фолликулов, дальнейшему росту стромы, нарушению нормальных внут-рияичниковых обратных связей, обеспечивающих в норме выбор доминанирующего фолликула.
Из-за ановуляции развивается дефицит прогесте рона. Нехватка прогестерона нарушает пульсовую секрецию гонадолиберина. Уровень ФСГ, а с ним и интенсивность ароматазной реакции, падают ещё ниже. Это окончательно тормозит развитие фолликулов.
Из-за их атрезии в гонадах формируются кисты. Уровень ЛГ стабильно высок, но лишен срединного пика, типичного для нормальных циклов. В измененном яич- нике возрастает секреция ингибина, закрепляющего аномальный характер гонадотропой регуляции. Гипер- андрогенизм вызывает гирсутизм и акне. Отмечает- ся гиперэндорфинемия.
Интересно, что весь этот комплекс изменений в гонадотропной регуляции развивается и при других причинах гиперандрогенизма {синдром Иценко-Ку- шинга, врождённая вирилизующая адренокорти- кальная гиперплазия, андростеромы). Своеобраз- ное беспиковое повышение продукции ЛГ и дефицит ФСГ также ведут у таких больных к вторичному по- ликистозу яичника. Может отмечаться и пониженная чувствительность тканей к инсулину (например, из- загиперкортицизма).
Итак, своего рода предвестником последующего развития синдрома Лесного-Штейна-Левента-ля у женщин, вполне вероятно, может служить юношеский диспитуитаризм.
Овариальная гиперандрогения может иметь и иную, опухолевую природу. Чаще всего опухоли из клеток теки и гранулёзы вырабатывают эстрогены и прогестины и не дают синдрома вирилизации. Вирилизующие опухоли яичников бывают редко (0,1% от всех неопластических поражений этого органа). Считается, что большую роль в их возникновении играют остатки мужской эмбриональной гонады, сохранившиеся в яичниках при скрытом мозаицизме по половым хромосомам. Андроб-ластомы секретируют эстрогены и андрогены и являются наиболее частыми среди опухолей этой группы. Реже встречаются дизгерминомы, продуцирующие вдобавок к андрогенам ещё и хорионический гонадот-ропин. Гиперандрогенизм вызывает у носительниц опухолей аменорею, мужское лобное облысение, гирсутизм, дефеминизацию.
Следует помнить и о возможности редких карцино-идных опухолей из диффузных эндокринных клеток яичников, вырабатывающих серотонин и тироидные гормоны («овариальная струма»).
Иногда, при нарушении фолликулогенеза, происходит нормальный переход к лютеальной фазе цикла, формируется желтое тело, и наступает продукция прогесте рона и переход эндометрия к секреторному состоянию. Однако яйцеклетка не выходит из фолликула. Все пре-зумптивные признаки овуляции имеются, менструация наступает, но женщины бесплодны, а менструальное отделяемое не содержит яйцеклетки. Этиология и патогенез этого редкого нарушения, именуемого «синдром лютеинизации интактного фолликула», неизвестны. Возможно, речь идет об устойчивости механизмов секреции фолликулярной жидкости к действию гонадотро-пинов или о дефекте внутрифолликулярной паракринной регуляции.
Большинство нарушений овариально-менструаль-ного цикла касается фолликулярной фазы и овуляции. Однако известны и изолированные нарушения его лютеальной фазы.
Их суть заключается в том, что секреция прогес-тинов либо укорочена по времени (недостаточность лютеальной фазы), либо недостаточна по интенсивности (неадекватность лютеальной фазы). Изредка речь идёт о внежелезистной рецепторной нечувствительности эндометрия к прогестинам, вызванной генетическим дефектом рецепторов прогестерона.
Важнейшие нозологические формы, обусловленные нарушениями эндокринных функций половой системы подростков, подлежат подробному отдельному клиническому рассмотрению ниже.
345
ЗАДЕРЖКА ПОЛОВОГО РАЗВИТИЯ
Определение. Задержка полового развития — запаздывание полового созревания с выраженным недоразвитием вторичных половых признаков, в сравнении с большинством подростков в популяции, в возрасте, который превышает средний на 2 стандартных отклонения.
Синонимы: задержка полового созревания, поздний пубертат, pubertas tarda, ретардированный пубертат, иррегулярный пубертат, непоследовательный пубертат, отсроченный пубертат, конституциональная задержка развития, задержка полового развития (по Л.М. Ско- родку и О.Н. Савченко, 1984).
Распространение. Задержка полового развития — самый частый вариант нарушения полового созревания. Частота патологии - от 0,4 до 2,5 % (при этом необходимо учитывать отсутствие единого представления о возрастных границах пубертатного периода). Вообще у 40 % детей с различными эндокринными заболеваниями наблюдаются нарушения полового развития. По Ю. А. Гуркину (1993), задержка полового развития встречается у 2,2% девочек с гинекологической патологией и составляет 1/3 в структуре гинекологических заболеваний девушек-подростков.
Этиология и патогенез. Задержка полового развития — это затянувшееся начало пубертатного периода в связи с замедлением общего физического созревания. Почти всегда наблюдаются замедленное течение полового созревания и более позднее завершение роста хронологически.
Как уже отмечалось выше, половое созревание имеет достаточно широкие возрастные границы. Так, у девочек оно считается физиологическим в возрасте от 9 до 16 лет, а у мальчиков — от 11 до 18 лет (Жу-
ковский М.А., 1982, 1989; Медведев В.П., Куликов A . M ., 1999).
Хронологическая последовательность появления вторичных половых признаков у девочек следующая (см. Приложение 5): 9-11 лет — нагрубание молочных желез, рост костей таза; 10-11 лет — оволосение лобка и подмышек; 11-12 лет—пубертатный скачок роста; 12-13 лет— первая менструация; 14-16 лет— становление двухфазного менструального цикла.
У мальчиков эта хронологическая последовательность несколько отличается от девочек. Так, увеличение объема яичек наблюдается в 11-12 лет, увеличение полового члена—в 12-13 лет (табл. 17), оволосение лобка—в 12-13 лет, регулярные поллюции — в 13-14 лет, аксиллярное оволосение, изменение архитектоники тела, снижение тембра голоса и пубертатный скачок роста — в 14-15 лет, зрелый сперматогенез — 16-18 лет. Половое развитие мальчиков с синдромом задержки полового развития происходит в более позние сроки, у большинства больных физиологический уровень развития достигается к возрасту 14-16 лет, а у 1/4 — к возрасту 17-19 лет.
У 90 % мальчиков пубертат начинается в 11-12 лет и только у 3 % — раньше 11 лет. До 11-12 лет нельзя говорить о задержке полового развития.
Увеличение грудного индекса на 5 % и более по отношению к норме позволяет заподозрить нарушение половой дифференцировки (Демченко А.Н., Черка сов И.А., 1978).
Задержка полового развития у девочек возникает реже, чем у мальчиков, но связана она, как правило, не с конституциональными особенностями, характерными для пубертатного возраста, а с более серьезными причинами. У девочек с андроидным типом телос-
Таблица 17
Дата: 2019-02-02, просмотров: 768.