Устойчивость и коагуляция дисперсных систем
Под устойчивостью дисперсных систем понимают постоянство во времени их свойств, в первую очередь постоянство дисперсности и посто- янство равномерного распределения частиц дисперсной фазы в среде.
Различают два вида устойчивости дисперсных систем: седимента- ционную (кинетическую) и агрегативную. Седиментационная устойчи- вость — это способность частиц дисперсной фазы удерживаться во взве- шенном состоянии. Эта способность зависит от степени дисперсности час- тиц, вязкости дисперсионной среды, разности плотностей дисперсной фа- зы и дисперсионной среды, температуры. Кинетическая (седиментацион- ная) устойчивость золя тем выше, чем меньше размер частиц, чем ближе значения плотностей фазы и среды, чем выше вязкость дисперсионной среды, причем степень дисперсности частиц оказывает наибольшее влия- ние. Поэтому высокодисперсные системы, в которых скорость осаждения взвешенных частиц под влиянием силы тяжести настолько мала, что ею можно пренебречь, принято называть седиментационно (кинетически) ус- тойчивыми.
Агрегативная устойчивость характеризует способность частиц дис- персной фазы оказывать сопротивление их слипанию и тем удерживать определенную степень дисперсности. Основными факторами агрегативной устойчивости дисперсных систем являются наличие у частиц ионной обо- лочки, т. е. двойного электрического слоя, диффузного слоя противоинов, а так же их сольватной (гидратной) оболочки. Утрата агрегативной устой- чивости приводит к коагуляции.
Коагуляция — это процесс объединения коллоидных частиц и обра- зования более крупных агрегатов, ведущий к выпадению их в осадок под действием сил тяжести и последующему разделению фаз. Коагуляцию мо- гут вызвать различные факторы: изменение температуры, механическое воздействие, действие света, облучение, увеличение концентрации золя, добавление электролитов.
Изменение температуры по-разному влияет на кинетическую и агре- гативную устойчивость, а следовательно, и на коагуляцию. Первая при увеличении температуры возрастает в результате усиления броуновского движения. Вторая при этом снижается вследствие уменьшения толщины диффузного слоя. Причем увеличивается и вероятность столкновения (со- ответственно — слипания) частиц, что способствует коагуляции.
Наиболее изучена и имеет большое практическое значение коагуля- ция электролитами. Электролиты, с одной стороны, необходимы для ста- билизации золя, но с другой — их избыток в растворе вызывает коагуля- цию. Поэтому коллоидные растворы, полученные химическими методами, необходимо очищать от примесей электролитов.
Коагуляция коллоидных растворов Чтобы начался процесс коагуляции необходимо наличие некоторой минимальной концентрации электролита в золе. То наименьшее количест- во электролита, которое вызывает коагуляцию 1 л золя, называется поро- гом коагуляции. Его определяют по помутнению и изменению окраски коллоидного раствора, и рассчитывают по формуле:
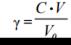
где γ — порог коагуляции, моль/л или ммоль/л; С — концентрация элек- тролита, моль/л; V — объем раствора электролита, л; V0 — объем золя, л.
Величина, обратная порогу коагуляции (1/γ), является мерой коагу- лирующей способности электролита: чем меньше порог коагуляции, тем выше коагулирующая способность электролита.
Коагуляцию вызывает тот ион, заряд которого по знаку противопо- ложен заряду поверхности коллоидных частиц. Коагуляцию положительно заряженных золей вызывают анионы добавляемого электролита, отрица- тельно заряженных золей — катионы электролита. Коагулирующее дейст- вие электролитов определяется правилом Шульце-Гарди: « Коагулирую- щее действие оказывает противоион и коагулирующая способность воз- растает пропорционально некоторой высокой степени его заряда». Если коагуляцию вызывают ионы одного знака, но разной величины заряда, то их пороги коагуляции соотносятся как величины, обратные их зарядам в шестой степени:

низм какого-либо электролита надо учитывать не только его концентра- цию, но и заряд ионов. К примеру, физиологический раствор хлорида на- трия нельзя заменить изотоническим раствором хлорида магния, посколь- ку данная соль содержит двухзарядный ион магния, оказывающий более высокое коагулирующие действие.
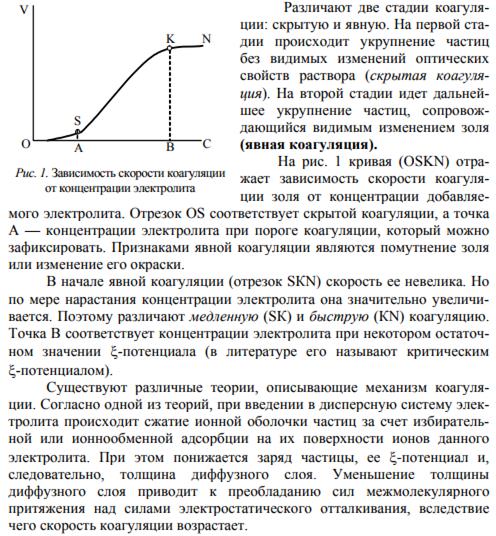
Кинетика и механизм коагуляции электролитами. Коагуляция любого коллоидного раствора не происходит мгновенно — она протекает во времени. О процессе коагуляции можно судить по изменению оптиче- ских свойств раствора.

Коллоидная защита Устойчивость коллоидных растворов можно повысить, используя не только малые количества электролита, но и добавляя к нему высокомоле- кулярные соединения (ВМС). Повышение устойчивости коллоидного рас- твора при добавлении к нему ВМС назвали коллоидной защитой. Это яв- ление выражается в повышении порога коагуляции. Если, например, к зо- лю гидроксида железа (III) добавить небольшое количество раствора же- латина, то для коагуляции такого золя требуется значительно больше электролита, чем для коагуляции незащищенного золя. Механизм защитного действия сводится к образованию вокруг кол- лоидной частицы адсорбционной оболочки из молекул ВМС, которые соз-дают структурно-механический барьер, препятствующий слипанию час- тиц. При этом повышается не только агрегативная, но и седиментационная устойчивость золя вследствие повышения вязкости дисперсионной среды. Коллоидные частицы, защищенные слоем белка, устойчивы и по своим свойствам не отличаются от макромолекул белка. Примером таких дисперсных систем могут служить медицинские бактерицидные препара- ты протаргол и колларгол, представляющие собой золи металлического серебра, защищенные белками. Эти препараты приобретают устойчивость, сохраняющуюся даже при полном удалении дисперсионной среды. Следу- ет отметить, что бактерицидное действие, свойственное тяжелым метал- лам, не экранизируется белковой оболочкой. Такие биологические жидкости, как кровь, плазма, лимфа, спинно- мозговая жидкость представляют собой системы, в которых некоторые входящие в них вещества, находятся в коллоидном состоянии, например, фосфаты, ураты, оксалаты, карбонаты, холестерин, липиды. В крови кри- сталлы малорастворимых соединений не выпадают в осадок потому, что защищены от коагуляции белками. Согласно одной из теорий, с возрастом защитная функция белков снижается, и возникают различные заболевания, например атеросклероз, кальциноз, подагра, образование камней в почках, печени и т. д.
Дата: 2018-12-28, просмотров: 548.