

Связь величин рН и рОН. Определение и вычисление рН в растворах сильных и слабых кислот, сильных и слабых оснований.
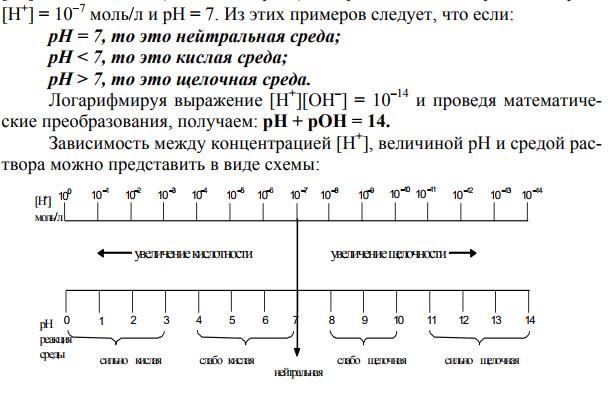
Среда водных растворов –определяется соотношением концентраций двух ионов H+ и OH-, которые всегда присутствуют в воде и в водном растворе любого вещества.
1) нейтральная среда :для чистой воды концентрация ионов водорода равна концентрации гидроксид-ионов, так как из одного моля воды образуется один моль ионов Н+ и один моль ионов ОН-. Следовательно, концентрация этих ионов при 22°С [Н+] = [ОН-] = 10-7моль/л.
2) кислая среда:если к чистой воде добавить кислоты, то [Н+]>[ОН-] и [Н+]>10-7 моль/л.
3) щелочная среда:если к воде добавить щелочи, то [Н+] < [ОН-] и [Н+] <10-7 моль/л.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рН = –lg[H+] или [Н+] = 10-рН,
С помощью рН реакция растворов характеризуется так:
нейтральная рН=7, кислая рН<7, щелочная рН>7.
Аналогично концентрацию ОН--ионов можно выразить через показатель гидроксид-ионов рОН: гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком:
рОН = –lg[OH-] или [ОН-]=10-рОН,
рН + рОН=14; рОН=14–рН.
Сильные кислоты и основания (табл.2.1) в растворах диссоциируют пол-
ностью, поэтому концентрация ионов водорода и ионов гидроксила равна
общей концентрации сильного электролита.
Для сильных оснований: [OH-] = См; для сильных кислот: [H+] = См.
Таблица 2.1
Сильные электролиты
| Класс | Формулы электролитов |
| Кислота | HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 |
| Основание | LiOH , KOH, RbOH, CsOH, NaOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
| Соль | Растворимые соли |
Слабым электролитом принято считать химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциируют на ионы. Степень диссоциации слабых электролитов для децимолярных растворов (0,1М) меньше 3%. Примеры слабых электролитов: все органические кислоты, некоторые неорганические кислоты (например, H2S, HCN), большинство гидроксидов (например, Zn(OH)2, Cu(OH)2).
Для растворов слабых кислот концентрация ионов водорода [H+] в растворе рассчитывается по формуле:
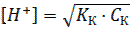
где: Кк – константа диссоциации слабой кислоты; Ск – концентрация кислоты, моль/дм3.
Для растворов слабых оснований концентрация гидроксильных ионов рассчитывается по формуле:
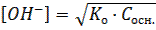
где: Ко – константа диссоциации слабого основания; Сосн. – концентрация основания, моль/дм3.
Таблица 2.2
Константы диссоциации слабых кислот и оснований при 25 оС
| Формула | Константа диссоциации, Кд |
| СH3COOH | 1,86 • 10–5 |
| HCN | 7,2 • 10-10 |
| HOCl | 5,0 • 10-8 |
| HBO2 | 7,5 • 10-10 |
| HOBr | 2,5 • 10-9 |
| HF | 6,2 • 10-4 |
| HNO2 | 5,1 • 10-4 |
| HIO | 2,3 • 10-11 |
| HOCN | 2,7 • 10-4 |
| NH4OH | 1,79 • 10-5 |
| AgOH | 5,0 • 10-3 |
Дата: 2018-12-28, просмотров: 1094.