Влияние концентрации на скорость химической реакции выражается законом действующих масс:«При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам». Закон справедлив только для элементарных реакций.
В общем виде для реакции аА+ bB = cC аналитическое выражение закона действующих масс будет иметь вид= [A]a[B]b, где a и b– порядки реакции по каждому реагенту, соответствующие стехиометрическим коэффициентам. Для конкретной реакции I2(г) + H2(г)⇄ 2HI(г) уравнение скорости прямой реакции будет=[I2][H2], а обратной реакции=[HI]2. В этих уравнениях и– константы скорости прямой и обратной реакций. Константа скорости – это скорость реакции при концентрации реагирующих веществ, равных единице. Таким образом, константу скорости можно рассматривать как удельную скорость. В случае гетерогенных процессов, когда реакция протекает на границе раздела фаз, в уравнение скорости входят концентрации только газообразных или растворенных веществ. Концентрация твердого вещества в процессе реакции остается постоянной и в уравнение скорости реакции не включается.
законе действующих масс, который был установлен в 1867 г. двуми норвежскими химиками К. Гульдбергом и П. Вааге. Современная формулировка закона действующих масс такова:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции aA + bB → mM + nN математическое выражение закона действующих масс имеет вид:
v = k · CAa · CBb,
где v - скорость реакции; k - коэффициент пропорциональности, называемый константой скорости химической реакции (при CA = CB = 1 моль/л k численно равна v); CA и CB - концентрации реагентов A и B; a и b - стехиометрические коэффициенты в уравнении реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах.
Часто уравнение реакции не отражает ее механизма. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно ко всей реакции в целом.
19.Кинетические уравнения реакций 1 и 2 порядков. Способы определения порядка реакций.
| Порядок реакции | Кинетическое уравнение | Единица измерения константы скорости | Зависимость концентрации от времени | Период полураспада |
| 1 | 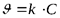
| с-1 | 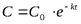 или или 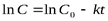
| 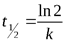
|
| 2 | 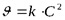
| л×моль-1×с-1 | 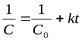
| 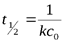
|
| 0 | 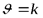
| моль×л-1×с-1 | 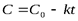
| 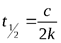
|
Метод подстановки:
Заключается в подстановке экспериментальных данных ( t, t1, t2,t3; С0, С1, С2, С3) последовательно в уравнения кинетики реакции 0,1,2 и 3 порядков и определении, какое из них приводит к постоянному значению k. Порядок будет такой, какая формула дает лучшее постоянство k для различного времени.
Графический метод определения порядка реакции:
Заключается в построении графика выражающего зависимость различных функций С от t. Чтобы определить порядок необходимо получить прямую линию функции. В случае реакции 1-го порядка линейную зависимость от t дает lgC. В случае реакции 2-го порядка – 1/С от t и для реакции 3-го порядка – 1/С2 от t. Для реакции нулевого порядка С от t дает параллельные прямые оси абсцисс.
Другой способ графического определения порядка реакции:
Порядок реакции определяется по зависимости скорости реакции w от текущей концентрации реагирующего вещества L:
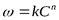



lgw
,
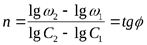

Аналитические методы определения порядка реакции:
а) Порядок реакции определяется по начальной скорости реакции (метод Вант-Гоффа):
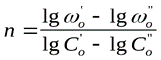
где 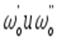 - начальные скорости реакции при начальных концентрациях
- начальные скорости реакции при начальных концентрациях 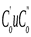 .
.
б) Порядок реакции определяется по времени ta’ и ta’’ одинаковой степени превращения a при начальных концентрациях Co’ и Co’’:
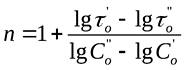
Дата: 2018-12-28, просмотров: 691.