Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида. Так, перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
ОСМОС
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию. Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением. Осмотическое давление и концентрацию раствора позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
π = C·R·T,
где C — молярная концентрация раствора, моль/м3,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
π·V = m·R·T /M
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
π` = i·C·R·T ,
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими. Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
38. И 39.Осмос, осмотическое давление. Уравнение Вант-Гоффа. Осмотическое давление крови человека при т=37 градусов цельсия, выраженное в кПа и атмосферах. Роль осмоса и осмотического давления в биологических системах. (Гипо-, Гипер-, изо-)тонические растворы. Плазмолиз. Гемолиз.
Коллигативные свойства разбавленных растворов
Все растворы имеют определенные физические свойства, которые зависят от природы растворенного вещества, растворителя, концентрации (плотность, вязкость, электрическая проводимость). Но есть физические свойства растворов, которые зависят от числа частиц растворенного веще- ства и природы растворителя, но не зависят от природы растворенного вещества. Эти свойства называются коллигативными. К ним относятся:
осмотическое давление, понижение давления насыщенного пара рас- творителя над раствором, понижение температуры замерзания рас- творов по сравнению с чистым растворителем, повышение темпера- туры кипения растворов по сравнению с чистым растворителем.
Осмос и осмотическое давление. Осмос — это преимущественно одностороннее проникновение молекул растворителя через полупрони- цаемую мембрану из растворителя в раствор, или из раствора с меньшей концентрацией в раствор с большей концентрацией. Необходимое условие возникновения осмоса — это наличие растворителя и раствора, или двух растворов различной концентрации, разделенных полупроницаемой мем- браной. Полупроницаемая мембрана — это мембрана, способная пропус- кать через поры строго определенные частицы раствора. Все мембраны клеток являются полупроницаемыми.
Осмос — это самопроизвольный процесс. С точки зрения термоди- намики движущая сила осмоса — стремление системы к выравниванию концентраций. При этом энтропия системы увеличивается (ΔS > 0), по- скольку она переходит в менее упорядоченное состояние, а энергия Гиб- бса системы соответственно уменьшается (ΔG

Кровь, лимфа, тканевые жидкости — это водные растворы низкомо- лекулярных соединений — NaCl, KCl, CaCl2; высокомолекулярных соеди- нений — белков, полисахаридов, нуклеиновых кислот и форменных эле- ментов. В сумме они определяют осмотическое давление биологических жидкостей. Каждый компонент биологической жидкости вносит свой вклад в поддержание ее осмотического давления. Основной вклад в под- держание осмотического давления плазмы крови вносят ионы натрия Na+ и ассоциированные с ними анионы хлора Cl– в виде хлорида натрия. Ос- тальной вклад вносят ионы калия К+ , ионы кальция Са2+, ионы магния Mg2+ с ассоциированными анионами, мочевина, глюкоза, белок (табл.). 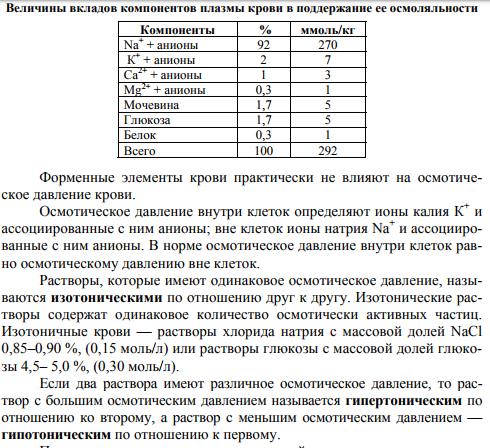
При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют. Если клетка попадает в гипер- тонический раствор (раствор с повышенной концентрацией солей и дру- гих растворимых веществ), то это приводит к осмосу, при котором вода уходит из клетки в раствор. Наблюдается общее сжимание, сморщивание клетки. Это явление называется плазмолизом. Если клетка попадает в ги- потонический раствор (раствор с пониженной концентрацией веществ), то это тоже приводит к осмосу, при котором вода из менее концентриро- ванного раствора идет внутрь клетки. Клетка набухает и разрывается. Это явление в случае разрушения эритроцитов называется гемолизом. Таким образом, распределение воды между внутриклеточной и внеклеточной жидкостями зависит от соотношения осмотических давлений внутри- и внеклеточной жидкостей.
Распределение жидкости между сосудистым руслом и межкле- точным пространством. В отличие от клеточных мембран стенки капил- ляров проницаемы для ионов Na+ и ассоциированных с ними ионов и низкомолекулярных соединений. Поэтому они не оказывают осмотического эффекта в кровеносных капиллярах. В плазме крови содержится очень много белков, стенки капилляров не проницаемы для них. Наоборот, вне кровеносных сосудов (во внеклеточной жидкости) концентрация белков мала. Большая концентрация белков в плазме крови приводит к потоку жидкости из тканей (внеклеточной жидкости) в плазму крови (сосудистое русло). В норме этот поток жидкости уравновешивается противоположным потоком жидкости, вызванным гидростатическим давлением белков плаз- мы. Осмотическое давление, которое проявляется на стенках капилляров и которое обусловлено белками, называется онкотическим давлением (кол- лоидно-осмотическим). Оно невелико и в норме равно около 0,04 атм. Таким образом, распределение жидкости между сосудистым рус- лом и межклеточным пространством зависит от соотношения меж- ду гидростатическим и онкотическим давлением плазмы крови, кото- рое определяется концентрацией белков.
Коллигативные свойства разбавленных растворов электролитов При диссоциации электролитов в растворе появляется больше час- тиц за счет образующихся ионов. С увеличением общего числа частиц увеличиваются и коллигативные свойства растворов. Для использования полученных формул для расчета коллигативных свойств разбавленных растворов электролитов Вант-Гофф ввел поправочный коэффициент или коэффициент Вант-Гоффа i. Согласно Вант-Гоффу изотонический коэф- фициент, равен:

Дата: 2018-12-28, просмотров: 689.