В гомогенных
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. D Н = Т × D S. В этом случае соблюдается уравнение D G = 0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени и в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями).
Используя закон действующих масс, можно рассчитать равновесие концентрации или парциальные давления реагирующих веществ.
Закон действующих масс формулируется в следующем виде: отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению исходных веществ в степенях, равных стехиометрическим коэффициентам при Т = const, является величиной постоянной. Используя этот закон, можно рассчитать равновесие концентрации или парциальные давления реагирующих веществ.
При внешнем воздействии на систему происходит смещение химического равновесия, т.е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Характер смещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле Шателье (который следует из закона действующих масс): если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
В гетерогенных системах
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций становятся одинаковыми, то наступает химическое равновесие в гетерогенной системе, называемое гетерогенным химическим равновесием. Условием этого равновесия является равенство энергии Гиббса реакции нулю, т.е. D G = 0.
Как в случае гомогенной химической реакции, константа гетерогенного химического равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам соответственно продуктов реакций и исходных веществ.
Таким образом, в уравнения констант гетерогенного химического равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях. В них также не входит площадь поверхности раздела фаз.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры в случае эндотермической прямой реакции (D Н < 0) и уменьшается с увеличением температуры в случае экзотермической прямой реакции (D Н < 0). Константа гетерогенного химического равновесия может быть рассчитана по уравнению
Кр = ехр[- D G ° /(RT)]. (3.11)
Расчеты равновесных концентраций и давлений реагирующих веществ для гетерогенных и гомогенных химических реакций аналогичны.
Катализ. Виды. Примеры гомогенного и гетерогенного катализа.
Катализ и катализаторы Катализ — изменение скорости реакции под действием веществ, которые сами не изменяются ни качественно, ни количественно в конце реакции. Эти вещества называются катализаторами. Катализатор не влияет на константу химического равновесия. Он только ускоряет или замедляет достижение химического равновесия, но одинаково влияет на константу скорости прямой реакции и на константу скорости обратной реакции. Катализатор ведет реакцию по пути с меньшей или с большей энер- гией активации ЕА. Положительный катализатор увеличивает скорость реакции, т. к. уменьшается ЕА; отрицательный катализатор уменьшает скорость реакции и увеличивает ЕА. Катализатор практически не влияет на общее число соударений, но влияет на энергию активации ЕА.
Катализатор может способствовать достижению ориентации, необ- ходимой для взаимодействия молекул. Различают гомогенный и гетерогенный катализ. Катализаторы, ко- торые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объ- яснить на основе теории промежуточных соединений. Согласно этой тео- рии, катализатор образует с реагентами промежуточные соединения, ко- торые уменьшают энергию активации реакции. Например, реакция 2SO2 + О2 → 2SО3 в присутствии оксида азота (II) NО может происходить по схеме:
2NO + О2 → 2NO2 (промежуточное соединение)
NO2 + SO2 → SO3 + NO
Как видно из системы, в суммарное уравнение реакции катализатор NO не входит, т. е. в результате реакции он не изменяется.
В случае гетерогенного катализа катализатор и реагенты находятся в разных фазах и имеют границу раздела. На поверхности твердого ката- лизатора (а точнее на поверхности раздела фаз) реагируют газообразные или жидкие вещества. Механизм каталитических гетерогенных реакций очень сложен и за- висит от природы реакции. Вначале на активных центрах поверхности ге- терогенного катализатора происходит процесс хемосорбции молекул ис- ходных веществ, в результате чего происходит:
a) локальное увеличение концентрации молекул исходных веществ на активных центрах;
б) ослаб- ление химических связей в молекулах исходных веществ, что заставляет их распадаться до атомов, которые реагируют друг с другом и образуют молекулу нового вещества, которое покидает поверхность катализатора.
К каталитическим гетерогенным реакциям относятся известные реакции по- лучения аммиака и оксида серы (IV).
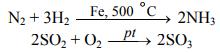
Биологические катализаторы — ферменты Химические процессы в живых организмах осуществляются при помощи биологических катализаторов — ферментов. Все известные в на- стоящее время ферменты являются белками, многие из которых содержат ионы металлов.
Особенности действия ферментов.
1.Высокая каталитическая активность. Ферменты резко снижают ЕА биохимических реакций.
2.Высокая специфичность и направленность действия. Напри- мер, амилаза, которая содержится в слюне, легко и быстро расщепляет крахмал, но не расщепляет сахарозу. Фермент уреаза расщепляет только мочевину
3. Мягкие условия действия ферментов. Каталитические действие ферментов происходит при температуре 37–40 ºС, невысоком давлении и определенном значении рН. 4. Отсутствие побочных эффектов в биохимических реакциях с участием ферментов.

Дата: 2018-12-28, просмотров: 454.