Коллигативные свойства разбавленных растворов Все растворы имеют определенные физические свойства, которые зависят от природы растворенного вещества, растворителя, концентрации (плотность, вязкость, электрическая проводимость). Но есть физические свойства растворов, которые зависят от числа частиц растворенного веще- ства и природы растворителя, но не зависят от природы растворенного вещества. Эти свойства называются коллигативными. К ним относятся: осмотическое давление, понижение давления насыщенного пара рас- творителя над раствором, понижение температуры замерзания рас- творов по сравнению с чистым растворителем, повышение темпера- туры кипения растворов по сравнению с чистым растворителем.


35.Повышение температуры кипения растворов, зависимость их от концентрации. Эбуллиоскопический метод определения молярных масс веществ. Физический смысл эбуллиоскопической постоянной, изотонический коэффициент.




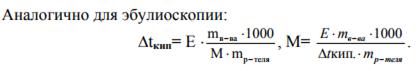
Уравнения справедливы для разбавленных растворов неэлектролитов

Понижение температуры кипения растворов, зависимость от концентрации.Физический смысл криоскопической постоянной. Определение молекулярных масс методом криоскопии.
См. п.33
И 38.Коллигативные свойства растворов неэлектролитов и электролитов: повышение температуры кипения, понижение температуры замерзания, осмотическое давление, изотонический коэффициент.
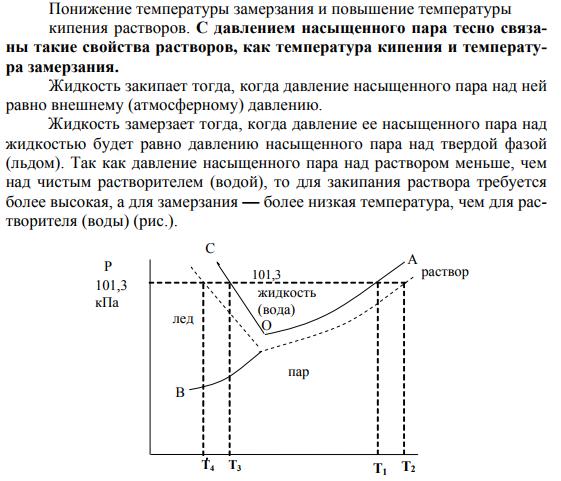
Понижение давление паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу. Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль
p = p0 · nр-ля/(nв-ва + nр-ля), где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
(p0 – p)/p0 = χв-ва
(p0 – p)/p0 = nв-ва/(nв-ва + nр-ля)
При этом принимаем, что χв-ва + χр-ль = 1
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
p0 – p = Δр
Δp = i · p0 · χв-ва, где
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
i = 1+α(n—1), где
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Дата: 2018-12-28, просмотров: 1172.