Химическая кинетика — раздел физической химии, представляю- щий собой учение о скоростях и механизмах протекания химических ре- акций.
Основные понятия химической кинетики Химическая реакция. Химической реакцией можно считать любое изменение вещества, при котором образуются или разрываются химиче- ские связи между атомами. Различают простые и сложные реакции. Про- стые реакции — это реакции, протекающие в одну стадию и их стехио- метрическое уравнение правильно отражает реальный ход реакции: H2 + I2 → 2HI. Сложные реакции протекают через несколько стадий. Стехиометри- ческое уравнение не отражает реального хода процесса и является выра- жением суммарного результата нескольких стадий. Например, реакция взаимодействия между пероксидом водорода и йодоводородом может протекать в две стадии: Первая стадия: H2O2 + HI →НIО + H2O. Вторая стадия: HIO + HI →I2 + H2O. Суммарное уравнение: H2O2 + 2HI →I2 + 2H2O. Абсолютное большинство химических реакций являются сложными. Совокупность стадий, из которых складывается химическая реакция, но- сит название механизма химической реакции. Каждая отдельная стадия, через которую идет реакция, называется элементарным актом реакции. Исходные, конечные и промежуточные вещества. Вещества, кото- рые образуются в процессе химического превращения и не изменяются при дальнейшем протекании реакции, называются конечными веществами или продуктами реакции. Вещества, которые образуются на первой стадии химической реак- ции, затем превращаются в другие вещества на следующей стадии этой же реакции, называются промежуточными веществами. Например, в выше рассмотренной реакции кислота HIO является промежуточным веществом. Гомогенные и гетерогенные реакции. Химическая реакция, проте- кающая в пределах одной фазы, называется гомогенной химической реак- цией. Химическая реакция, протекающая на границе раздела фаз, называ- ется гетерогенной химической реакцией. Примером гомогенных реакций может служить любая реакция в растворе. Примером гетерогенной реак- ции может служить любая из реакций, идущих на поверхности твердого катализатора (гетерогенная каталитическая реакция)
Скорость химической реакции — это изменение концентрации любого из участвующих в реакции веществ в единицу времени. Средняя скорость реакции (V) за промежуток времени t2–t1 равна:
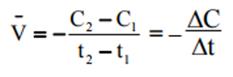


Крутизна кинетической кривой в каждый момент времени характеризует истинную скорость реакции в этот момент времени, так как наклон касательной в точке численно равен скорости:
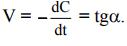
Дата: 2018-12-28, просмотров: 962.