Диссоциация комплексных соединений в растворах. Внутренняя и внешняя сферы комплексного соединения сильно раз- личаются по устойчивости. Частицы, находящиеся во внешней сфере, свя- заны с комплексным ионом электростатическими силами и легко распа- даются в водном растворе. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и распадаются в не- большой степени. Поэтому диссоциация комплексных соединений проте- 63 кает в две стадии. На первой стадии диссоциация идет по типу диссоциа- ции сильных электролитов:
[Ag(NH3)2Cl] → [Ag(NH3)2] + + Cl– .
На второй стадии диссоциация идет по типу слабых электролитов: ступенчато, обратимо, частично: [Ag(NH3)2] + ⇆ Ag+ + 2NH3. Диссоциация ионов[Ag(NH3)2] + , как и диссоциация всякого слабого электролита, выра- жается константой химического равновесия:
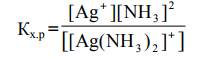
Константа химического равновесия Кх.р. в случае диссоциации ком- плексного иона называется константой нестойкости Кн. Она характеризует устойчивость и прочность внутренней сферы комплексного соединения. Чем меньше Кн., тем меньше концентрация продуктов распада комплекса и тем более прочный и устойчивый комплекс. Для характеристики устойчивости комплексных соединений можно пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости Ку.:
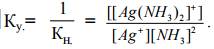 Чем больше Ку., тем более устойчивее и прочнее комплекс.
Чем больше Ку., тем более устойчивее и прочнее комплекс.
14. Методы получения комплексных соединений.
Аквакомплексы получают взаимодействием водорастворимых солей, содержащих комплексообразователь, с водой
MgSO4 + 6H2O  [Mg(H2O)6]SO4
[Mg(H2O)6]SO4
Аммиакаты получают взаимодействием гидроксида аммония с водорастворимыми солями, содержащими комплексообразователь. Реакция имеет ступенчатый характер: первоначально образуется нерастворимый гидроксид металла комплексообразователя, который под действием избытка гидроксида аммония переходит в водорастворимое комплексное основание. Суммирование левых и правых частей уравнений этих реакций приводит к уравнению брутто-реакций:
CuSO4 + 2NH4OH  Cu(OH)2 ¯+ (NH4)2SO4
Cu(OH)2 ¯+ (NH4)2SO4
Cu(OH)2 + 4NH4OH  [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 4H2O
___________________________________________
CuSO4 + 6NH4OH  [Cu(NH3)4](OH)2 + (NH4)2SO4 + 4H2O
[Cu(NH3)4](OH)2 + (NH4)2SO4 + 4H2O
Чтобы получить во внешней сфере необходимый анион, на полученное комплексное основание действуют эквивалентным количеством соли, содержащей этот анион и катион, дающий с гидроксид–анионом нерастворимую форму
[Cu(NH3)4](OH)2 + CuCl2  [Cu(NH3)4]Cl2 + Cu(OH)2
[Cu(NH3)4]Cl2 + Cu(OH)2 
Гидроксокомплексы получают воздействием на водорастворимую соль комплексообразователя избытком щелочного агента. Эта реакция также имеет ступенчатый характер:
AlBr3 + 3NaOH 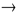 Al(OH)3
Al(OH)3 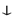 + 3NaBr
+ 3NaBr
Al(OH)3 + 3NaOH 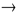 Na3[Al(OH)6]
Na3[Al(OH)6]
________________________________
AlBr3 + 6 NaOH 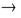 Na3[Al(OH)6] + 3NaBr
Na3[Al(OH)6] + 3NaBr
Условием образования гидрокомплексов является амфотерный характер металла–комплексообразователя.
Ацидокомплексы получают взаимодействием водорастворимой соли комплексообразователя с избытком водорастворимого соединения, содержащего лиганд. Первоначально образуется обычная соль комплексообразователя с лигандом, которая под действием избытка лиганд-содержащего агента переходит в комплексное соединение:
Hg(NO3)2 + 2KI 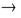 HgI2
HgI2 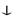 + 2KNO3
+ 2KNO3
HgI2 + 2KI 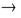 K2[HgI4]
K2[HgI4]
 Hg(NO3)2 + 4KI
Hg(NO3)2 + 4KI 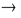 K2[HgI4] + 2KNO3
K2[HgI4] + 2KNO3
НОМЕНКЛАТУРА:
1. К названиям лигандов-анионов добавляют суффикс -о- (хлоро-, сульфато-, циано-). Исключением являются названия тех лигандов, которые традиционно рассматриваются как радикалы (метил-, фенил-). Названия нейтральных лигандов суффикса не имеют. Изменяются только названия аммиака (амин) и воды (аква).
2. Число координированных групп каждого рода указывают греческими приставками ди-, три-, тетра-, пента-, гекса, и т.д. Приставку моно- обычно не употребляют. Если внутрисферные лиганды сложные и, особенно, если они уже включают в своё название приставки ди-, три-, то для обозначения их количества употребляют приставки бис-, трис-, тетракис-. Название сложного лиганда обычно заключается в круглые скобки.
3. Чтобы составить название комплексной частицы, сначала перечисляют лиганды-анионы, лиганды-молекулы (перечисление производят в алфавитном порядке), а затем указывают центральный атом. Формулу комплекса записывают в обратном порядке. Комплексную частицу принято выделять квадратными скобками.
4. В русской номенклатуре сначала называют анион, а затем катион. Название анионного комплекса имеет окончание -ат и производится от латинского названия центрального атома. Название катионного комплекса производится от русского названия центрального атома (родительный падеж). При названии центрального (незаряженного молекулярного) комплекса также используется русское название центрального атома (именительный падеж). Название комплексного иона и нейтрального комплекса пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, заключённой в круглые скобки.
Химические свойства комплексных соединений. Примеры комплексных соединений в медицине.
Механизмы реакций координационных соединений. Реакционная способность координированных лигандов комплексных соединений. Окислительно-восстановительныесвойства комплексных соединений. Типыокислительно-восстановительныхпревращений комплексных соединений. Влияние процессов комплексообразования на величину электродных потенциалов в растворах электролитов.Применение комплексных соединений. Аналитическая и органическая химия. Катализ. Красители. Пигменты.
Дата: 2018-12-28, просмотров: 610.