Комплексные соединения — это такие соединения, в узлах кри- сталлической решетки которых находятся сложные ионы или нейтральные комплексы, способные существовать как в растворах, так и в расплавах.
Реакции, в результате которых образуются комплексные соединения, но- сят название реакций комплексообразования. Первая теория строения комплексных соединений была разработана в 1893 г. Альфредом Вернером. В структуре комплексных соединений различают внутреннюю ко- ординационную и внешнюю сферы. Внутренняя координационная сфе- ра (комплекс) представляет собой совокупность центрального атома (комплексообразователя) и лигандов (молекул или ионов). Заряд внутрен- ней сферы равен алгебраической сумме зарядов центрального атома и ли- гандов. Внутреннюю сферу или комплекс заключают в скобки. В качестве примера рассмотрим составные части следующего ком- плексного соединения K4[Fe(CN)6]:
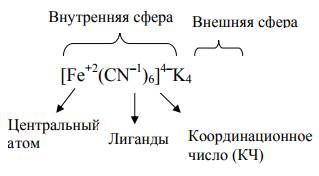
Атомы лиганды, с помощью которых осуществляется связь с цен- тральным атомом, называются донорными. Наиболее часто используют лиганды с донорными атомами кислорода, азота и серы. Число лигандов, принимающих прямое участие в связывании с центральным атомом назы- вается координационным числом.
Внешняя сфера — совокупность всех ионов, непосредственно не связанных с центральным атомом и находящихся за пределами внутрен- ней координационной сферы. Заряд внутренней сферы компенсируется ионами противоположного знака внешней сферы. Обычно внешнюю сфе- ру составляют простые одноатомные или многоатомные ионы.
В составе внутренней сферы в качестве центрального атома может входить любой элемент периодической системы элементов. Наиболее сильно комплексообразующая способность выражена у d- и f-элементов, слабее — у р-элементов, s-элементы в роли центрального атома выступа- ют редко. Центральный атом может иметь любую степень окисления:
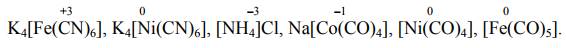
Значение координационного числа центрального атома зависит от его природы, степени окисления, природы лигандов и условий, при кото- рых протекает реакция комплексообразования. Значение координационно- го числа может меняться в различных комплексных соединениях от 2 до 8 и выше. Наиболее распространенными координационными числами явля- ются 4 и 6. Чаще всего значение координационного числа в 2 раза больше степени окисления центрального атома.
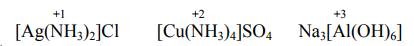
Чем больше заряд центрального атома и чем меньше его радиус, тем более прочный комплекс образуется. В качестве лигандов выступают ионы и нейтральные молекулы. Число донорных атомов лиганда, образующих координационные связи с центральным атомом, называется дентатностью лиганда. В зависимости от числа донорных атомов различают лиганды с разной дентатностью.
Ес- ли лиганд образует одну координационную связь с центральным атомом, то это монодентатный лиганд. Число монодентатных лигандов во внут- ренней сфере равно координационному числу центрального атома. Моно- дентатные лиганды содержат один донорный атом: Н2О, NН3, ОН– , Cl– .
Бидентатные лиганды содержат два донорных атома и образуют две ко- ординационные связи с центральным атомом. Это анионы SO4 2– , CrO4 2–, молекулы — этилендиамин (Н2N–СН2–СН2–NH2), аминоуксусная кислота (Н2N–СН2–COOH).
Существуют и полидентатные лиганды, которые со- держат больше двух донорных атомов. К ним относится гексадентатный лиганд — этилендиаминтетраацетат-ион этилендиаминтетрауксусной ки- слоты. (ЭДТА). Он образует комплексы со многими металлами за счет атома кислорода каждого из четырех карбоксильных групп и за счет обоих атомов азота:
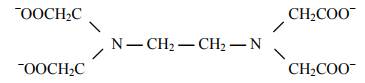
К полидентатным лигандам относятся белки.

Дата: 2018-12-28, просмотров: 863.