Первое начало термодинамики. Внутренняя энергия, изобарный и изохорный тепловые процессы. Энтальпия.
Энергия. Внутренняя энергия. Количественной мерой движения материи является энергия. Внутренняя энергия системы (U) — это сумма кинетической энергии (Екин.) движения всех частиц системы (молекул, атомов, ионов, электронов и др.) и потенциальной энергии (Епот..) взаимо- действия между ними. U= Екин.+ Епот. Мы не можем измерить абсолютное значение внутренней энергии ка- кой-либо системы, но можем измерить изменение внутренней энергии (ΔU). Это достаточно для решения многих физико-химических проблем. Единица измерения энергии джоуль или калория (Дж, кал), 1 Дж = 1 н·м (нью- тон·метр); 1 ккал = 1000 кал = 4,184 кДж.
Работа и теплота. Изменение внутренней энергии системы связано с обменом энергией этой системы с окружающей средой. Этот обмен осу- ществляется в двух формах — либо в форме работы, либо в форме тепло- ты, либо одновременно. Работа и теплота — это формы передачи энергии от одной системы к другой. Работа (А) — это форма передачи энергии в виде упорядоченного движения (движение поршня). Теплота (Q) — форма передачи энергии в виде неупорядоченного движения и взаимодействия молекул при наличии градиента температуры. Если система получает некоторое количество энергии, передаваемое в форме тепла, то Q условно считают положительной величиной; если же система отдает энергию окружающей среде в форме тепла, то Q считают отрицательной величиной.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Между теплотой (Q), работой (А) и изменением внутренней энергии ΔU существует зависимость, которая выражается в виде первого закона термодинамики. Первый закон термодинамики — это частный случай за- кона сохранения энергии и формулируется закон следующим образом: «если к системе подводится определенное количество энергии в форме те- плоты Q, то часть этой энергии идет на изменение внутренней энергии ΔU, а остальная часть — на совершение работы». Q = ΔU + А, где А = рΔV, р — давление, ΔV — изменение объема системы. Применение первого закона термодинамики к различным про- цессам.
1. Изохорный процесс. V = const., ΔV = 0, тогда рΔV = 0. В этом случае математическое выражение первого закона термоди- намики имеет вид: Qv = ΔU, где Qv — энергия, сообщаемая системе в изохорном процессе. Из уравнения следует, что энергия, сообщенная системе в форме теп- лоты, идет только на приращение внутренней энергии системы. В этом слу- чае Qv не зависит от пути перехода системы из одного состояния в другое.
2. Изобарный процесс. Р = const., ΔР = 0. В случае изобарного про- цесса Qр = ΔU + рΔV или Qр = U2 – U1 + рV2 – рV1. Сгруппируем величины с одинаковыми индексами: Qр = (U2 + рV2) – ( U1 + рV1). Так как внутренняя энергия, объем системы и давление — функции состояния, то сумма величин (U + рV) также должна быть функцией со- стояния и ее изменение не зависит от пути перехода системы из одного состояния в другое. Эту функцию состояния называют энтальпией и обо- значают символом Н: Н = U + рV.
Из уравнений следует, что Qр = ΔН, т. е. в изобарном процессе энергия, сообщенная системе в форме теплоты, идет на приращение эн- тальпии системы. Энтальпия характеризует энергосодержание системы. Если ΔН < 0, то это экзотермический процесс, и он протекает с выделени- ем теплоты; если ΔН > 0, то это эндотермический процесс и он протекает с поглощением теплоты.
3.Изотермический процесс. Т = const и ΔU = 0 для такого процес- са, тогда Q = А. Таким образом, вся сообщенная системе энергия в форме теплоты превращается в работу.
4. Адиабатный процесс. В адиабатном процессе система не обме- нивается с окружающей средой энергией (Q = 0), работа совершается за счет уменьшения внутренней энергии системы: А = –ΔU.
Химические свойства комплексных соединений. Примеры комплексных соединений в медицине.
Механизмы реакций координационных соединений. Реакционная способность координированных лигандов комплексных соединений. Окислительно-восстановительныесвойства комплексных соединений. Типыокислительно-восстановительныхпревращений комплексных соединений. Влияние процессов комплексообразования на величину электродных потенциалов в растворах электролитов.Применение комплексных соединений. Аналитическая и органическая химия. Катализ. Красители. Пигменты.
В гетерогенных системах
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций становятся одинаковыми, то наступает химическое равновесие в гетерогенной системе, называемое гетерогенным химическим равновесием. Условием этого равновесия является равенство энергии Гиббса реакции нулю, т.е. D G = 0.
Как в случае гомогенной химической реакции, константа гетерогенного химического равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам соответственно продуктов реакций и исходных веществ.
Таким образом, в уравнения констант гетерогенного химического равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях. В них также не входит площадь поверхности раздела фаз.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры в случае эндотермической прямой реакции (D Н < 0) и уменьшается с увеличением температуры в случае экзотермической прямой реакции (D Н < 0). Константа гетерогенного химического равновесия может быть рассчитана по уравнению
Кр = ехр[- D G ° /(RT)]. (3.11)
Расчеты равновесных концентраций и давлений реагирующих веществ для гетерогенных и гомогенных химических реакций аналогичны.
Катализ. Виды. Примеры гомогенного и гетерогенного катализа.
Катализ и катализаторы Катализ — изменение скорости реакции под действием веществ, которые сами не изменяются ни качественно, ни количественно в конце реакции. Эти вещества называются катализаторами. Катализатор не влияет на константу химического равновесия. Он только ускоряет или замедляет достижение химического равновесия, но одинаково влияет на константу скорости прямой реакции и на константу скорости обратной реакции. Катализатор ведет реакцию по пути с меньшей или с большей энер- гией активации ЕА. Положительный катализатор увеличивает скорость реакции, т. к. уменьшается ЕА; отрицательный катализатор уменьшает скорость реакции и увеличивает ЕА. Катализатор практически не влияет на общее число соударений, но влияет на энергию активации ЕА.
Катализатор может способствовать достижению ориентации, необ- ходимой для взаимодействия молекул. Различают гомогенный и гетерогенный катализ. Катализаторы, ко- торые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объ- яснить на основе теории промежуточных соединений. Согласно этой тео- рии, катализатор образует с реагентами промежуточные соединения, ко- торые уменьшают энергию активации реакции. Например, реакция 2SO2 + О2 → 2SО3 в присутствии оксида азота (II) NО может происходить по схеме:
2NO + О2 → 2NO2 (промежуточное соединение)
NO2 + SO2 → SO3 + NO
Как видно из системы, в суммарное уравнение реакции катализатор NO не входит, т. е. в результате реакции он не изменяется.
В случае гетерогенного катализа катализатор и реагенты находятся в разных фазах и имеют границу раздела. На поверхности твердого ката- лизатора (а точнее на поверхности раздела фаз) реагируют газообразные или жидкие вещества. Механизм каталитических гетерогенных реакций очень сложен и за- висит от природы реакции. Вначале на активных центрах поверхности ге- терогенного катализатора происходит процесс хемосорбции молекул ис- ходных веществ, в результате чего происходит:
a) локальное увеличение концентрации молекул исходных веществ на активных центрах;
б) ослаб- ление химических связей в молекулах исходных веществ, что заставляет их распадаться до атомов, которые реагируют друг с другом и образуют молекулу нового вещества, которое покидает поверхность катализатора.
К каталитическим гетерогенным реакциям относятся известные реакции по- лучения аммиака и оксида серы (IV).
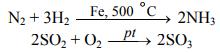
Биологические катализаторы — ферменты Химические процессы в живых организмах осуществляются при помощи биологических катализаторов — ферментов. Все известные в на- стоящее время ферменты являются белками, многие из которых содержат ионы металлов.
Особенности действия ферментов.
1.Высокая каталитическая активность. Ферменты резко снижают ЕА биохимических реакций.
2.Высокая специфичность и направленность действия. Напри- мер, амилаза, которая содержится в слюне, легко и быстро расщепляет крахмал, но не расщепляет сахарозу. Фермент уреаза расщепляет только мочевину
3. Мягкие условия действия ферментов. Каталитические действие ферментов происходит при температуре 37–40 ºС, невысоком давлении и определенном значении рН. 4. Отсутствие побочных эффектов в биохимических реакциях с участием ферментов.

Переход:
| m (x) 100 | |||||||||
|
| ω (х ) = | , |
| ||||||
| ρ V(мл) | |||||||||
| m (x ) = ω(x ) ρ V (мл ), | |||||||||
| 100 | |||||||||
| C(x) = | m (x) | = |
| ω(x) ρ V(мл) | . | ||||
| M (x) V(л) |
| ||||||||
| 100 М(х) V(л) | |||||||||
См. п.33
Понижение давление паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу. Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль
p = p0 · nр-ля/(nв-ва + nр-ля), где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
(p0 – p)/p0 = χв-ва
(p0 – p)/p0 = nв-ва/(nв-ва + nр-ля)
При этом принимаем, что χв-ва + χр-ль = 1
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
p0 – p = Δр
Δp = i · p0 · χв-ва, где
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
i = 1+α(n—1), где
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Таблица 2.1
Сильные электролиты
| Класс | Формулы электролитов |
| Кислота | HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 |
| Основание | LiOH , KOH, RbOH, CsOH, NaOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
| Соль | Растворимые соли |
Слабым электролитом принято считать химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциируют на ионы. Степень диссоциации слабых электролитов для децимолярных растворов (0,1М) меньше 3%. Примеры слабых электролитов: все органические кислоты, некоторые неорганические кислоты (например, H2S, HCN), большинство гидроксидов (например, Zn(OH)2, Cu(OH)2).
Для растворов слабых кислот концентрация ионов водорода [H+] в растворе рассчитывается по формуле:
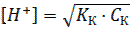
где: Кк – константа диссоциации слабой кислоты; Ск – концентрация кислоты, моль/дм3.
Для растворов слабых оснований концентрация гидроксильных ионов рассчитывается по формуле:
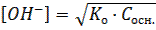
где: Ко – константа диссоциации слабого основания; Сосн. – концентрация основания, моль/дм3.
Таблица 2.2
Алкалиметрия. Установочные и рабочие растворы, их приготовление и применение в анализе. Определение массы соляной и уксусной кислот при совместном присутствии. Установочные и рабочие растворы, выбор индикаторов. Величина рН в точке эквивалентности.
Алкалиметрия – метод определения сильных и слабых кислот, кислых солей, солей слабых оснований путем титрования их стан-
дартным раствором сильного основания.
Основными титрантами являются растворы гидроксида натрия (NaOH) или гидроксида калия (KOH). Эти растворы нельзя приготовить по точной навеске вследствие их взаимодействия с углекислым газом и поглощением паров воды из воздуха, поэтому титрант готовят приблизительной концентрации, разбавляя водой 50%-ныйраствор (растворимость карбоната натрия в концентрированном растворе NaOH мала), а затем стандартизируют его по дигидрату у.р.щавелевой кислоты (Н2С2О4 2Н2О). В основе стандартизации лежит реакция:
2NaOH + Н2С2О4 = Na2С2О4 + 2Н2О.
Раствор щелочи можно приготовить и из фиксаналов, но с обязательной последующей стандартизацией.Способ титрования приямой, индикаторы:фенолфт,метилораж.
Сущность метода перманганатометрии. Рабочие и установочные растворы, их приготовление. Условие перманганатометрического титрования. Определение молярной концентрации эквивалента и титра калий перманганата по щавелевой кислоте.
Перганатометрия-в основе лежит реакция окисления перманганатом калия, реакция восстановления самого перманганата. MnO4+8H+5e->Mn+4H2O суть метода
Условия проведения:
1.Добавления серной кислоты так как pH>7 KMnO4 является сильнейшим окислителем с др.ст. обр. бесц. Ион Mg в отличие от нейтр среды MnO2 и щелочной среды K2MnO4
2.Не применяют индикаторов так как раствор перманганата имеет интенсивную окраску способ.окрашивать р-р в точке эквивалентности в слабый розовый цвет.
3.К р-р. Опр. В-ва. Р-р перманганата титранта добавл.медленно в изб. Окислителя во избежание побочных реакций.
В качестве установочных веществ в перманганатометрии используют щавелевую кислоту и ее соли: оксалат натрия и оксалат аммония.
Реакцию между щавелевой кислотой и перманганатом калия в кислой среде можно представить следующим уравнением:
| 5H2С2O4 | + 2KMnO4 + 3H2SO4 = 2MnSO4 + 10СO2 + 8H2O + K2SO4 | |||||||||||||||
| MnO 4 | + 8H+ + 5е Mn2+ + 4H2O | о(MnO4 ,Mn2+) = +1,51 В | ||||||||||||||
| 2 | ||||||||||||||||
| 2СO + 2H+ + 2e H | С | O | 5 | о(СO | /С | О 2 ) =–0,49В | ||||||||||
| 2 | 2 | 2 | 4 | 2 | 2 | 4 | ||||||||||
|
|
|
| ||||||||||||||
| 5H С | 2 | O | 4 | + 2MnO + 6H+ | = 10СO | 2 | + 2Mn2+ + 8H | 2 | O | |||||||
| 2 | 4 | |||||||||||||||
Реакция протекает слева направо, так как
о(MnO4 ,Mn2+) >о(СO2/С2О24 )
Предмет и задачи химии. Значение для современной медицины. Термодинамика. Системы: открытые и закрытые, изолированные, их параметры, процессы протекающие в этих системах.
Химия — это наука о веществах, их свой- ствах, превращениях и явлениях, которые сопровождают эти превращения. Химия имеет две основные задачи. Первая задача — это умение раз- личать вещества по их физическим и химическим свойствам, а иногда по физиологическому действию на живой организм. Вторая задача – получе- ние различных веществ, которых в природе нет. К ним относятся полиме- ры, некоторые минеральные удобрения, лекарственные соединения.
Большое количество различных химических веществ из окружающей среды попадает в организм человека. Действие этих ве- ществ оказывает влияние на организм в течение всей его жизни и может передаваться по наследству от поколения к поколению. Знание возможных последствий воздействия различного рода химических соединений на здо- ровье человека становится необходимым для будущего врача. Связь между химией и медициной наблюдается на протяжении всей истории накопления химических и медицинских знаний. В 50-е годы XX в. на границе химии, биологии и медицины возникли такие новые дисципли- ны как бионеорганическая химия и биофизическая.
Бионеорганическая химия изучает роль химических элементов в раз- ных процессах здорового и больного организма.
Биофизическая химия изучает физико-химические процессы обмена веществ (или процессов жизнедеятельности). Основу биофизической хи- мии составляет биологическая термодинамика (наука о трансформации энергии в живых организмах) и общая кинетика биохимических процессов (учение о скоростях и механизмах биохимических реакций).
Для прогресса медицины необходимо изучение молекулярных основ жизни на базе химии и физики. Результаты этих знаний позволяют понять природу различных заболеваний, которые представляют разнообразные отклонения от протекающих в организме химических реакций.
Наука, которая изучает трансформацию энергии в живых организ- мах, называется биоэнергетикой. Теоретическую основу биоэнергетики представляет химическая термодинамика. Биоэнергетику изучают как раз- дел биохимии. Термодинамика — это наука о взаимных превращениях различных видов энергии в друг друга, а также о формах передачи энергии в виде те- плоты и работы. Задачи химической термодинамики: 1. Установление энергетических эффектов химических и физико- химических процессов (тепловые эффекты химических реакций). 2. Установление возможности самопроизвольного протекания хи- мических процессов. 3. Установление условий равновесного состояния термодинамиче- ских процессов.
Термодинамическая система — это тело или совокупность тел, ог- раниченных от окружающей среды мысленно или реально существующи- ми границами. Примеры термодинамических систем: газ в сосуде, клетка, растение, орган. Типы термодинамических систем: 1. Изолированные системы. Такие системы не обмениваются с ок- ружающей средой ни веществом, ни энергией. В природе таких систем нет: это плод научной фантазии. 2. Закрытые системы. Эти системы обмениваются с окружающей средой энергией, но не веществом. Например: электролампочка, гермети- чески закрытый сосуд с теплопроводящими стенками. 3. Открытые системы. Такие системы обмениваются с окружаю- щей средой веществом и энергией. Например: живые организмы. По составу системы разделяются на гомогенные и гетерогенные. Гомогенные системы однофазные, не имеют поверхности раздела. Все части системы имеют одинаковые химические и физические свойства. На- пример: воздух (смесь газов), истинные растворы. Гетерогенные системы многофазные, неоднородные, имеют поверхность раздела. Например: лед в воде, жидкость и пар.
Фаза — это часть системы с одинаковыми физическими и химическими свойствами. Например: система «лед–вода». Одна фаза лед, другая — вода.
Состояние системы, стандартное состояние. Состояние системы определяется совокупностью ее физических и химических свойств. Если свойства изменяются, то изменяется и состояние системы; если же свойст- ва системы не изменяются со временем, то система находится в состоянии равновесия.
Термодинамические параметры состояния системы. Все величи- ны, характеризующие то или иное макроскопическое состояние системы, называются термодинамическими параметрами. Различают независимые (основные) и зависимые термодинамические параметры. Независимые термодинамические параметры можно измерить. Это температура, давле- ние, масса, объем, плотность. Зависимые термодинамические параметры нельзя измерить, так как они зависят от остальных параметров. Например, внутренняя энергия (U) зависит от температуры, концентрации и т. д. За- висимые термодинамические параметры называют функциями состоя- ния системы. Это название введено для того, чтобы отличить свойства системы от таких характеристик процессов (функций процессов), как теп- лота и работа. Изменение таких параметров зависит только от их значений в начальном и конечном состояниях системы, но не зависит от пути пере- хода системы из одного состояния в другое.
Термодинамические процессы. Любое изменение состояния сис- темы — это термодинамический процесс. В зависимости от условий про- ведения процесса различают следующие виды процессов.
Круговой или циклический — процесс, в результате протекания ко- торого, система возвращается в исходное состояние. После завершения кругового процесса изменения любой функции состояния системы равны нулю.
Изотермический — процесс, протекающий при постоянной темпе- ратуре. Т = const., ΔТ = 0.
Изохорный — процесс, при котором объем системы остается посто- янным. V = const., ΔV = 0.
Изобарный — процесс, протекающий при постоянном давлении. Р = const., ΔР = 0.
Адиабатический (адиабатный). Теплообмен с окружающей средой отсутствует. Q = 0.
В зависимости от характера протекания процесса раз- личают два типа термодинамических процессов.
1.Термодинамически обратимые процессы (не путать с кинетиче- скими обратимыми процессами). Это такие процессы, которые можно провести как в прямом, так и в обратном направлении через одни и те же стадии без каких-либо изменений в окружающей среде. Эти процессы протекают бесконечно медленно через ряд стадий бесконечно близких к равновесным. Например, движение поршня без трения при снятии с него песчинок.
2.Необратимые термодинамические процессы в прямом направле- нии протекают не так, как в обратном. Необратимые термодинамические процессы оставляют в окружающей среде следы своего протекания. На- пример, двигатель внутреннего сгорания, процессы жизнедеятельности.
Дата: 2018-12-28, просмотров: 626.