А как зависит от температуры растворимость твердого вещества? Подход
и принципиальные результаты здесь совершенно таковы же, что и для газов.
а) Воспользуемся формальным представлением растворения в виде химической реакции:
(Вещество 2)тв ↔ (Вещество 2)р-р (8.10,а)
б) Как известно, константа равновесия в данном случае просто совпадает
с равновесной концентрацией растворяемого вещества:
Кр = [Вещество 2] . (8.10,б)
 |
в) Для этой константы-концентрации уравнение изобары (5.20) записывается так:
 |
г) Вытекающий из него вывод аналогичен таковому для растворимости газов:
если
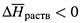 , то при росте температуры растворимость вещества понижается. Однако в случае твердых веществ чаще наблюдается обратная ситуация:
, то при росте температуры растворимость вещества понижается. Однако в случае твердых веществ чаще наблюдается обратная ситуация:
Поэтому их растворимость при нагревании обычно увеличивается.
Краткое содержание главы 8
Глава посвящена частному виду двухкомпонентных систем – РАСТВОРАМ.
1. Для их характеристики наиболее часто используются молярные (с i) и моляльные (b i) концентрации, а также молярная доля (Х i), связанные следующими соотношениями:
с i ≈ X i n i /Vo , X i ≈ b i M i
2. В т.н. ИДЕАЛЬНЫХ РАСТВОРАХ все межмолекулярные взаимодействия одинаковы по характеру и силе. Для таких растворов изменение энергии Гиббса составляет:
а) при образовании газового раствора –
ΔGо = (n1 + n2) RT [X1 ln X1 + X2 ln X2] ,
б) в жидких растворах – при повышении концентрации растворённого вещества с X2 до X2′:
Δ Gо = n1 RT ln ( X1′ / X1 ) + n2 RT ln ( X2′ / X2 ) + Δn2 RT ln X2′ .
 3. Затем речь шла о ФАЗОВОМ РАВНОВЕСИИ МЕЖДУ РАСТВОРИТЕЛЕМ И ЕГО ПАРОМ над раствором. Был сформулирован ЗАКОН РАУЛЯ: давление насыщенного пара над ИДЕАЛЬНЫМ раствором пропорционально молярной доле растворителя:
3. Затем речь шла о ФАЗОВОМ РАВНОВЕСИИ МЕЖДУ РАСТВОРИТЕЛЕМ И ЕГО ПАРОМ над раствором. Был сформулирован ЗАКОН РАУЛЯ: давление насыщенного пара над ИДЕАЛЬНЫМ раствором пропорционально молярной доле растворителя:
 4. Отсюда вытекают КОЛЛИГАТИВНЫЕ ЭФФЕКТЫ. Растворение вещества в растворителе приводит к:
4. Отсюда вытекают КОЛЛИГАТИВНЫЕ ЭФФЕКТЫ. Растворение вещества в растворителе приводит к:
а) понижению давления насыщенного пара растворителя,
б) понижению температуры замерзания раствора,
в) повышению температуры кипения,
г) возникновению осмотического давления,
 При этом эбулиоскопическая и криоскопическая константы определяются природой только растворителя:
При этом эбулиоскопическая и криоскопическая константы определяются природой только растворителя:
5. Для растворов ЭЛЕКТРОЛИТОВ вводится поправочный множитель — ИЗОТО-НИЧЕСКИЙ КОЭФФИЦИЕНТ i :

причем для сильных и для слабых электролитов он вычисляется так:
 |
6. а) И в общем случае эффективные концентрации (АКТИВНОСТИ) часто отличаются от истинных:
а X = γХ , а c = γс , a b = γ b .
б) КОЭФФИЦИЕНТЫ АКТИВНОСТИ γ зависят от концентрации веществ, что выражается УРАВНЕНИЕМ ГИББСА-ДЮГЕМА:
(1 – Х2) d (ln γ1) = – X2 d (ln γ2) .
7. РАСТВОРИМОСТЬ ГАЗА зависит от его парциального давления над раствором (ЗАКОН ГЕНРИ) и концентрации солей в растворе (ЗАКОН СЕЧЕНОВА):
с2 ≈ КР Р2 , ln KР = ln KР0 – k cсоль .
Глава 9. ЖИДКИЕ СМЕСИ С НЕОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ
Теперь рассмотрим растворы жидкости в жидкости, которые правильней называть смесями. Смеси различаются по взаимной растворимости жидкостей, что связано с природой последних и характером межмолекулярного взаимодействия.
Рассмотрим вначале простейший тип смесей. Как обычно, будем иметь в виду систему под поршнем.
Дата: 2019-02-02, просмотров: 345.