1. Теперь обратимся к температуре кипения смеси.
а) Если компоненты смеси различаются по своей летучести (значениям 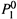 и
и 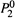 ), то они различаются и по температурам кипения в чистом состоянии.
), то они различаются и по температурам кипения в чистом состоянии.
б) У менее летучей жидкости 1, очевидно, данная температура выше:
 |
Это показано на рис. 9.4 соответствующими точками на осях температуры.
2. Для смеси же температура кипения, как тоже очевидно, будет зависеть от её состава.
а) Понятно, что с ростом X2 (увеличением доли более летучего компонента) Тк смеси будет уменьшаться — от Тк,1 до Тк,2 (нижняя кривая на рис. 9.4).
 б) В отличие от зависимости P0(X2) ((9.3) и рис. 9.1), рассматриваемая сейчас зависимость является нелинейной.
б) В отличие от зависимости P0(X2) ((9.3) и рис. 9.1), рассматриваемая сейчас зависимость является нелинейной.
Действительно, количественную зависимость Тк от X2 можно получить, если исходить из условия: общее давление пара над смесью равно внешнему давлению:
 |
 |
где для величин
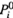 следует использовать уравнение Клаузиуса-Клайперона (7.22,6) с искомой температурой:
следует использовать уравнение Клаузиуса-Клайперона (7.22,6) с искомой температурой:
Без дальнейших вычислений понятно, что
зависимость Тк от Х2 окажется нелинейной.
в) Верхняя кривая (п) связывает температуру кипения и состав газовой фазы. Построение ее происходит так же, как построение линии п на рис. 9.3; так что в итоге точке М линии ж соответствует точка М' линии п.
3. а) Диаграмма опять-таки разделяется на три области, но в отличие от диаграммы давления порядок расположения областей обратен: область пара — над линией п, а область жидкой фазы — под линией ж.
б) Кроме того, диаграмма позволяет прогнозировать, как будут изменяться состав и масса каждой фазы в процессе кипения смеси.
4. Состав фаз. Пусть исходный состав жидкости (находящейся в системе под поршнем) — X2,0.
а) По достижении температуры кипения (точки М на нижней кривой диаграммы рис. 9.4) в системе начинает образовываться пар с составом 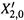 (точка М' на верхней кривой).
(точка М' на верхней кривой).
б) В процессе кипения переход в пар второго (более летучего) вещества происходит легче, чем первого. Поэтому содержание второго компонента в жидкой фазе (величина X2) неуклонно снижается. Движение идет по нижней кривой влево от точки М.
в) Соответственно, снижается содержание этого вещества и в паре. Движение по верхней кривой от точки М' — тоже влево.
г) Таким образом, на первых стадиях процесса преимущественно испарялся компонент 2 и пар был им обогащен. Со временем же постепенно возрастают:
- доля компонента 1 в жидкой фазе,
- температура кипения этой фазы,
- доля компонента 1 в паре.
д) Напомним: предполагается, что пар никуда из системы не отводится. Тогда суммарный состав системы (с учетом и жидкости, и пара) остается постоянным: он численно равен X2,0 и на рис.9.4 отражается одной из точек вертикали М N.
е) Ясно также, что при полном испарении обоих компонентов состав пара будет описываться точкой N , т.е. сравняется с составом исходной жидкой смеси.
5. Масса фаз. Кроме состава фаз смеси на разных стадиях испарения, можно оценить и массы фаз.
а) Допустим, на некоторой стадии кипения состав жидкой фазы отражается
точкой К, а парообразной — точкой К', тогда суммарное состояние системы
отражается точкой О (местом пересечения горизонтали КК' с вертикалью М N).
б) Можно убедиться в перекрёстном правиле рычага:
- отрезок ОК на рис. 9.4, примыкающий к нижней кривой (ж), пропорционален массе газовой фазы,
- а отрезок ОК', примыкающий к верхней кривой (п), — массе жидкой фазы.
в) Действительно, в состоянии О молярная доля вещества 2 в системе
(сохраняющая исходное значение) может быть вычислена так:
 |
где n0 — общее число молей обоих компонентов в обеих фазах, а nж и nг —
количество молей обоих компонентов, соответственно, в жидкой и газовой фазах.
 |
Подставляя n0 = nж + nг , после простых преобразований получаем:
что и означает правило рычага.
Дата: 2019-02-02, просмотров: 321.