(закон Рауля)
1. Теперь примем во внимание не только сам жидкий раствор, но и газовую фазу над ним (рис. 8.3).
 а) Сначала рассмотрим только пар растворителя (т.е. растворенное вещество будем считать нелетучим). Над чистым растворителем давление насыщенного пара —
а) Сначала рассмотрим только пар растворителя (т.е. растворенное вещество будем считать нелетучим). Над чистым растворителем давление насыщенного пара — 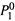 .
.
 |
б) В присутствии же растворенного вещества в идеальном
растворе среди поверхностных молекул жидкой фазы доля компонента 1 составляет уже X1<1. Соответственно, уменьшается число испаряющихся молекул. Поэтому давление насыщенного пара над раствором оказывается меньше, чем над чистым растворителем:
Это утверждение обозначается как закон Рауля.
в) Часто его формулируют более конкретно: давление (над раствором) насыщенного пара какого-либо компонента пропорционально молярной доле этого компонента в растворе. В данной формулировке закон можно отнести не только к растворителю, но и к любому летучему компоненту раствора.
2. Вот простой термодинамический вывод этого закона.
а) Для компонента 1 в газовой фазе используем уравнение Менделеева-Клайперона в форме (3.23,а):
 |
б) Отношение равновесных концентраций компонента 1 в газовой и жидкой
фазах — постоянная величина:
 |
в) Отсюда
 |
Формула (8.1,6) использована для разбавленных растворов (когда 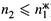 ).
).
 |
г) В результате и получается, что
3. В процессе этого вывода мы выяснили, от чего зависит давление насыщенного пара над чистым растворителем. Оно тем больше, чем выше а) молярная концентрация чистого растворителя ( 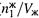 ), б) константа распределения
), б) константа распределения 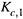 и в) температура.
и в) температура.
4. а) Закон Рауля имеет еще одну формулировку — через молярную долю растворенного вещества. Преобразуя выражение (8.12), получаем:
 |
б) Иначе говоря, понижение давления насыщенного пара растворителя пропорционально молярной доле растворенного вещества (8.17,6), а относительное понижение давления в точности равно этой доле (8.17, в).
5. Для разбавленных водных растворов удобней перейти от молярной доли к моляльной концентрации. Используя формулу связи (8.4, г), переписываем (8.17, в) следующим образом:

Здесь M1 — молярная масса воды.
8.6. Следствия из закона Рауля: изменение T к и T з
1. а) Как известно, жидкость закипает при такой температуре, при которой
давление насыщенного пара сравнивается с внешним:


 |
б) Поскольку растворенное вещество снижает давление пара растворителя, требуется большая температура, чтобы это давление сравнялось с внешним, т.е. присутствие растворенного вещества повышает температуру кипения раство ра. Причем, ΔTк пропорционально моляльной концентрации вещества:
Здесь Kэб — эбулиоскопическая констан та.
в) Этот эффект наглядно виден на
диаграмме в координатах давление-
температура (рис. 8.4), которая во многом напоминает диаграмму состояния воды (рис.7.2).
Так, здесь кривые O0C0 и OC описывают зависимость от температуры давления насыщенного пара растворителя . Но
- кривая O0C0 относится к чистому растворителю,
- а кривая ОС — к раствору.
Причём, вторая из них идет ниже (вследствие закона Рауля) и пересекает уровень в 760 мм рт. ст. (когда наступает кипение) при большей температуре. Это и означает, что температура кипения раствора выше, чем у чистого растворителя.
2. А при какой температуре происходит замерзание растворителя?
а) Ясно, что в присутствии растворенного вещества молекулам растворителя сложней образовать гомогенные кристаллы твердой фазы, поэтому требуется более сильное понижение температуры (по сравнению с чистым растворителем). Таким образом, присутствие растворенного вещества понижает температуру замерзания раствора.
б) Величина ΔТз тоже пропорциональна моляльной концентрации раствора:
 |
где Kз — так называемая криоскопическая константа.
в) И этот эффект следует из рис. 8.4. Действительно, линия A0O0 на диаграмме — это зависимость от температуры (Т) давления (Р) насыщенного пара над твердым
растворителем (надо льдом). Жидкая и твердая фазы растворителя приходят
в равновесие тогда, когда над ними сравниваются давления насыщенного пара,
т.е. когда с кривой A0O0 пересекается соответствующая кривая для жидкой фазы. Видно, что точка пересечения О лежит левее точки O0, что и означает меньшую температуру замерзания.
8.7. Природа констант Kэб и Kз
Вернемся к повышению температуры кипения и докажем, что ΔTк действи-
тельно пропорционально моляльной концентрации. Одновременно выясним,
от чего зависит эбулиоскопическая константа.
а) Рассмотрим на рис. 8.4 отрезки К0С0 и КС, где К – точка пересечения кривой ОС с вертикальной линией Т = Тк0 .
I . Заметим: Тк0 – температура кипения чистого растворителя при нормальном атмосферном давлении (Р10 = 760 мм рт.ст.).
II . Точка же К соответствует давлению пара над раствором при Тк0. Это давление обозначено через Р1 .
III . Наконец, К0 – точка пересечения горизонтальной линии Р = Р1 с кривой О0С0.
 |
б) Отрезки К0С0 и КС почти параллельны друг другу; поэтому практически равны отрезки К0К и КМ, т.е.
 |
в) Используя это обстоятельство, применим к кривой О0С0 (на отрезке К0С0) уравнение Клайперона-Клаузиуса:
Однако необходимо сделать следующие переобозначения:
 |
 |
Тогда указанное уравнение приобретает вид:
г) Закон Рауля позволяет преобразовать левую часть уравнения:
 |
д) Подставляя результат в (8.24) и выражая ΔTк, получаем:
 |
Здесь M1 измеряется в моль/кг. Таким образом, эбулиоскопическая константа зависит лишь от природы растворителя (его молекулярной массы, теплоты испарения и температуры кипения в чистом состоянии) и не зависит от природы растворенного вещества.
 |
е) Можно доказать, что сходную структуру имеет и криоскопическая константа:
Дата: 2019-02-02, просмотров: 413.