1. Исходные условия. а) Будем также считать, что жидкости
I. неограниченно растворимы друг в друге и
II. обе являются летучими, т. е. дают над раствором пар.
б) Введём обозначения: 1 — менее летучая жидкость, 2 — более летучая, т.е. у первой жидкости — ниже давление насыщенного пара над чистым веществом и, соответственно, выше температура кипения:
 |
в) Вспомним также условие идеальности раствора, согласно которому все виды межмолекулярных взаимодействий в системе — 1–1, 2–2 и 1–2 — одинаковы
по характеру и силе. Примерами являются смеси близких по природе жидкостей: бензол–толуол, гексан–гептан, метанол–этанол.
2. а) Для идеальной смеси закон Рауля (8.12) применим к обоим летучим компонентам:
 |
откуда

 б) Получается, что общее давление пара над смесью линейно зависит от состава смеси. Это изображено на рис. 9.1, где
б) Получается, что общее давление пара над смесью линейно зависит от состава смеси. Это изображено на рис. 9.1, где
- по оси абсцисс отложена молярная доля в жидкой фазе более летучего компонента,
- пунктирными линиями показаны парциальные давления паров каждого из двух
компонентов (при разном составе смеси)
- и сплошной линией — общее давление
пара над раствором.
3. а) Нетрудно определить состав пара при том или ином составе жидкой фазы. Молярные доли каждого вещества в паре обозначим штрихом. Тогда, например, доля в паре второго компонента такова:
 |
 Последнее выражение получено путем деления числителя и знаменателя на
Последнее выражение получено путем деления числителя и знаменателя на 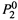 , а ζ1— величина, меньшая единицы:
, а ζ1— величина, меньшая единицы:

поскольку, в соответствии с условием, первый компонент является менее летучим.
 |
б) Заметим: так как X1 + X 2 = 1, то знаменатель выражения (9.4, в) меньше единицы:
в) Таким образом, доля второго (более летучего) компонента в паре выше, чем в жидкой смеси. В этом заключается первый закон Коновалова: по сравнению с жидкой фазой, состав газовой фазы обогащен более летучим компонентом.
На рис. 9.2 это выражается в том, что кривая зависимости 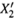 от X2 идет выше диагонали единичного квадрата. График же данной зависимости нетрудно построить, используя формулу (9.4, в).
от X2 идет выше диагонали единичного квадрата. График же данной зависимости нетрудно построить, используя формулу (9.4, в).
Идеальные смеси:
полный вариант диаграммы давления
 1. а) Нередко на диаграмме давления (рис. 9.3), кроме зависимости P0 от состава жидкости X2 (линии ж), изображают также линию, связывающую P0
1. а) Нередко на диаграмме давления (рис. 9.3), кроме зависимости P0 от состава жидкости X2 (линии ж), изображают также линию, связывающую P0
с составом газовой фазы 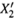 (линия п). Для этого удобно ввести еще одну
(линия п). Для этого удобно ввести еще одну
координатную ось — 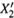 (хотя часто обходятся и без неё).
(хотя часто обходятся и без неё).
б) Тогда построение таково (см. рис. 9.3). Для произвольного значения X2,М по формулам (9.4) рассчитывают соответствующее значение 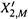 (большее X2,М) и находят точку пересечения этой ординаты
(большее X2,М) и находят точку пересечения этой ординаты 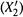 с изобарой, проходящей через точку М. Тем самым получают точку М', принадлежащую линии п.
с изобарой, проходящей через точку М. Тем самым получают точку М', принадлежащую линии п.
2. Линиями ж и п диаграмма разделяется на три области.
а) Над линией ж система имеет только жидкую фазу (имеется в виду, что система находится под поршнем). В любой точке этой области внешнее давление (создаваемое поршнем) больше возможного давления пара смеси, так что пар не образуется.
б) Между линиями возможно существование двух фаз: и жидкой, и газообразной. Например, в точке О (состав — X2,0, внешнее давление — P0 = Pм) сосуществуют жидкая фаза с составом X2,М и газовая с составом 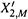 .
.
в) А под линией n система имеет только одну газовую фазу.
3. Отметим также, что состав газовой фазы зависит от температуры {закон
Вревского). Это следует из формулы (9.4,в). В ней фигурирует ζ1 — отношение
величин 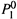 и
и 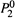 . Если эти величины с ростом температуры изменяются
. Если эти величины с ростом температуры изменяются
непропорционально, то 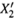 оказывается функцией температуры.
оказывается функцией температуры.
Дата: 2019-02-02, просмотров: 367.