Когда речь идет о фазовом переходе т→ж, т.е. в случае диаграммы воды (рис. 7.2), необходимо обратиться к кривой ОВ — зависимости Tпл от Р.
 |
1. а) Уравнение (7.16) перепишем в виде:
где по-прежнему 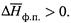
б) Следовательно, и крутизна, и знак производной 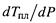 определяется величиной
определяется величиной 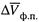 Как правило, эта величина (т. е. разность молярных объемов вещества в жидком и твердом состояниях) является небольшой.
Как правило, эта величина (т. е. разность молярных объемов вещества в жидком и твердом состояниях) является небольшой.
Поэтому чрезвычайно слаба и зависимость температуры плавления от давления, что мы наблюдали для плавления льда (пп. 7.2—7.3).
2. а) Так, при снижении давления от 760 мм рт. ст. до 4,6 мм рт. ст. в случае
льда Tпл изменяется всего на 0,01°С. Кроме того, для большинства веществ
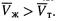 При плавлении объем обычно увеличивается на 3—5 %. Поэтому и
При плавлении объем обычно увеличивается на 3—5 %. Поэтому и
 |
т.е. наклон кривой Tпл(P) — положительный.
б) Однако некоторые вещества представляют исключение. Среди них — вода, висмут, галлий. Объем льда при плавлении уменьшается на 8 %, т. е. здесь
 |
Вследствие этого кривая ОВ на диаграмме состояния воды имеет слабый
отрицательный наклон.
3. Для практических расчетов более удобна приближенная интегральная
форма уравнения (7.26). Она основывается на том, что зависимость Tпл от Р —
очень слаба, отчего ее на рассматриваемом интервале давлений можно считать
линейной.
 |
Тогда приращение ΔTпл, обусловленное изменением давления ΔP , с учетом (7.26, б) примерно равно:
где ΔTпл,1 — температура плавления при исходном давлении. Таким образом, зная ΔTпл при одном давлении, можно оценить ее при другом давлении.
Краткое содержание главы 7
1. В главе рассмотрены фазовые состояния ОДНОКОМПОНЕНТНЫХ систем. Если из внешних параметров на такую систему влияют только давление и температура, то правило фаз Гиббса приобретает вид:
С = 3 – Ф,
где С – число степеней свободы системы, а Ф – количество фаз.
а) В качестве конкретной системы рассмотрена ВОДА (находящаяся в цилиндре под поршнем). Диаграмма её состояния имеет три монофазные области (Т, Ж, Г). Они разделены тремя линиями, сходящимися в одной (т.н. тройной) точке. Линии соответствуют двухфазным состояниям системы. При этом они отражают ту или иную зависимость:
- давления насыщенного пара от температуры,
- температуры кипения или плавления от внешнего давления.
В тройной точке одновременно сосуществуют три фазы воды.
б) На диаграмме состояния СЕРЫ – четыре области (две модификации твёрдой серы, а также Ж и Г), разделённые шестью линиями.
2. Ход линий фазовых диаграмм описывается УРАВНЕНИЕМ КЛАУЗИУСА-КЛАЙПЕРОНА.
а) Наиболее общая форма данного уравнения такова:
 |
Она показывает, что при фазовом равновесии произвольно изменяться может лишь один из внешних параметров – либо Т, либо Р.
 |
б) Отсюда можно получить зависимость давления насыщенного пара от температуры – например, в таком виде:
Тогда, зная давление насыщенного пара при температуре T 1, можно оценить давление пара при другой температуре, T 2 .
 |
в) А для перехода тв → ж следует зависимость температуры плавления от давления:
Зная T пл при одном давлении, можно найти T пл при другом давлении.
Глава 8. РАСТВОРЫ
В этой главе будут рассмотрены двухкомпонентные системы, точнее, частный вид таких систем — растворы.
Природа растворов
1. а) Раствор — это гомогенная система, в которой одно вещество равномерно
распределено в среде другого или других веществ.
б) Растворы бывают газообразными, жидкими и твердыми. В случае жидких
растворов различают растворитель и растворенное вещество. Но иногда такое
подразделение становится весьма условным — например, если одна жидкость
смешивается с другой. При необходимости же подразделения будут использованы индексы: 1 — для растворителя, 2 — для растворенного вещества.
2. При растворении происходит взаимодействие между компонентами раствора вида 1—1, 2—2 и 1—2, которое во многом зависит от полярности молекул компонентов.
 а) В полярных молекулах, даже если они в целом не заряжены, электрический заряд распределен асимметрично,
а) В полярных молекулах, даже если они в целом не заряжены, электрический заряд распределен асимметрично,
т.е. эти молекулы представляют собой диполи с условными
зарядами δ+ и > δ- (рис.8.1,a). Простейший пример — молекулы воды; здесь отрицательное электронное облако оттянуто на кислород (рис. 8.1,6).
В органических молекулах полярность создается за счет присутствия электрофильных элементов (О, N, S, Р).
б) Неполярные же органические молекулы — это, как правило, либо чистые углеводороды, либо вещества с преобладающей углеводородной частью; электронное облако распределено равномерно, дипольной структуры нет.
3. Как известно, «подобное растворяется в подобном», т.е. чем ближе полярные
(или неполярные) свойства компонентов, тем лучше их взаимная растворимость. Так, сахароза (полярное вещество) хорошо растворяется в воде (тоже полярной жидкости). Зато масло (неполярное вещество) в воде не растворяется.
4. А что понимают под идеальными растворами? В отличие от идельных газов, здесь не предполагается, что между молекулами системы нет никаких
взаимодействий. Предполагается лишь, что все эти взаимодействия одинаковы.
Итак, раствор называется идеальным, если в нем все виды межмолекулярных взаимодействий (т.е. взаимодействия вида 1—1, 2—2, 1—2) одинаковы по характеру и силе. Именно таким растворам посвящена настоящая глава.
Дата: 2019-02-02, просмотров: 379.