Другим важным параметром системы (наряду с параметром Ф) является
число независимых компонентов — К. Слово «независимых» часто опускают
и говорят просто: «число компонентов».
Так вот, К — это наименьшее количество веществ, необходимое для мате-
матического выражения состава всех фаз системы. От общего числа компо-
нентов в системе (К0) параметр К отличается на число математических связей
(х) между характеристиками компонентов:
К = К0 – х . (6.1)
2. Поясним это несколькими примерами (табл. 6.1).
 |
а) В первом примере речь идёт о растворении и диссоциации в воде NaCl. В системе – 3 компонента (в случае полной диссоциации): растворитель (вода) и оба иона – Na+ и Cl – . Но имеется одно условие – равенство концентраций ионов. Поэтому количество независимых компонентов равно 2.
б) Во втором примере в колбу вводят два газа – некоторое количество Н2 и некоторое (не связанное с первым) количество I2. В результате обратимой реакции получаем HI; следовательно — в системе вновь три компонента.
Но после достижения равновесия концентрации всех трех газов связаны друг
с другом законом действующих масс, т.е. выражением для константы равно-
весия. Следовательно, параметр К равен 2.
в) В третьем же примере в колбу вводят лишь один газ — йодистый водород. Некоторое его количество вступает в реакцию, обратную предыдущей. — В системе появляются еще 2 газа, т.е. всего в сосуде — опять те же три компонента.
Однако теперь имеются два уравнения связи — выражение для константы равновесия и стехиометрическое соотношение между продуктами (в данном случае — просто равенство их концентраций). В итоге, остается всего один независимый компонент, т.е. данная система рассматривается как однокомпонентная.
3. Параметр К фигурирует в фундаментальном правиле фаз Гиббса. Однако к этому правилу мы обратимся позже (в п. 6.5). Предварительно же выясним, что требуется, чтобы фазы находились друг относительно друга в состоянии термодинамического равновесия.
Условия фазового равновесия
 1. Пусть имеется двухфазная система (рис. 6.1), включающая К компонентов. Считается, что система находится в состоянии фазового равновесия
1. Пусть имеется двухфазная система (рис. 6.1), включающая К компонентов. Считается, что система находится в состоянии фазового равновесия
относительно i-го компонента , если не происходит резуль тирующего перемещения данного компонента из одной фазы в другую.
Слово «результирующее» означает, что равновесие может быть динамическим: отдельные молекулы вещества могут переходить из одной фазы в другую, но количество переходов «туда» и «обратно» (в единицу времени) строго одинаково.
Тем самым мы дали определение фазового равновесия.
2. Условия же равновесия таковы. В гетерогенной системе имеется фазовое равновесие, если между фазами существуют следующие виды равновесий:
- термическое (равенство температур),
- механическое (равенство давлений)
- и химическое в отношении каждого компонента.
Сюда можно было бы добавить и другие виды равновесий — электрическое
и магнитное.
3. Первые два условия достаточно понятны. Например, хорошо известно, что
если водяной пар над поверхностью воды имеет давление меньше насыща-
ющего и (или) температуру ниже, чем у воды, то происходит перемещение
молекул воды из жидкой фазы в газовую.
4. Следовательно, надо лишь определить, что в общем виде понимается под химическим равновесием между фазами.
а) Допустим, что условия термического и механического равновесий со-
блюдены, и система, представленная на рис. 6.1, находится при постоянном
давлении и температуре. Тогда термодинамическим потенциалом (п. 4.4) в этой системе является энергия Гиббса.
б) Так, если в системе происходит перемещение некоторого количества dni компонента Yi из фазы α в фазу β, то изменение энергии каждой фазы таково:

Здесь μ i (α) и μ i (β) — химические потенциалы вещества Yi (п. 4.7), т.е. энергия Гиббса 1 моля этого вещества в соответствующей фазе. Общее изменение энергии Гиббса системы при указанном перемещении равно

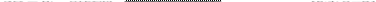 |
в) Условием же равновесия системы (при постоянных Т и Р) является постоянство ее энергии Гиббса:
Следовательно, можно сформулировать такое условие химического равнове-
сия: фазы системы находятся в химическом равновесии друг с другом относительно компонента Yi, если химические потенциалы данного компонента в этих фазах одинаковы.
Рассмотрим, к чему сводится это условие в конкретных ситуациях.
Дата: 2019-02-02, просмотров: 358.