Теоретические вопросы
1. Карбоновые кислоты. Изомерия и номенклатура.
2. Предельные одноосновные (жирные) кислоты: муравьиная, уксусная, пропионовая, масляная, изомасляная, валериановая, стеариновая, пальмитиновая.
3. Непредельные одноосновные карбоновые кислоты: акриловая, метакриловая, олеиновая, линолевая, линоленовая.
4. Двухосновные предельные карбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, адипиновая.
5. Двухосновные непредельные карбоновые кислоты: фумаровая и малеиновая кислоты как пример геометрической изомерии.
6. Ароматические кислоты: бензойная, фталевая, изофталевая, терефталевая.
7. Особенности строения карбоксильной группы и карбоксилат-аниона.
8. Химические свойства карбоновых кислот: образование солей, взаимодействие с аммиаком, получение сложных эфиров (этерификация), получение галогенангидридов, ангидридов, пиролиз солей щелочных металлов, сухая перегонка кальциевых и бариевых солей.
9. Замещение атома водорода в a-положении к карбоксильной группе на галоген. Получение аминокислот.
10. Сложные эфиры. Получение, гидролиз. Жиры. Масла.
11. Окисление муравьиной кислоты аммиачным раствором оксида серебра.
12. Способы получения оксикислот.
13. Полимеризация эфиров непредельных карбоновых кислот. Органическое стекло.
14. Превращения двухосновных карбоновых кислот при нагревании.
15. Реакции замещения в бензольном кольце бензойной кислоты.
Экспериментальная часть
Цель работы – изучение химических свойств карбоновых кислот
Опыт 1. Диссоциация карбоновых кислот.
а) Определение рН растворов карбоновых кислот. В трёх пробирках приготовьте соответственно растворы уксусной, бензойной и щавелевой кислот. Для этого в одну пробирку поместите 0,5 мл 2Н раствора уксусной кислоты и добавьте столько же дистиллированной воды. В другой пробирке растворите несколько кристалликов бензойной кислоты в 1 мл воды. Чтобы ускорить растворение бензойной кислоты, нагрейте пробирку на водяной бане. В третьей - растворите несколько кристалликов щавелевой кислоты в 1 мл воды. Чистой стеклянной палочкой нанесите по капле раствора на кусочки бумаги универсального индикатора на предметном стекле. Сравните цвет полосок индикатора со шкалой, запишите уравнения диссоциации всех кислот, цвет универсального индикатора и значения рН. Растворы кислот оставьте для опыта 1б.
б) Сила карбоновых кислот. К растворам кислот из опыта 1б добавьте по 1 мл насыщенного раствора карбоната натрия. Какие изменения наблюдаете? Запишите уравнения реакций в лабораторный журнал, рассчитайте константы равновесия обменных реакций (Кдис.СН3СООН = 1,75.10-5; Кдис.С6Н5СООН = 1,26.10-5; Кдис.Н2С2О4 = 5,4.10-2; Кдис.НС2О4- = 5,4.10-5; Кдис.Н2СО3 = 4,5.10-7; Кдис.НСОО- = 4,7.10-11). На основании обоих опытов – 1а и 1б –сделайте вывод о силе исследованных электролитов.
Опыт 2. Окисление щавелевой кислоты перманганатом калия. Приготовьте водный раствор щавелевой кислоты как в опыте 1а. Добавьте к нему 2-3 капли 2Н раствора серной кислоты и 1-2 капли 2%-го раствора перманганата калия. Смесь нагрейте на водяной бане. Какой газ выделяется в результате реакции? Запишите наблюдения в лабораторный журнал; в уравнении реакции отметьте окислитель и восстановитель. Объясните, почему необходимо добавлять серную кислоту, сравните величины стандартных электродных потенциалов окислителя в различных средах. Сделайте вывод о восстановительных свойствах щавелевой кислоты.
Опыт 3. Окисление олеиновой кислоты перманганатом калия. К 1 мл олеиновой кислоты (СН3(СН2)7-СН=СН-(СН2)7СООН) прибавьте 1 мл 2%-го раствора перманганата калия. Энергично встряхните содержимое пробирки. Олеиновая кислота окисляется до диоксистеариновой кислоты, а перманганат калия восстанавливается до диоксида марганца. Запишите наблюдения и уравнение реакции. В выводе укажите, класс органических соединений, для которого характерна эта реакция.
Опыт 4. Получение комплексного соединения меди (II) с α-аминопропионовой кислотой .
В коническую колбу налейте 10 мл 2%-го раствора аланина (α-аминопропионовой кислоты) и добавьте к нему 0,5 г CuCO3. Смесь прокипятите. В лабораторном журнале напишите схему образования комплексной соли и отметьте её цвет. В выводе объясните, для каких соединений Сu (II) характерна такая окраска.

Типовые задачи
1. Напишите формулы всех карбоновых кислот состава C5H10O2 .
2. Приведите формулу двух гомологов янтарной кислоты, имеющих а) на 8 электронов больше; б) на 16 электронов меньше.
3. Как можно разделить смесь, содержащую фенол, бензол и уксусную кислоту? Приведите уравнения реакций.
4. Напишите уравнения химических реакций:
а) муравьиной кислоты с аммиачным раствором оксида серебра;
б) линолевой кислоты с бромной водой;
в) кипячения раствора щавелевой кислоты;
г) бензойной кислоты с бромом в присутствии железа;
д) получения хлорангидрида янтарной кислоты.
е) получения полиметилметакрилата из метакриловой кислоты;
5. Напишите уравнения химических реакций:
а) получения полиметилметакрилата из метакриловой кислоты;
б) фталевой кислоты при нагревании;
в) щавелевой кислоты с карбонатом натрия;
г) линолевой кислоты с бромной водой;
д) хлоруксусной кислоты с аммиаком
6. Напишите уравнения химических реакций:
а) стеариновой кислоты с аммиаком;
б) муравьиной кислоты с аммиачным раствором оксида серебра;
в) кипячения растворов щавелевой кислоты;
г) бензойной кислоты с бромом в присутствии железа;
д) получения дипептида a-аминомасляной кислоты
Программа курса «Химия»
Цель изучения курса химии состоит в формировании системных знаний о строении вещества, основных закономерностях протекания химических реакций, закономерностях в химическом поведении основных классов неорганических и органических соединений во взаимосвязи с их строением для использования этих знаний в качестве основы при изучении процессов, протекающих в живом организме, и основных материалов, используемых в стоматологической практике.
Содержание курса
| № | Наименование раздела дисциплины | Содержание раздела |
| 1. | Строение вещества | Корпускулярно-волновой дуализм материального мира. Волновая функция. Электронные конфигурации атомов и ионов. Периодический закон Д.И. Менделеева. Химическая связь. Метод валентных связей. Гибридизация орбиталей. Пространственная конфигурация молекул. Химическая связь в комплексных соединениях. Ионная связь. |
| 2. | Термодинамика и кинетика химических реакций | Основы термохимии. Энтальпия. Закон Гесса. Энтропия. Свободная энергия Гиббса. Условия самопроизвольного протекания реакции. Скорость химической реакции. Порядок реакции. Химическое равновесие. Константа скорости и константа равновесия. Смещение химического равновесия. Понятия адсорбции и катализа. |
| 3. | Химические реакции в растворах | Общие понятия о дисперсных системах. Способы выражения концентрации растворов: массовая доля, титр, молярная, нормальная концентрации. Теория электролитической диссоциации. Зависимость кислотно-основных свойств электролитов от характера их диссоциации. Амфотерные электролиты (амфолиты). Ионные реакции. Условия протекания реакций ионного обмена. |
| 4. | Химические равновесия в растворах | Слабые электролиты. Закон разбавления. Эффект общего иона. Сильные электролиты. Активность и коэффициент активности. Ионная сила. Ионное произведение воды. Водородный показатель. Буферные растворы. Гидролиз солей. Константа гидролиза. Зависимость гидролиза от температуры и концентрации растворов. Константа растворимости. Растворимость. Условия растворения и образования осадка. Электролитическая диссоциация и константа нестойкости комплексных соединений. Коллоидные растворы. |
| 5. | Классы неорганических соединений | Основные классы неорганических соединений. Двойные оксиды. Керамические материалы. |
| 6. | Общие свойства металлов | Общие физические и химические свойства металлов. Сплавы. Сплавы. Микроструктура и диаграммы состояния различных типов сплавов. |
| 7. | Электрохимические процессы | Электрохимические процессы. Возникновение двойного электрического слоя на границе металл-электролит. Электродный потенциал, способы его измерения. Электрохимический ряд напряжений металлов. Принцип работы гальванических элементов. Электрохимическая коррозия. |
| 8. | Введение в органическую химию | Органическая химия как область науки, изучающая строение и механизмы функционирования биологически активных молекул с позиции органической химии. Основные положения теории химического строения. Изомерия. Классы органических соединений. Механизмы органических реакций. |
| 9. | Углеводороды | Предельные и непредельные углеводороды: основные типы химических реакций алканов и алкенов. Сопряженные диены. 1,2- и 1,4-Присоединение к сопряженным диенам. Полимеризация сопряженных диенов. Ароматические соединения. Реакции электрофильного замещения в ароматическом ядре. |
| 10. | Спирты и фенолы | Спирты (алкоголи и алканолы). Атомность спиртов. Водородная связь. Реакционная способность спиртов. Фенол. Кислые свойства фенола. |
| 11. | Карбонилсодержащие органические соединения | Альдегиды и кетоны. Электронное строение карбонильной группы. Реакции оксосоединений по карбонильной группе и по a-положению. Диальдегиды и дикетоны. Ацетилацетон. Кето-енольная таутомерия. |
| 12. | Карбоновые кислоты и их производные | Карбоновые кислоты. Строение карбоксильной группы. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, амиды, нитрилы, сложные эфиры. Методы получения и свойства. Природные высшие жирные кислоты (ВЖК): пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая, арахидоновая. Липиды и фосфолипиды. Ферментативный гидролиз жиров. Окисление кислот в организме. Фрагменты фосфорной кислоты в нуклеиновых кислотах и аденозинфосфатах. Фосфатиды. Лицетин и кефалин. Оксикислоты. Строение и номенклатура оксикислот. Молочная кислота, образование при молочнокислом брожении и в мышцах. Превращение молочной кислоты в пировиноградную при метаболизме. Яблочная, винная и лимонная кислоты. Оптическая изомерия на примерах молочной и винных кислот. |
| 13. | Амины | Амины. Основные свойства аминов. Диамины. Этилендиамин, путресцин, кадаверин, гексаметилендиамин – их биологическое значение и применение. |
| 14. | Аминокислоты | Аминокислоты, входящие в состав белков: классификация, строение, номенклатура, стереоизомерия, кислотно-основные свойства (образование биполярного иона). Химические свойства аминокислот. Биологически важные реакции a-аминокислот: дезаминирование (окислительное и неокислительное), гидроксилирование, декарбоксилирование a-аминокислот (образование коламина, гистамина, триптамина). |
| 15. | Пептиды и белки | Пептиды и белки. Первичная структура белков. Частичный и полный гидролиз. Понятие о сложных белках. Гликопротеиды, липопротеиды, нуклеопротеиды, фосфопротеиды. |
| 16. | Углеводы | Углеводы. Углеводы в природе. Значение углеводов. Фотосинтез. Моносахариды. Цикло-цепная таутомерия. D- и L- ряды. Реакции моноз по функциональным группам. Глюкоза, манноза, галактоза, фруктоза, рибоза и дезоксирибоза; нахождение в природе и биологическое значение. Аскорбиновая кислота. Восстанавливающие и невосстанавливающие дисахариды: сахароза, мальтоза, целлобиоза, лактоза. |
| 17. | Гетероциклические соединения | Биологически важнейшие гетероциклические системы. Нуклеиновые кислоты. Нуклеиновые основания. |
Рейтинговая система оценки знаний студентов по курсу «Химия»:
| Вид работы | Количество работ | Количество баллов | Общая сумма баллов |
| Лабораторные работы | 14 | 2 | 28 |
| Контрольные работы | 10 | 2 | 20 |
| Коллоквиумы | 2 1 | 10 12 | 20 12 |
| Итого за семестр | 80 | ||
| Итоговая аттестация | 20 | ||
| ИТОГО | 100 баллов | ||
| Баллы | Оценки | Оценки ECTS |
| 95 - 100 | 5 | А |
| 86-94 | 5 | В |
| 69-85 | 4 | С |
| 61-68 51-60 | 3 | D |
| 3 | Е | |
| 31-50 0-30 | 2 | FX |
| 2 | F |
Литература
а) основная литература
- Слесарев В.И. Химия. Основы химии живого. Санкт Петербург: Химиздат, 2005 г.
- Глинка Н.Л. Задачи и упражнения по общей химии М.: Высш. шк., 1988.
- Ковальчукова О.В., Авраменко О.В., Ромашкина Е.П., Колядина Н.М. Лабораторные работы по химии. Для студентов I курса медицинского факультета специальности «Стоматология» М.: изд-во РУДН, 2015 г.
- Ковальчукова О.В. Лекции по общей и биоорганической химии. Часть 1. Общая химия. М.: Изд-во РУДН, 2011.
- Ковальчукова О.В., Авраменко О.В. Лекции по общей и биоорганической химии. Часть 2. Биоорганическая химия. М.: Изд-во РУДН, 2010.
б) дополнительная литература
· Хомченко Г.П., Цитович И.К. Неорганическая химия. -М.: Высшая школа, 1986 и др.
· Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. “Дрофа”, Москва, 2005, 2011.
· Грандберг И.И, Органическая химия. “Дрофа”, Москва, 2002.
ПРИЛОЖЕНИЯ
Таблица 1.
Давление насыщенного водяного пара при различных температурах
| t,0C | h, мм рт ст | t,0C | h, мм рт ст | t,0C | h, мм рт ст |
| 0 | 4,58 | 20 | 17,54 | 35 | 42,18 |
| 10 | 9,21 | 21 | 18,65 | 40 | 55,32 |
| 11 | 9,84 | 22 | 19,83 | 45 | 71,88 |
| 12 | 10,52 | 23 | 21,07 | 50 | 92,51 |
| 13 | 11,23 | 24 | 22,38 | 55 | 118,0 |
| 14 | 11,99 | 25 | 23,76 | 60 | 149,4 |
| 15 | 12,79 | 26 | 25,21 | 65 | 187,5 |
| 16 | 13,63 | 27 | 26,74 | 70 | 233,7 |
| 17 | 14,53 | 28 | 28,35 | 80 | 355,1 |
| 18 | 15,48 | 29 | 30,04 | 90 | 525,8 |
| 19 | 16,48 | 30 | 31,82 | 100 | 760,0 |
Таблица 2.
Константы диссоциации некоторых слабых электролитов
| Электролит | Kдис. | Электролит | Kдис. |
К И С Л О Т Ы
 10-4
10-4
 10-5
10-5
 10-10
10-10
H3PO4
 10-3
10-3
H2B4O7
 10-4
10-4
 10-8
10-8
 10-8
10-8
 10-13
10-13
 10-4
10-4
 10-4
10-4
 10-12
10-12
H2CrO4
 10-1
10-1
 10-2
10-2
 10-7
10-7
H2SO3
 10-2
10-2
 10-2
10-2
 10-8
10-8
 10-10
10-10
H2S
 10-7
10-7
H2C2O4
 10-2
10-2
 10-13
10-13
 10-5
10-5
 10-1
10-1
H2CO3
 10-7
10-7
 10-11
10-11
О С Н О В А Н И Я
 10-9
10-9
 10-5
10-5
 H2O
H2O
 10-5
10-5
 10-7
10-7
 10-1
10-1
 10-5
10-5
 10-4
10-4
Pb(OH)2
 10-4
10-4
Fe(OH)3
 10-11
10-11
 10-8
10-8
 10-12
10-12
 10-10
10-10
 10-2
10-2
 10-9
10-9
Таблица 3.
Произведения растворимости некоторых малорастворимых веществ
| Соединение | Ks | Соединение | Ks |
| AgBr | 4.90  10-13 10-13
| Cu(OH)2 | 2.20  10-20 10-20
|
| AgCl | 1.78  10-10 10-10
| CuI | 1.10  10-12 10-12
|
| AgI | 9.98  10-17 10-17
| CuCO3 | 2.34  10-10 10-10
|
| Ag2SO4 | 5.02  10-5 10-5
| CuS | 6.31  10-36 10-36
|
| Ag2S | 6.31  10-50 10-50
| Cr(OH)3 | 6.31  10-31 10-31
|
| Ag2CrO4 | 1.44  10-12 10-12
| Fe(OH)2 | 7.94  10-16 10-16
|
| Al(OH)3 | 1.10  10-33 10-33
| Fe(OH)3 | 3.72  10-40 10-40
|
| BaCO3 | 5.93  10-9 10-9
| Hg2Cl2 | 1.32  10-18 10-18
|
| BaC2O4 | 1.49  10-7 10-7
| Mg(OH)2 | 1.32  10-11 10-11
|
| BaSO4 | 1.05  10-10 10-10
| Ni(OH)2 | 3.16  10-16 10-16
|
| BaCrO4 | 1.18  10-10 10-10
| PbI2 | 1.34  10-8 10-8
|
| CaCO3 | 3.26  10-9 10-9
| PbCl2 | 6.02  10-5 10-5
|
| CaC2O4 | 2.60  10-9 10-9
| PbSO4 | 1.90  10-8 10-8
|
| CaSO4 | 2.30  10-5 10-5
| PbCrO4 | 1.18  10-14 10-14
|
| CaCrO4 | 3.67  10-3 10-3
| Zn(OH)2 | 1.20  10-17 10-17
|
Таблица 4.
Стандартные окислительно-восстановительные потенциалы некоторых полуреакций
| Элемент | Полуреакция | j0, В |
| Br | Br2 + 2e ® 2Br - | +1.09 |
| BrO3- + 3H2O + 6e ®Br - + 6OH- | +0.61 | |
| HBrO3 + 5H+ + 6e ®Br - + 3H2O | +1.45 | |
| C | 2CO2 + 2H+ ® H2C2O4 | +1.35 |
| Cl | Cl2 + 2e ® 2Cl- | +1.19 |
| ClO4- + 2H+ + 2e®ClO3- +H2O | +0.36 | |
| ClO4- + H2O + 2e ®ClO3- + 2OH- | +1.39 | |
| 2ClO4- + 14H+ + 14e ® Cl2 + 8H2O | +1.47 | |
| 2ClO3- + 12H+ + 10e ® Cl2 + 3H2O | +1.95 | |
| Co | Co3+ + e ® Co2+ | +0.1 |
| [Co(NH3)6]3+ + e® [Co(NH3)6]2+ | ||
| Cr | Cr3+ + 3e ® Cr | -0.74 |
| Cr2O72- + 14H+ + 6e ® 2Cr3+ + 7H2O | +1.33 | |
| CrO42- + 4H2O + 3e ® Cr(OH)3 + 5OH- | -0.13 | |
| Cu | Cu2+ + e ® Cu+ | +0.16 |
| Cu2+ + 2e ® Cu | +0.34 | |
| Cu2+ + I- + e ® CuI | +0.86 | |
| Fe | Fe2+ +2e ® Fe | -0.44 |
| Fe3+ + e ® Fe2+ | +0.77 | |
| Fe3+ + 3e ® Fe | -0.04 | |
| [Fe(CN)6]3- + e ® [Fe(CN)6]4- | +0.36 | |
| H | 2H+ + 2e ® H2 | ±0.00 |
| 2H2O +2e ® H2 +2OH- | -0.83 | |
| I | I2 + 2e ® 2I- ( I3 + 2e ® 3I- ) | +1.78 |
| IO3- + 6H+ + 4e ® HIO + 3H2O | +0.88 | |
| IO3- + 6H+ + 6e ® I- + 3H2O | +0.54 | |
| Mn | MnO4- + 8H+ + 5e ® Mn2+ + 4H2O | +1.51 |
| MnO4- + 2H2O + 3e ® MnO2 + 4OH- | +0.59 | |
| MnO4- + e ® MnO42- | +0.56 | |
| N | NO3- + 4N+ + 3e ® NO + H2O | +0.96 |
| NO3- + 3H+ + 2e ® HNO2 + H2O | +0.94 | |
| NO3- + H2O +2e ® NO2- +2OH- | +0.01 | |
| NO3- + 2H+ + e ® NO2 + H2O | +0.80 | |
| 2NO2 + 8H+ + 8e ® N2 + 4H2O | +1.35 | |
| HNO2 + H+ + e ® NO + H2O | +0.98 | |
| 2HNO2 + 4H+ + 4e ® N2O + 3H2O | +1.29 | |
| 2HNO2 + 6H+ + 6e ® N2 + 4H2O | +1.44 | |
| O | H2O2 + 2H+ +2e ® 2H2O | +1.16 |
| HO2- + H2O + 2e ® 3OH- | +1.08 | |
| O2 + 4H+ + 4e ® 2H2O | +1.23 | |
| O2 + H2O + 4e ® 4OH- | +0.40 | |
| O2 + 2H+ + 2e ® H2O2 | +0.69 | |
| Pb | Pb2+ + 2e ® Pb | -0.13 |
| PbO2 + 4H+ + 2e ® Pb2+ + 2H2O | +1.46 | |
| S | S + 2e ® S2- | -0.48 |
| S + 2H+ + 2e ® H2S | +0.14 | |
| SO42- + 4H+ +2e ® H2SO4 + H2O | +0.17 | |
| SO42- + 8H+ + 6e ® S + 4H2O | +0.36 | |
| SO42- + H2O + 2e ® SO32- + 2OH- | -0.93 | |
| SO42- + 10H+ + 8e ® H2S + 4H2O | +0.30 | |
| S2O82- + 2e ® 2SO42- | +2.01 | |
| S4O62- + 2e ® 2S2O32- | +0.22 | |
| H2SO3 + 4H+ + 4e ® S + 3H2O | +0.45 | |
| Sn | Sn4+ + 2e ® Sn2+ | +0.15 |
Таблица 5.
Константы нестойкости некоторых комплексных ионов
| Ион | Комплексный ион | Kнест. | Ион | Комплексный ион | Kнест. |
| Ag+ | [Ag(NH3)2]+ | 6.1  10-8 10-8
| Cu2+ | CuCl42- | 6.60  10-6 10-6
|
| [Ag(SCN)4]3- | 6.6  10-12 10-12
| [Cu(NH3)4]2+ | 9.35  10-13 10-13
| ||
| [Ag(S2O3)3]5- | 7.1  10-15 10-15
| [Cu(SCN)4]2- | 3.02  10-7 10-7
| ||
| [Ag(CN)4]3- | 3.8  10-20 10-20
| [Cu(S2O3)3]5- | 1.45  10-14 10-14
| ||
| [Ag(EDTA)]3- | 4.7  10-8 10-8
| [Cu(EDTA)]2- | 1.58  10-19 10-19
| ||
| Al3+ | [Al(OH)4] - | 1.00  10-33 10-33
| Fe2+ | [Fe(CN)6]4- | 1.00  10-24 10-24
|
| [AlF6]3- | 2.1  10-21 10-21
| [Fe(EDTA)]2- | 4.67  10-15 10-15
| ||
| [Al(EDTA)] - | 7.4  10-17 10-17
| Fe3+ | [Fe(SCN)6]3- | 5.88  10-4 10-4
| |
| Ba2+ | [Ba(EDTA)]2- | 1.6  10-8 10-8
| [FeF6]3- | 7.94  10-17 10-17
| |
| Ca2+ | [Ca(EDTA)]2- | 2.69  10-11 10-11
| [Fe(CN)6]3- | 1.00  10-31 10-31
| |
| Co2+ | [Co(NH3)6]2+ | 4.08  10-5 10-5
| [Fe(EDTA)] - | 7.94  10-26 10-26
| |
| [Co(SCN)4]2- | 6.29  10-3 10-3
| Mg2+ | [Mg(EDTA)]2- | 2.04  10-9 10-9
| |
| [Co(EDTA)]2- | 6.17  10-17 10-17
| Mn2+ | [Mn(EDTA)]2- | 9.09  10-15 10-15
| |
| Co3+ | [Co(NH3)6]3+ | 2.19  10-34 10-34
| Pb2+ | [Pb(OH)3]- | 5.00  10-12 10-12
|
| [Co(NO2)6]3- | 1.00  10-22 10-22
| [Pb(EDTA)]2- | 9.09  10-19 10-19
| ||
| [Co(EDTA)]- | 1.00  10-36 10-36
| Sn2+ | [Sn(OH)3] - | 7.41  10-26 10-26
| |
| Cr3+ | [Cr(OH)4]- | 1.26  10-30 10-30
| [SnCl4]2- | 3.31  10-2 10-2
| |
| [Cr(SCN)6]3- | 1.59  10-4 10-4
| Zn2+ | [Zn(NH3)4]2+ | 3.98  10-10 10-10
| |
| [Cr(EDTA)]- | 1.00  10-24 10-24
| [Zn(OH)4]2- | 2.19  10-15 10-15
| ||
| [Zn(EDTA)]2- | 3.16  10-17 10-17
|
Таблица 6.
Плотности растворов соляной кислоты различных концентраций
| r, г / мл | w, % | r, г / мл | w, % | r, г / мл | w, % |
| 1,010 | 2,14 | 1,065 | 13,19 | 1,120 | 23,82 |
| 1,015 | 3,12 | 1,070 | 14,17 | 1,125 | 24,78 |
| 1,020 | 4,13 | 1,075 | 15,16 | 1,130 | 25,75 |
| 1,025 | 5,15 | 1,080 | 16,15 | 1,135 | 26,70 |
| 1,030 | 6,15 | 1,085 | 17,13 | 1,140 | 27,66 |
| 1,035 | 7,15 | 1,090 | 18,11 | 1,145 | 28,61 |
| 1,040 | 8,16 | 1,095 | 19,06 | 1,150 | 29,57 |
| 1,045 | 9,16 | 1,100 | 20,01 | 1,160 | 31,52 |
| 1,050 | 10,17 | 1,105 | 20,97 | 1,165 | 32,49 |
| 1,055 | 11,19 | 1,110 | 21,92 | 1,175 | 34,42 |
| 1,060 | 12,18 | 1,115 | 22,86 | 1,200 | 39,11 |
Пример интерполяции
Пусть требуется найти массовую долю (wх) раствора соляной кислоты плотностью rх = 1,142 г/мл. В табл. 6 такого значения плотности нет, но есть близкие к нему значения:
rmin = 1,140 г/мл wmin = 27,66 %
rmax = 1,145 г/мл wmax = 28,61 %
Значение wх, соответствующее плотности rх = 1,142 г/мл, можно рассчитать по следующей формуле:
wх = wmin + 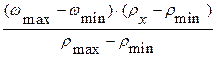 =
=
= 27,66 % + 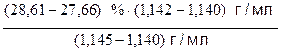 = 28,04%
= 28,04%
Таблица 7.
Растворимость некоторых оснований и кислот в воде
| NH4+ | Na+ | K+ | Mg2+ | Ca2+ | Ba2+ | Al3+ | Cr3+ | Zn2+ | Mn2+ | |
OH 
| р | р | р | м | м | р | н | н | н | н |
F 
| р | р | р | н | н | м | м | н | м | м |
Cl 
| р | р | р | р | р | р | р | р | р | р |
Br 
| р | р | р | р | р | р | р | р | р | р |
I 
| р | р | р | р | р | р | р | р | р | р |
S2 
| р | р | р | р | м | р | - | - | н | н |
SO32 
| р | р | р | н | н | н | - | - | н | н |
SO42 
| р | р | р | р | м | н | р | р | р | р |
NO3 
| р | р | р | р | р | р | р | р | р | р |
PO43 
| р | р | р | н | н | н | н | н | н | н |
CO32 
| р | р | р | н | н | н | - | - | н | н |
SiO32 
| - | р | р | н | н | н | н | н | р | н |
CH3COO 
| р | р | р | р | р | р | м | р | р | р |
| Co2+ | Ni2+ | Fe2+ | Fe3+ | Cd2+ | Hg2+ | Cu2+ | Ag+ | Sn2+ | Pb2+ | |
OH 
| н | н | н | н | н | - | н | - | н | н |
F 
| р | р | н | н | р | - | н | р | р | н |
Cl 
| р | р | р | р | р | р | р | н | р | м |
Br 
| р | р | р | р | р | м | р | н | р | м |
I 
| р | р | р | р | р | н | р | н | р | н |
S2 
| н | н | н | - | н | н | н | н | н | н |
SO32 
| н | н | н | - | н | н | н | н | - | н |
SO42 
| р | р | р | р | р | р | р | м | р | р |
NO3 
| р | р | р | р | р | р | р | р | - | р |
PO43 
| н | н | н | н | н | н | н | н | н | н |
CO32 
| н | н | н | н | н | н | н | н | - | н |
SiO32 
| н | н | н | н | н | - | н | н | - | н |
CH3COO 
| р | р | р | р | р | р | р | р | р | р |
р - растворимое вещество (растворимость свыше 1 г в 100 г воды); м - малорастворимое вещество (растворимость от 0,1 до 1 г в 100 г воды); н - практически не растворимое вещество (растворимость меньше 0,1 г в 100 г воды); прочерк означает, что вещество не существует или разлагается водой.
СОДЕРЖАНИЕ
Стр.
| РЕКОМЕНДАЦИИ К ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ........................................... | 3 |
| Семинар 1 Основные классы неорганических соединений…………………………………………………. | 6 |
| Лабораторная работа 1 Скорость химической реакции. Химическое равновесие ........................................................ | 7 |
| Лабораторная работа 2 . Приготовление раствора соляной кислоты……………………………………….. | 16 |
| Лабораторная работа 3 . Стандартизация раствора соляной кислоты………………………………………. | 22 |
| Семинар 2 . Строение атома. Периодический закон Д.И.Менделеева. Химическая связь…................................ | 27 |
| Лабораторная работа 4 . Ионные и гетерогенные равновесия в растворах.………………………........ | 29 |
| Лабораторная работа 5 . рН растворов. Гидролиз солей…………………........................................................ | 39 |
| Лабораторная работа 6 . Буферные растворы……………………………………………….. | 47 |
| Лабораторная работа 7 . Коллоидные растворы …… | 52 |
| Лабораторная работа 8 . Комплексные соединения… | 61 |
| Лабораторная работа 9 . Окислительно-восстановительные реакции........................................... | 67 |
| Семинар 3 Гальванические элементы. Коррозия металлов и сплавов………………………………………. | 76 |
| Семинар 4 Изомерия органических соединений……….. | 78 |
| Лабораторная работа 10 . Химические свойства углеводородов………………………………………….. | 80 |
| Лабораторная работа 11 . Спирты и фенолы……………………………………………………. | 87 |
| Лабораторная работа 12. Альдегиды и кетоны……….. | 92 |
| Лабораторная работа 13 . Карбоновые кислоты. Аминокислоты……………………………………….. | 96 |
| ПРОГРАММА КУРСА……………………………………. | 102 |
| ПРИЛОЖЕНИЯ………………………………………… | 110 |
Дата: 2019-02-02, просмотров: 414.