Теоретические основы . Вода - слабый электролит, диссоциирует в незначительной степени с образованием ионов водорода Н+ и гидроксил-анионов ОН  : Н2О
: Н2О  Н++ОН
Н++ОН  .
.
Состояние равновесия этой реакции характеризуется константой, которая называется ионное произведение воды:
К 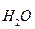 = [Н+ ]
= [Н+ ] 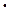 [ОН
[ОН  ] = 10
] = 10  14 (при 220С),
14 (при 220С),
где [Н+ ] и [ОН  ] - равновесные концентрации ионов.
] - равновесные концентрации ионов.
Обычно вместо величин [Н+] и [ОН  ] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
рН = - lg [Н+ ]
рОН = - lg [ОН  ]
]
рК 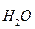 = рН + рОН = 14
= рН + рОН = 14
Нейтральные растворы не имеют избытка ионов  Н+ или ОН
Н+ или ОН  : [Н+ ] = [ОН
: [Н+ ] = [ОН  ] = 10
] = 10  7 ; рН = рОН = 7
7 ; рН = рОН = 7
Кислые растворы содержат избыток ионов Н+:
[Н+ ]> [ОН  ]; рН< рОН; рН<7; рОН>7
]; рН< рОН; рН<7; рОН>7
Щелочные растворы содержат избыток ионов ОН  :
:
[Н+ ]< [ОН  ]; рН> рОН; рН>7; рОН<7
]; рН> рОН; рН>7; рОН<7
Если растворенная в воде соль содержит ионы-остатки слабых кислот или слабых оснований, то происходит процесс гидролиза соли - обменной реакции ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых слабых электролитов.
Основные правила написания реакций гидролиза:
1. Гидролизу подвергаются анионы слабых кислот и катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по первой ступени. Гидролиз усиливается при нагревании и разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его равновесие можно смещать. Добавление одноименных ионов (Н+ или ОН  ), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН
), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН  в молекулы воды, смещает равновесие в сторону усиления гидролиза.
в молекулы воды, смещает равновесие в сторону усиления гидролиза.
Типы реакций гидролиза.
1. Соль образована ионами сильного основания и сильной кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O 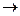 гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
2. Соль образована ионами сильного основания и слабой кислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О 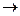 гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
CO32  + HOH
+ HOH 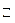 HCO3
HCO3  + OH
+ OH  (среда щелочная, рН>7).
(среда щелочная, рН>7).
Na2CO3+ HOH 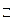 NaHCO3 + NaOH (1 ступень гидролиза).
NaHCO3 + NaOH (1 ступень гидролиза).
Добавление к раствору сильных щелочей (NaOH), содержащих одноименные ионы (OH  ), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH
), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH 
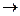 Н2О, в результате которой концентрация ионов OH
Н2О, в результате которой концентрация ионов OH  в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
Н CO 3  + HOH
+ HOH  H 2 CO 3 + OH
H 2 CO 3 + OH 
Na Н CO 3 + HOH 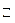 H 2 CO 3 + NaOH (2 ступень гидролиза).
H 2 CO 3 + NaOH (2 ступень гидролиза).
3. Соль образована ионами слабого основания и сильной кислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O 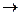 гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
Al3+ + HOH 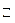 AlOH2+ + H+ (среда кислая, рН<7)
AlOH2+ + H+ (среда кислая, рН<7)
AlCl3 + HOH 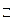 AlOHCl2 + HCl (1 ступень гидролиза).
AlOHCl2 + HCl (1 ступень гидролиза).
4. Соль образована ионами слабого основания и слабой кислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O 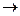 гидролиз идет сразу по катиону и аниону:
гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32  + HOH
+ HOH 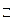 NH4OH + HCO3
NH4OH + HCO3  + NH4+
+ NH4+
( рН  7)
7)
(NH4)2CO3 + HOH 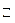 NH4OH + NH4HCO3
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O 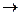 нерастворимые соли гидролизу не подвергаются;
нерастворимые соли гидролизу не подвергаются;
в) соль разлагается водой (в таблице растворимости стоит прочерк, например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет необратимо и до конца: Fe2S3+6H2O 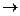 2Fe(OH)3
2Fe(OH)3 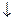 +3H2S
+3H2S 
Цель работы. C помощью универсальной индикаторной бумаги определить реакцию среды водных растворов солей, изучить влияние температуры и концентрации на гидролиз, взаимное усиление гидролиза растворов различных солей.
Порядок работы.
Опыт 1. Определение рН в кислых, щелочных и
нейтральных средах
На предметное стекло положите небольшие кусочки универсальной индикаторной бумаги и стеклянными палочками нанесите на них по капле дистиллированной воды, растворов NaOH, NH4OH, HCl, CH3COOH. С помощью цветовой шкалы определите рН в нейтральной, щелочной и кислой средах.
Опыт 2. Определение реакции среды при гидролизе солей
В отдельные пробирки добавьте по нескольку кристалликов следующих солей: нитрата натрия, сульфита натрия, нитрата цинка, ацетата аммония. Растворите соли в 1-2 мл дистиллированной воды. На предметное стекло положите кусочки универсальной индикаторной бумаги и определите рН растворов солей.
Опыт 3. Влияние температуры на гидролиз
Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли фенолфталеина. Разделите раствор на 2 пробирки и одну из них нагрейте на водяной бане. Сравните интенсивность окраски индикатора в обеих пробирках.
Опыт 4. Влияние концентрации раствора соли на гидролиз
Налейте в пробирку 1 мл раствора хлорида сурьмы и добавьте дистиллированной воды. Выпадение белого осадка связано с разложением хлорида дигидроксосурьмы, образующейся за счет гидролиза соли по второй ступени: Sb(OH)2Cl 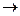 SbOCl
SbOCl 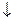 + H2O
+ H2O
Добавьте в пробирку раствор соляной кислоты до растворения осадка. Объясните смещение равновесия реакции гидролиза.
Опыт 5. Взаимное усиление гидролиза
Налейте в пробирку 1 мл раствора хлорида алюминия и добавьте равное количество раствора карбоната натрия. Объясните взаимное усиление гидролиза солей, приводящее к выделению оксида углерода (IV) и образованию осадка гидроксида алюминия. Используя амфотерные свойства гидроксида алюминия, докажите его образование.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
Опыт 1. Определение рН в кислых, щелочных и
нейтральных средах
| Исследуемое вещество | Цвет универсальной индикаторной бумаги | рН | Реакция среды |
Опыт 2. Определение реакции среды при гидролизе солей
| Исследуемое вещество | рН раствора | Реакция среды | Уравнение реакции гидролиза соли в молекулярном и ионном видах |
Опыты 3-5 оформите по схеме:
а) название опыта;
б) уравнение реакций в молекулярной и ионной формах;
в) наблюдения и обсуждения;
г) выводы.
Типовые задачи.
1. Напишите в молекулярной и ионно-молекулярной формах уравнения реакций гидролиза следующих солей: ZnCl2, Fe(NO3)3, CH3COOK, MnSO4, Na3PO4, K2S, NH4Cl, (NH4)2CO3, Al2S3. Укажите реакцию среды.
2. Рассчитайте концентрацию ионов водорода в водном растворе, в котором концентрация ионов ОН- равна 3,9×10-9 моль/л.
3. Найти рН 0,0001 М раствора КОН при условии его полной диссоциации.
4. Найти рН 0,1 М раствора соляной кислоты при условии ее полной диссоциации.
5. Найти рН 0,005 М раствора H2SO4 при условии полной диссоциации.
6. Найти рН 0,5 М раствора Ва(ОН)2 при условии полной диссоциации.
7. Найти рН и степень диссоциации 0,1 М раствора СН3СООН, если константа ее диссоциации К = 1,8 10-5.
8. Найти рН и степень диссоциации 0,001 М раствора NH4OH, если константа его диссоциации К = 1,75 10-5.
9. Найти рОН 0,079 M раствора НСN (К= 7,9 ·10-10).
10. Найти рОН 0,05 M раствора НСlО (К= 5 ·10-8).
11. Смешали 1 л 0,001 М раствора азотной кислоты и 1 л 0,0008 М раствора гидроксида натрия. Найти рН полученного раствора.
12. Смешали 1 л 0,03 М раствора HCl и 1 л 0,028 М раствора КОН. Найти рН полученного раствора.
Лабораторная работа 6
Буферные растворы
Теоретические основы . Буферные растворы используют для поддержания постоянной величины рН в исследуемом растворе при добавлении к нему небольших количеств сильной кислоты, сильного основания или при разбавления раствора.
В качестве буферных растворов обычно используют смеси растворов слабых кислот или слабых оснований и их солей или смеси солей многоосновных кислот различной степени замещения. В таблице приведены примеры наиболее часто используемых буферных растворов и величины рН, которые они поддерживают:
| Состав буферного раствора | Название буфера | рН |
| Смесь СН3СООН и СН3СООNа | Ацетатный буфер | 4,7 |
| Смесь NаН2РО4 и Nа2НРО4 | Фосфатный буфер | 6,5 |
| Смесь NН4ОН и NН4С1 | Аммиачный буфер | 9,25 |
Буферная система может связывать как ионы Н+, так и ОН- приливаемых сильных кислот и оснований в слабые электролиты, незначительно изменяя величину рН раствора.
Пример: Ацетатный буферный раствор содержит смесь CH3COOH и CH3COONa. Диссоциация слабого электролита – уксусной кислоты – отражается уравнением реакции: CH3COOH 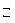 CH3COO
CH3COO  + H+ и описывается константой равновесия:
+ H+ и описывается константой равновесия:
Ka= 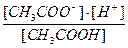 = 1.8 10
= 1.8 10 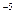
При добавлении ацетата натрия концентрация ионов CH3COO 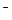 возрастает и определяется концентрацией соли: [CH3COO
возрастает и определяется концентрацией соли: [CH3COO 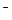 ]
] 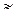 Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH]
Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH] 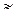 Cк, где Cк – концентрация кислоты.
Cк, где Cк – концентрация кислоты.
Ka= 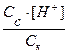 ;
;
[H+] = Ka  ;
;
pH = -lg[H+] = pKa - lg (  ),
),
где pKa = - lg Ka .
Таким образом, рН буферных растворов не зависит от концентраций компонентов, а определяется их отношением.
При добавлении небольших количеств сильных кислот и оснований компоненты буферного раствора реагируют с ними, переводя их в слабые электролиты:
CH3COOH + NaOH = CH3COONa + H2O (концентрация соли увеличивается на концентрацию добавленной щелочи, а концентрация кислоты уменьшается на ту же величину):
pH = -lg[H+] = pKa - lg ( 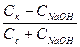 );
);
CH3COONa + HCl = CH3COOH + NaCl,
pH = -lg[H+] = pKa - lg ( 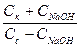 ).
).
Так как отношение концентраций изменяется меньше, чем их сумма или разность, общее значение рН изменяется незначительно.
Количество сильной кислоты или сильного основания, которые нужно добавить к буферному раствору для изменения рН одного литра его раствора на единицу, называют буферной емкостью ( B ). Она может быть вычислена относительно кислоты (B а) или основания (Bb).
Ba = 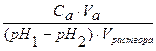
Bb = 
где Ba и Bb – буферные емкости по кислоте и основанию соответственно; Ca и Cb – концентрации добавленных кислоты и основания; pH 1 и pH 2 – исходные и конечные значения рН раствора; Va and Vb – объемы добавленных сильных кислоты и основания.
Цель работы. Изучить свойства буферных растворов.
Порядок работы.
Опыт. Определение рН буферных растворов
1. Приготовьте ацетатные буферные растворы, содержащие различные количества компонентов, согласно приведенной таблице:
|
| Буферный раствор | |||
| 1 | 2 | 3 | 4 | |
| Объем кислоты, мл | 10 | 18 | 6 | 2 |
| Объем соли, мл | 10 | 2 | 14 | 18 |
| Cк/Cс=Vк /Vс | ||||
| pH (измеренный) | ||||
| pH (рассчитанный) | ||||
2. Используя рН-метр, измерьте рН буферных растворов и занесите результаты в таблицу.
3. Используя теоретические формулы, рассчитайте рН буферных растворов и занесите результаты в таблицу. Сравните полученные результаты.
Форма лабораторного отчета
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Заполненная таблица.
5. Расчеты рН и буферной емкости.
6. Обсуждения.
7. Выводы.
Типовые задачи.
1. Напишите уравнения реакций, происходящих в аммиачном буферном растворе при добавлении к нему небольших количеств а) - соляной кислоты и б) - гидроксида натрия.
2. Вычислите рН формиатного буферного раствора, содержащего в 1 л 0,1 моль муравьиной кислоты и 0,01 моль формиата калия.
3. Вычислите рН аммиачного буферного раствора, содержащего 1 М раствор гидроксида аммония и 0,001 М раствор хлорида аммония.
4. Вычислите рН аммиачного буферного раствора, содержащего в 500 мл 5,25 г гидроксида аммония и 4,01 г хлорида аммония.
5. Вычислите рН ацетатного буферного раствора, содержащего в 1 л 0,25 моль уксусной кислоты и 0,12 моль ацетата натрия после добавления к нему 0,02 моль гидроксида калия.
6. После добавления 5 мл 0,1 М раствора соляной кислоты к 100 мл ацетатного буферного раствора его рН изменился от 4,50 до 4,35. Вычислите буферную емкость раствора.
7. Как изменится рН при добавлении 1 мл 1 М раствора HСl: а) к 100 мл Н2О; б) к 100 мл буферной смеси, содержащей 0,1 М СН3СООН и 0,1 М СН3СООNа. Изменением объема можно пренебречь.
Лабораторная работа 7
Коллоидные растворы
Теоретические основы. Коллоидные системы – это ультрамикрогетерогенные системы, состоящие из двух фаз: дисперсионной среды и дисперсной фазы. Дисперсная фаза коллоидных растворов состоит из молекулярных агрегатов размером 10 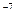 - 10
- 10 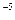 cм.
cм.
Дата: 2019-02-02, просмотров: 374.