Теоретические основы .
Окислительно-восстановительными называются реакции, при которых происходит переход электронов от одних частиц (атомов, молекул или ионов) к другим, в результате чего изменяется степень окисления данных частиц. Процесс отдачи электронов называется окислением; вещество, атомы которого отдают электроны, называется восстановителем. Восстановительными свойствами обладают, как правило, молекулы водорода, атомы металлов в свободном состоянии, а также ионы, в которых элемент находится в низшей или промежуточной степени окисления. В лаборатории в качестве восстановителей обычно применяют H2, KI, H2S, HNO2 .
Процесс присоединения электронов называется восстановлением, а восстанавливающаяся частица - окислителем. Окислителями часто являются молекулы и ионы, содержащие элемент в высшей степени окисления, например: MnO4  , Cr2O72
, Cr2O72  , Ni 3+ и т.д.
, Ni 3+ и т.д.
В том случае, когда соединения содержат элементы в промежуточных степенях окисления, можно говорить об их окислительно-восстановительном дуализме (H 2 O 2 , Na 2 SO 3 , NaNO 2 и др.).
Окислительно-восстановительные свойства вещества определяют по их окислительной способности, численно выражаемой через редокс-потенциал j , который рассчитывается по уравнению Нернста:
 j = j 0 +
j = j 0 +  lg(Cок / C восст) ,
lg(Cок / C восст) ,
где j 0 - стандартный электродный потенциал данного процесса, n- количество принятых электронов, Cок и C восст - концентрации окисленной и восстановленной форм соответственно.
Чем больше значение j, тем сильнее окислительные свойства окисленной формы данного соединения.
Направление окислительно-восстановительной реакции определяется по величине электродвижущей силы ( E ):
E = j (ок) - j (вос)
Если E > 0, прямая реакция возможна. Если E < 0, прямая реакция невозможна (реакция идет в обратном направлении).
Стандартная электродвижущая сила E 0 связана со стандартной энергией Гиббса D G 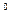
nFE 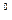 = - D G
= - D G 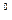
С другой стороны, D G 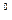 определяет константу равновесия реакции K:
определяет константу равновесия реакции K:
D G 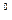 = - 2.3 RT lg K
= - 2.3 RT lg K
Таким образом,
nFE 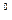 = 2.3 RT lg K
= 2.3 RT lg K
При температуре 25 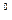 C (298 K), уравнение принимает вид:
C (298 K), уравнение принимает вид:
lg K = 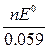 .
.
Все окислительно-восстановительные реакции можно разделить на три группы:
1). реакции межмолекулярного окисления-восстановления - это реакции, в которых обмен электронами происходит между атомами, находящимися в различных молекулах: Fe + CuSO4 = FeSO4 + Cu .
2). реакции внутримолекулярного окисления-восстановления - в таких реакциях окислитель и восстановитель находятся в одном и том же веществе: 2КClO3 = 2KCl + 3O2.
3). реакции диспропорционирования, в которых одни и те же атомы в молекулах взаимодействуют друг с другом как окислитель с восстановителем, вследствие того, что эти атомы имеют промежуточные степени окисления и являются одновременно окислителем и восстановителем:
3 К 2 MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
Cоставление уравнений реакций окислисления-восстановления.
Метод полуреакций основан на составлении ионных уравнений для процессов окисления и восстановления с учетом рН среды данной реакции, оказывающей определенное влияние на направление протекания реакции. Сильные электролиты в данном методе записываются в виде ионов, слабые - в виде молекул. В ионную схему включают ионы и молекулы, проявляющие окислительно-восстановительные свойства, а также ионы, характеризующие среду (в кислой среде - ионы Н+ и молекулы воды, в щелочной среде - ионы ОН  и молекулы воды, в нейтральной среде - молекулы воды, ионы Н+ или ОН
и молекулы воды, в нейтральной среде - молекулы воды, ионы Н+ или ОН  ):
):
Ca + HNO3 ( разб ) 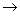 NH4NO3 + ...
NH4NO3 + ...
 Ca0 - 2 e
Ca0 - 2 e 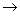 Ca2+
Ca2+  4
4
NO3  + 10H+ + 8 e
+ 10H+ + 8 e 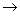 NH4+ + 3H2O
NH4+ + 3H2O 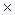 1
1

4Ca0 + NO3  + 10H+
+ 10H+ 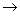 4Ca2+ + NH4+ + 3H2O
4Ca2+ + NH4+ + 3H2O
4Ca + 10HNO3 ( разб ) 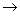 4Ca(NO3)2 + NH4NO3 + 3H2O
4Ca(NO3)2 + NH4NO3 + 3H2O
Примеры некоторых полуреакций с участием наиболее типичных окислителей и восстановителей:
Дата: 2019-02-02, просмотров: 304.