Теоретические основы . Вещества, которые в расплавах или растворах полярных растворителей диссоциируют на ионы, называют электролитами: Na2CO3  2 Na+ + CO3
2 Na+ + CO3 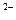
Процесс диссоциации количественно характеризуют степенью диссоциации:
a = 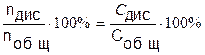 ,
,
где n - количество вещества, С - концентрация.
Если степень диссоциации электролита a > 30%, то такой электролит называется сильным. К сильным электролитам относятся соли, сильные кислоты (HCl, H2SO4, HNO3, HClO4 и некоторые другие), щелочи (основания щелочных и щелочноземельных металлов NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2). Диссоциация сильных электролитов протекает необратимо и в одну стадию. Например:
Al 2 ( SO 4 )3 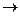 2 Al 3+ + 3 SO 4
2 Al 3+ + 3 SO 4 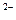
Если степень диссоциации электролита a < 3%, то электролит называют слабым. К слабым электролитам относятся молекулы воды, гидроксида аммония NH4OH, слабых кислот и оснований. Диссоциация слабых электролитов - процесс обратимый и ступенчатый, для него устанавливается состояние химического равновесия, которое характеризуется константой равновесия - константой диссоциации.
Например, диссоциация фосфорной кислоты - трехступенчатый процесс:
H3PO4 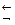 H+ + H2PO
H+ + H2PO 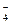
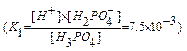
H2PO4- 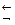 H+ + HPO
H+ + HPO 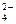
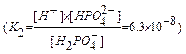
HPO 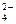
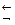 H+ + PO
H+ + PO 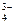
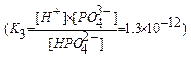
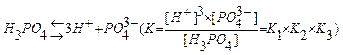
[H+], [H2PO4 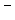 ], [HPO4
], [HPO4 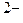 ], [PO4
], [PO4 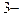 ], [H3PO4] - равновесные концентрации ионов; К1, К2, К3 - ступенчатые константы диссоциации; К - общая константа диссоциации.
], [H3PO4] - равновесные концентрации ионов; К1, К2, К3 - ступенчатые константы диссоциации; К - общая константа диссоциации.
Константа диссоциации слабого электролита не зависит от его концентрации, но возрастает с повышением температуры. Чем меньше величина константа диссоциации, тем слабее электролит.
Для слабого бинарного электролита AB, который диссоциирует с образованием ионов A+ и B 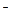 , константа диссоциации связана со степенью диссоциации (закон разбавления Оствальда):
, константа диссоциации связана со степенью диссоциации (закон разбавления Оствальда):
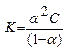
Добавление в раствор слабых электролитов одноименных ионов вызывает смещение равновесия реакции диссоциации в сторону ее уменьшения (эффект одноименного иона).
Концентрации ионов в растворах сильных электролитов велики, поэтому ионы взаимодействуют друг с другом. Это приводит к уменьшению их подвижности. Кажущаяся концентрация ионов, проявляющаяся в их взаимодействии, носит название активности ионов:
a = f 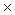 . C , где a – активность; f – коэффициент активности.
. C , где a – активность; f – коэффициент активности.
Коэффициент активности определяется составом и концентрацией ионов в растворе, а также их зарядом:
lg f = - 0.5 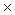 Z2
Z2 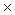 I1/2
I1/2
I = 0.5 (C1 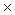 z12 + C2
z12 + C2 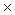 z22 + C3
z22 + C3 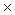 z32 + ... + Ci
z32 + ... + Ci 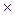 zi 2 )
zi 2 )
где z – заряд иона; I – ионная сила раствора; C – концентрация иона в растворе.
Обменные реакции в растворах происходят между ионами сильных электролитов и молекулами слабых электролитов. Равновесие реакций обмена в растворах смещено в сторону образования осадков, газов, молекул слабых электролитов.
В ионном виде реакции обмена записывают следующим образом: сильные растворимые в воде электролиты пишут в виде ионов; слабые электролиты, осадки и газы записывают в виде молекул:
2 NaNO 2 + H 2 SO 4  Na 2 SO 4 + 2 HNO 2
Na 2 SO 4 + 2 HNO 2
растворимая сильная растворимая слабая
в воде соль кислота в воде соль кислота
(реакция в молекулярном виде)
2Na++2NO2 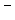 +2H++SO42
+2H++SO42 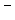
 2Na++SO42
2Na++SO42 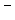 + 2HNO2
+ 2HNO2
(полное ионное уравнение реакции)
2 NO 2 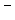 + 2 H +
+ 2 H +  2 HNO 2
2 HNO 2
(сокращенное ионное уравнение реакции)
Свойства химических соединений в растворах определяются характером их диссоциации:
HCl 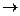 H+ + Cl
H+ + Cl 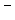 (кислоты при диссоциации дают ионы Н+);
(кислоты при диссоциации дают ионы Н+);
NaOH 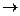 Na++OH
Na++OH 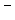 (основания при диссоциации дают ионы ОН
(основания при диссоциации дают ионы ОН 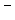 );
);
NaCl 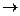 Na++Cl
Na++Cl 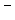 (cоли при диссоциации дают катионы металлов и анионы кислотных остатков).
(cоли при диссоциации дают катионы металлов и анионы кислотных остатков).
Существуют электролиты, которые могут участвовать в химических реакциях как в роли основания, так и в роли кислоты. Такие электролиты называются амфотерными. К ним относятся оксиды и основания некоторых металлов: цинка, алюминия, свинца, олова, хрома(III) и некоторых других. Они способны диссициировать как по типу кислот, так и по типу оснований:
2H2O+Sn2++2OH 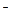
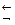 Sn(OH)2
Sn(OH)2 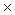 2H2O
2H2O 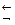 H2[Sn(OH)4]
H2[Sn(OH)4] 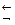 2H+ +Sn(OH)4]2
2H+ +Sn(OH)4]2 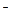
3H2O+Al3++30H 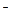
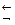 Al(OH)3
Al(OH)3 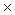 3H2O
3H2O 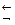 H3[Al(OH)6]
H3[Al(OH)6] 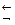 3H+ +Al(OH)6]
3H+ +Al(OH)6] 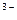
Добавление сильных кислот и оснований смещает равновесие в одну из сторон (амфотерные основания реагируют как с кислотами, так и с основаниями, образуя в качестве продуктов реакции соли):
Al(OH)3¯ + 3HCl 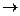 AlCl3 + 3H2O
AlCl3 + 3H2O
Al(OH)3¯ + NaOH 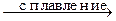 NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3¯ + 3NaOH 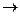 Na3[Al(OH)6]
Na3[Al(OH)6]
Sn(OH)2¯ + 2HCl 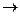 SnCl2 + 2H2O
SnCl2 + 2H2O
Sn(OH)2¯ + 2NaOH 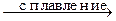 Na2SnO2 + 2H2O
Na2SnO2 + 2H2O
Sn(OH)2¯ + 2NaOH 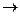 Na2[Sn(OH)4]
Na2[Sn(OH)4]
В насыщенном растворе малорастворимого вещества между твердой фазой и раствором устанавливается динамическое равновесие, которое можно представить уравнением:
CaCO3(т.) 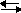 Ca2+ + CO32-
Ca2+ + CO32-
Для этого уравнения, используя закон действия масс, запишем выражение константы равновесия
К = 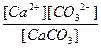
где [Ca2+], [CO32-] - равновесные концентрации ионов в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе), она постоянна.
Умножив К на постоянную величину [CaCO3], получим константу, называемую произведением растворимости, Ksp - произведение равновесных концентраций ионов малорастворимого вещества в степенях их химических коэффициентов :.
К×[CaCO3] = Ksp = [Ca2+]× [CO32-]
В присутствии одноименных ионов равновесие диссоциации смещается в сторону образования осадка (эффект одноименного иона). В присутствии сильных электролитов, не содержащих общих ионов, подвижность ионов в растворе уменьшается и равновесие смещается в сторону большего растворения осадка (солевой эффект).
Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного соединения. [Ca2+] [CO32-] > Ksp (CaCO3).
Условие растворения осадка: произведение концентраций ионов в растворе меньше, чем величина произведения растворимости данного соединения ([Ca2+] [CO32-] < Ksp(CaCO3) ).
Существует связь между произведением растворимости и растворимостью малорастворимого вещества
Обозначим молярную растворимость вещества через “S” . Тогда раствор CaCO3 будет содержать катионов [Ca2+]=S (моль/л), анионов - [CO32-]=S (моль/л). Подставим эти обозначения в выражение произведения растворимости:
Ksp = S ·S= S2,
отсюда находим растворимость S:
 S=ÖKsp , моль/л
S=ÖKsp , моль/л
Цель работы. Изучить реакции, идущие в растворах электролитов, и условия их смещения.
Порядок работы.
Опыт 1. Ослабление диссоциации слабого электролита(эффект одноименного иона)
а) В пробирку налейте 4 мл разбавленной уксусной кислоты и добавьте 2 капли метилоранжа. Отлейте половину раствора в другую пробирку и добавьте в нее несколько кристаллов ацетата натрия. Сравните цвет растворов в пробирках.
б) В пробирку налейте 4 мл разбавленного водного раствора аммиака и добавьте 2 капли фенолфталеина. Отлейте половину раствора в другую пробирку и добавьте в нее несколько кристаллов хлорида аммония. Сравните цвет растворов в пробирках.
Опыт 2. Образование слабого электролита
В одну пробирку налете 5-6 капель раствора ацетата натрия СH3COONa, а в другую - столько же раствора хлорида аммония NH4Cl. В первую пробирку прибавьте несколько капель 2н раствора HCl, а во вторую - несколько капель 2н раствора NaOH. Пробирки нагрейте на водяной бане и испытайте на запах. Напишите молекулярные и ионные уравнения реакций:
Опыт 3. Амфотерные основания
а) В пробирку налейте 3 мл раствора хлорида цинка. Осторожно добавьте 2 капли раствора гидроксида натрия до образования осадка гидроксида цинка. Разделите осадок на 2 части и испытайте его растворимость в соляной кислоте и гидроксиде натрия. Запишите наблюдения.
б) Повторите опыт, используя соль хрома (III). Отметьте изменение цвета раствора.
Опыт 4. Образование и растворение осадка
В пробирку налейте 3-4 капли любой соли кальция и добавьте раствор оксалата аммония до образования осадка. Далее астворите осадок в соляной кислоте. Сравните значение констант диссоциации щавелевой кислоты и константу растворимости оксалата кальция. Сделайте вывод об условиях образования и растворения осадков.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Уравнение реакции: а) в молекулярной форме; б) в полной ионной форме; в) в сокращенной ионной форме.
5. Наблюдения.
6. Обсуждения.
7. Выводы.
Типовые задачи.
1. Напишите уравнения реакций диссоциации следующих электролитов: AlCl3, H2SO3, NaHCO3. Для обратимых процессов запишите выражения констант равновесия.
2. Вычислите концентрацию ионов водорода в 0,1 М растворе соляной кислоты, если степень ее диссоциации равна 98%.
3. Закончите уравнения реакций, расставьте коэффициенты, запишите уравнения в ионно-молекулярной и сокращенной форме:
| а) AgNO3 + BaCl2 ® | б) Ca(OH)2 + HCl ® |
| в) Na2SO3 + H2SO4 ® | г) CaCO3 + HNO3 ® |
| д) K2SO4 + NaOH ® | e) Pb(OH)2 + KOH ® |
| ж)Al2(SO4)3+NaOH(изб.)® | з) AgNO3 + H2S ® |
4. Вычислите ионную силу раствора, содержащего смесь 0,01 М AlCl3 и 0,1 М Na2SO4.
5. Вычислите ионную силу раствора, содержащего смесь 0,01 М Cr2(SO4)3 и 1М NaCl.
6. Вычислите активность ионов Са2+ в 0,1 М растворе СаСl2.
7. Вычислите активность ионов Nа+ в 0,1 М растворе Nа3PO4.
8. Константа диссоциации масляной кислоты составляет 1.5 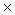 10
10 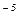 . Рассчитайте степень ее диссоциации и рН в 0,005 М растворе.
. Рассчитайте степень ее диссоциации и рН в 0,005 М растворе.
9. Вычислите концентрацию ацетат-ионов в 0,1 М растворе уксусной кислоты в присутствии 0,01 моль соляной кислоты.
10. Напишите в молекулярном и ионном виде уравнения реакций доказывающих амфотерный характер: Be(OH)2, Cr(OH)3, Pb(OH)2.
Лабораторная работа 5
Дата: 2019-02-02, просмотров: 336.